云南省大理南云龙一中2020届高三下学期4月理综考试化学试题
云南
高三
阶段练习
2020-04-22
327次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、认识化学科学、物质结构与性质、化学反应原理
云南省大理南云龙一中2020届高三下学期4月理综考试化学试题
云南
高三
阶段练习
2020-04-22
327次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、认识化学科学、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 中国古代化学成绩斐然,下列说法错误的是
| A.古代造纸是以木材等为原料,用去除杂质后的纤维素制成的,纤维素属于天然高分子 |
| B.火药是由硫磺、木炭、硝酸钾按照一定比例混合制得的 |
| C.“China”来源于闻名于世的我国陶瓷,陶瓷是一种硅酸盐产品 |
| D.司母戊鼎是商朝铸造的青铜器,它是由纯铜制作的 |
【知识点】 硅酸盐工业解读 淀粉和纤维素组成与结构 常见合金的组成解读
您最近一年使用:0次
2017-03-16更新
|
633次组卷
|
2卷引用:2017届湖南省长郡中学、衡阳八中等十三校重点中学高三第一次联考化学试卷
单选题
|
适中(0.65)
解题方法
2. 下列实验操作能达到实验目的的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蛋白质 | 向待测液中滴入浓硝酸溶液,观察颜色变化 |
| B | 检验NH4+ | 向待测液中滴入氢氧化钠溶液,观察气泡 |
| C | 检验碳碳双键 | 向待测液中滴入酸性高锰酸钾溶液,观察颜色变化 |
| D | 检验K+ | 用洁净的铂丝蘸取待测液,灼烧,直接观察火焰颜色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
3. 设NA为阿伏加 德罗常数的值。下列说法正确的是( )
| A.100g30%CH3COOH溶液中含氢原子数为2NA |
| B.标准状况下,11.2LCCl4中含有的C—Cl键的数目为2NA |
| C.16gO3和O2混合物中含氧原子数为NA |
| D.精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
【知识点】 阿伏加德罗常数的应用解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
4. 具有下列组成和结构特点的有机化合物中同分异构体数目最多的是(不考虑立体异构)
| 选项 | A | B | C | D |
| 分子式 | C4H8Cl2 | C5H10O2 | C4H8O2 | C8H10 |
| 类别 | 含氯化合物 | 羧酸 | 酯 | 含有苯环的烃 |
| A.A | B.B | C.C | D.D |
【知识点】 根据要求书写同分异构体解读 同分异构体的数目的确定解读
您最近一年使用:0次
2018-04-13更新
|
297次组卷
|
6卷引用:黑龙江省大庆实验中学2018届高三上学期期初考试化学试题
单选题
|
适中(0.65)
解题方法
5. 有a、b、c、d四种元素,为原子序数依次增大的前20号元素。a存在a+和a-两种离子,b和c为同一主族元素,c的次外层有8个电子,c2-和d2+的电子层结构相同。下列叙述正确的是( )
| A.b、c与a形成化合物的稳定性一定为c>b |
| B.a和d形成的化合物与水反应产生的气体可以作燃料 |
| C.c、a和b三种元素可形成离子化合物 |
| D.a、b、c、d四种元素组成的化合物的水溶液可以为酸性也可以为碱性 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 根据下图回答,下列说法不正确的是


| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.若a为纯铜,b为粗铜,该装置可用于粗铜的电解精炼 |
| C.燃料电池中正极反应为O2+4e-+2H2O = 4OH- |
| D.电子经导线流入b电极 |
您最近一年使用:0次
2016-12-09更新
|
303次组卷
|
2卷引用:2016届天津市十二区县重点高中高三毕业班第一次联考化学试卷
单选题
|
较难(0.4)
名校
7. pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=-lg (1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是


| A.H2CO3、HCO3-、CO32-不能在同一溶液中大量共存 |
| B.H2CO3电离平衡常数Ka1≈10-6 |
| C.pH=7时,溶液中存在关系(HCO3-)>c(H2CO3)>c(CO32-) |
| D.pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
您最近一年使用:0次
2017-10-16更新
|
834次组卷
|
7卷引用:湖南省邵阳市洞口县第一中学2018届高三上学期第一次月考理科综合化学试题
湖南省邵阳市洞口县第一中学2018届高三上学期第一次月考理科综合化学试题深圳市高级中学2018届高三理科综合测试化学试题【全国百强校】四川省双流中学2018届高三考前第二次模拟考试理综-化学试题(已下线)2018年5月28日 押高考化学第13题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密12 盐类的水解——备战2018年高考化学之高频考点解密(已下线)2019年5月27日《每日一题》四轮复习—— 押高考化学第13题(2)云南省大理南云龙一中2020届高三下学期4月理综考试化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
8. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________ 。
(2)仪器a的名称是________ ,其作用是____________________ 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________ 。检验是否存在该杂质的方法是___________________________ 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:____________ 。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32—+I2=S4O62—+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________ 。
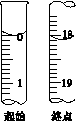
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________ mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________ 。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42—,常用作脱氯剂,该反应的离子方程式为____________ 。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)
 Na2S2O3(aq)
Na2S2O3(aq)实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是
(2)仪器a的名称是
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32—+I2=S4O62—+2I-
(5)滴定至终点时,溶液颜色的变化:
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42—,常用作脱氯剂,该反应的离子方程式为
您最近一年使用:0次
2018-09-16更新
|
294次组卷
|
5卷引用:2016届贵州省贵阳一中高三上学期第三次月考理综化学试卷
2016届贵州省贵阳一中高三上学期第三次月考理综化学试卷云南省玉溪市峨山一中2019届高三9月月考化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (教学案)云南省大理南云龙一中2020届高三下学期4月理综考试化学试题
9. 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位,但近年来对其进行了掠夺性开采。二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如图:
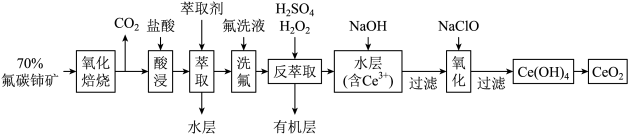
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是__ 。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:__ 。为避免产生上述污染,请提出一种解决方案:__ 。
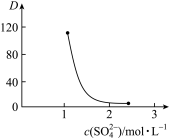
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=
Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D= )。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:
)。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:__ (用平衡移动原理解释)。
(4)若缺少“洗氟”,则所得产品的质量将__ (填“偏大”“偏小”或“不变”)。
(5)“反萃取”中,H2O2作__ (填“催化剂”“氧化剂”或“还原剂”)。
(6)“氧化”步骤的化学方程式为__ 。
(7)取上述流程中得到的CeO2产品0.4000g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为__ 。滴定过程中可能造成实验结果偏低的是__ (填字母)。
A.使用久置的FeSO4标准溶液
B.滴定终点时仰视读数
C.锥形瓶中溶液变色后立刻停止滴定,进行读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡

已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:
(3)“萃取”时存在反应:Ce4++n(HA)2
 Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=
Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D= )。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:
)。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:
(4)若缺少“洗氟”,则所得产品的质量将
(5)“反萃取”中,H2O2作
(6)“氧化”步骤的化学方程式为
(7)取上述流程中得到的CeO2产品0.4000g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为
A.使用久置的FeSO4标准溶液
B.滴定终点时仰视读数
C.锥形瓶中溶液变色后立刻停止滴定,进行读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
您最近一年使用:0次
10. 甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下合成甲醇,发生的反应为CO(g)+2H2(g) CH3OH(l) ΔH=?
CH3OH(l) ΔH=?
(1)已知CO、H2、CH3OH的燃烧热分别为283.0kJ·mol-1、285.8kJ·mol-1、726.5kJ·mol-1,则ΔH=__ 。
(2)在一容积为2L的恒容密闭容器中加入0.2molCO和0.4molH2,发生如下反应:CO(g)+2H2(g) CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。
①由上述数据可以判断:T1__ T2(填“>”“<”或“=”)。
②T1℃时,0~20minH2的平均反应速率v(H2)=__ 。
③该反应在T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是__ (填字母)。
A.改用高效催化剂
B.升高温度
C.缩小容器容积
D.分离出甲醇
E.增加CO的浓度
(3)若保持T2℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应满足的条件:__ 。
(4)当反应在T1℃进行20min时,迅速将0.02molCO、0.04molH2、0.18molCH3OH同时投入体系中,同时将反应体积扩大为原来的2倍,反应在40min时达到平衡,请在图中画出20~40min内容器中H2浓度的变化趋势曲线___ 。

(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__ ;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为__ (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
 CH3OH(l) ΔH=?
CH3OH(l) ΔH=?(1)已知CO、H2、CH3OH的燃烧热分别为283.0kJ·mol-1、285.8kJ·mol-1、726.5kJ·mol-1,则ΔH=
(2)在一容积为2L的恒容密闭容器中加入0.2molCO和0.4molH2,发生如下反应:CO(g)+2H2(g)
 CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示。| 时间 温度/℃ | 10min | 20min | 30min | 40min | 50min | 60min |
| T1 | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| T2 | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
①由上述数据可以判断:T1
②T1℃时,0~20minH2的平均反应速率v(H2)=
③该反应在T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是
A.改用高效催化剂
B.升高温度
C.缩小容器容积
D.分离出甲醇
E.增加CO的浓度
(3)若保持T2℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应满足的条件:
(4)当反应在T1℃进行20min时,迅速将0.02molCO、0.04molH2、0.18molCH3OH同时投入体系中,同时将反应体积扩大为原来的2倍,反应在40min时达到平衡,请在图中画出20~40min内容器中H2浓度的变化趋势曲线

(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
较难(0.4)
名校
解题方法
11. 硅、磷、硫、氯都是第三周期的非金属元素,它们在工农业生产中都有重要的用途。
(1)基态硅原子的电子排布图为_______________ ;硫的基态原子能量最高的电子云在空间有________________ 个伸展方向,原子轨道呈________________ 形。
(2)硅、磷、硫的第一电离能由大到小的顺序为________________ 。
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为________________ ,其分子的空间构型为________________ 。
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为__________ ;PO43-作为___________ 为Fe3+提供________________ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏伽德罗常数的值,则磷化硼晶体的密度为_________ g/cm3。

(1)基态硅原子的电子排布图为
(2)硅、磷、硫的第一电离能由大到小的顺序为
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏伽德罗常数的值,则磷化硼晶体的密度为

您最近一年使用:0次
2017-11-01更新
|
387次组卷
|
2卷引用:重庆市第一中学2018届高三上学期期中考试化学试题
解答题-有机推断题
|
适中(0.65)
解题方法
12. 胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酚为原料制备胡椒乙酸的合成路线如图所示。

回答下列问题:
(1)下列关于有机物B的说法正确的是____________ (填字母)。
a.能与FeCl3溶液发生显色反应
b.核磁共振氢谱中只有3组峰
c.能发生银镜反应
d.能与溴水发生加成反应
(2)C的名称是___________ ,C→D的反应类型是_______ 。
(3)胡椒乙酸(E)中所含官能团的名称为__________ 。
(4)G生成F的化学方程式为_____________ 。
(5)W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成1 mol CO2,已知W的苯环上只有2个取代基,则W的结构共有__________ (不含立体异构)种,其中核磁共振氢谱有五组峰的结构简式为_______ 。
(6)参照上述合成路线,写出以一氯甲苯(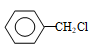 )为原料(无机试剂任选)制备苯乙酸的合成路线:
)为原料(无机试剂任选)制备苯乙酸的合成路线:____________________ 。

回答下列问题:
(1)下列关于有机物B的说法正确的是
a.能与FeCl3溶液发生显色反应
b.核磁共振氢谱中只有3组峰
c.能发生银镜反应
d.能与溴水发生加成反应
(2)C的名称是
(3)胡椒乙酸(E)中所含官能团的名称为
(4)G生成F的化学方程式为
(5)W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成1 mol CO2,已知W的苯环上只有2个取代基,则W的结构共有
(6)参照上述合成路线,写出以一氯甲苯(
 )为原料(无机试剂任选)制备苯乙酸的合成路线:
)为原料(无机试剂任选)制备苯乙酸的合成路线:
您最近一年使用:0次
2017-08-16更新
|
255次组卷
|
4卷引用:2017届山西临汾一中等五校高三上第二次联考化学试卷
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础、认识化学科学、物质结构与性质、化学反应原理
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 硅酸盐工业 淀粉和纤维素组成与结构 常见合金的组成 | |
| 2 | 0.65 | 铵根离子的检验 焰色试验 蛋白质的颜色反应 化学实验方案的设计与评价 | |
| 3 | 0.65 | 阿伏加德罗常数的应用 | |
| 4 | 0.65 | 根据要求书写同分异构体 同分异构体的数目的确定 | |
| 5 | 0.65 | 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 6 | 0.65 | 原电池 电解原理的应用 | |
| 7 | 0.4 | 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 氧化还原反应在生活、生产中的应用 硫 酸碱中和滴定原理的应用 物质制备的探究 | 实验探究题 |
| 9 | 0.4 | 氧化还原反应的规律 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.65 | 化学反应原理综合考查 化学平衡的移动及其影响因素 化学平衡的有关计算 甲醇燃料电池 | 原理综合题 |
| 11 | 0.4 | 基态核外电子排布规律 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 根据要求书写同分异构体 根据题给物质选择合适合成路线 有机合成综合考查 碳链加长 | 有机推断题 |



