广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题
广东
高三
模拟预测
2020-04-23
1086次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质、认识化学科学
广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题
广东
高三
模拟预测
2020-04-23
1086次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质、认识化学科学
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 春季复工、复学后,做好防护是控防新型冠状病毒传播的有效措施。下列说法正确的是
| A.40%的甲醛溶液可做公共餐具消毒剂 |
| B.生产医用口罩的主要原料是聚丙烯(PP),分子式为(CH3CH=CH2)n。 |
| C.95%的乙醇溶液、84消毒液可直接用作环境消毒剂 |
| D.为减少直接吸入飞沫形成的气溶胶感染病毒的几率,就餐时人人间距至少应为1米 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
2. 中国工程院院士李兰娟团队发现,阿比朵尔对2019-nCoV具有一定的抑制作用,其结构简式如图所示,下面有关该化合物的说法正确的是
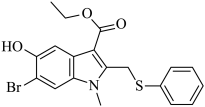

| A.室温可溶于水和酒精 |
| B.氢原子种类数为10 |
| C.不能使酸性KMnO4溶液褪色 |
| D.1mol该分子最多与8mol氢气反应 |
您最近一年使用:0次
2020-04-20更新
|
292次组卷
|
2卷引用:广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题
单选题
|
适中(0.65)
名校
解题方法
3. 某同学按下图所示实验装置探究铜与浓硫酸的反应,记录实验现象见下表。
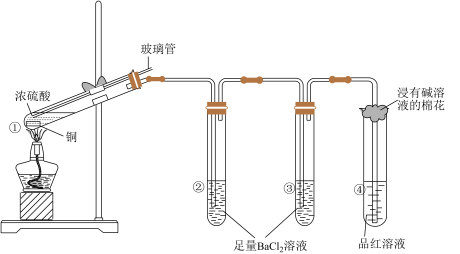
下列说法正确的是

| 试管 | ① | ② | ③ | ④ |
| 实验现象 | 溶液仍为无色,有白雾、白色固体产生 | 有大量白色沉淀产生 | 有少量白色沉 | 品红溶液褪色 |
下列说法正确的是
| A.②中白色沉淀是BaSO3 |
| B.①中可能有部分硫酸挥发了 |
| C.为确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡 |
| D.实验时若先往装置内通入足量N2,再加热试管①,实验现象不变 |
您最近一年使用:0次
2020-04-27更新
|
383次组卷
|
6卷引用:广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题
广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题广东省广州、深圳市学调联盟2020届高三第二次调研考试化学试题(已下线)考点16 非金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编福建省福州市福建师范大学附属中学2021届高三上学期期中考试化学试题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)安徽省六安第二中学2020-2021学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
4. 科研工作者结合实验与计算机模拟来研究钌催化剂表面不同位点上合成氨反应历程,如图所示,其中实线表示位点A上合成氨的反应历程,虚线表示位点B上合成氨的反应历程,吸附在催化剂表面的物种用*标注。下列说法错误的是
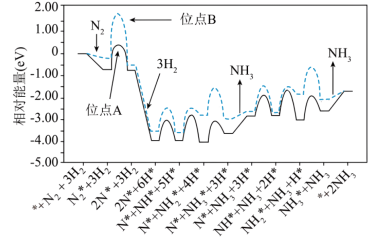

| A.由图可以判断合成氨反应属于放热反应 |
| B.氮气在位点A上转变成2N*速率比在位点B上的快 |
| C.整个反应历程中活化能最大的步骤是2N*+3H2→2N*+6H* |
| D.从图中知选择合适的催化剂位点可加快合成氨的速率 |
您最近一年使用:0次
单选题
|
适中(0.65)
5. 处于3个不同短周期的元素X、Y、Z、M,其原子序数依次增大,它们组成一种团簇分子Z2M2Y4(YX)2。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的3/4,下列说法正确的是
| A.元素形成的简单离子半径:Z>M>Y |
| B.常温下Z和M的单质均能溶于浓硝酸 |
| C.X与Y结合形成的化合物是离子化合物 |
| D.工业上常用电解熔融的Z的氯化物来制取Z单质 |
您最近一年使用:0次
2020-06-23更新
|
291次组卷
|
5卷引用:广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题
广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题山东省泰安市2020届高三第四次模拟化学试题(已下线)学科网2020年5月高三大联考考后强化卷(新课标Ⅰ卷)化学试题黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题(已下线)专题09 物质结构 元素周期律-2022年高考化学二轮复习重点专题常考点突破练
单选题
|
适中(0.65)
解题方法
6. 中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示。充电过程中,石墨电极发生阴离子插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是
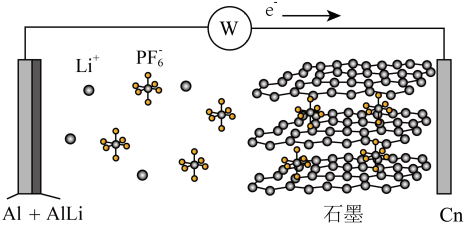

| A.放电时,电解质中的Li+向左端电极移动 |
| B.充电时,与外加电源负极相连一端电极反应为:AlLi-e-=Li++Al |
| C.放电时,正极反应式为Cn(PF6)+e-=PF6-+Cn |
| D.充电时,若转移0.2mol电子,则铝电极上增重5.4g |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
7. 往10mL0.1mol/L的Ba(OH)2溶液中滴加等浓度NaHSO4溶液,溶液的导电能力随滴入溶液体积变化的曲线如图。下列说法正确的是
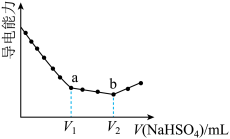

| A.a点对应的溶液呈碱性 |
| B.V2=10mL |
| C.水的电离程度:a> b |
| D.b点后的溶液满足c(Na+)>2c(SO42-) |
您最近一年使用:0次
2020-04-20更新
|
230次组卷
|
2卷引用:广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
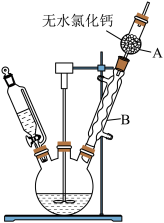
8. 三苯甲醇(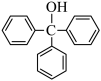 )是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
)是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
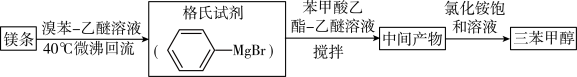
已知:①格氏试剂易潮解,生成可溶于水的 Mg(OH)Br。
②三苯甲醇可通过格氏试剂与苯甲酸乙酯按物质的量比2:1反应合成
③相关物质的物理性质如下:
请回答下列问题:
(1)合成格氏试剂:实验装置如图所示,仪器A的名称是____ ,已知制备格氏试剂的反应剧烈放热,但实验开始时常加入一小粒碘引发反应,推测I2的作用是____ 。使用无水氯化钙主要是为避免发生____ (用化学方程式表示)。
(2)制备三苯甲醇:通过恒压滴液漏斗往过量的格氏试剂中加入13mL苯甲酸乙酯(0.09mol)和15mL无水乙醚的混合液,反应剧烈,要控制反应速率除使用冷水浴外,还可以___ (答一点)。回流0.5h后,加入饱和氯化铵溶液,有晶体析出。
(3)提纯:冷却后析出晶体的混合液含有乙醚、溴苯、苯甲酸乙酯和碱式溴化镁等杂质,可先通过___ (填操作方法,下同)除去有机杂质,得到固体17.2g。再通过 ___ 纯化,得白色颗粒状晶体16.0g,测得熔点为164℃。
(4)本实验的产率是____ (结果保留两位有效数字)。本实验需要在通风橱中进行,且不能有明火,原因是____ 。
 )是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
)是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:

已知:①格氏试剂易潮解,生成可溶于水的 Mg(OH)Br。
②三苯甲醇可通过格氏试剂与苯甲酸乙酯按物质的量比2:1反应合成
③相关物质的物理性质如下:
| 物质 | 相对分子量 | 沸点 | 熔点 | 溶解性 |
| 三苯甲醇 | 260 | 380℃ | 164.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | - | 34.6℃ | -116.3℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | - | 156.2℃ | -30.7℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 苯甲酸乙酯 | 150 | 212.6℃ | -34.6℃ | 不溶于水 |
(1)合成格氏试剂:实验装置如图所示,仪器A的名称是
(2)制备三苯甲醇:通过恒压滴液漏斗往过量的格氏试剂中加入13mL苯甲酸乙酯(0.09mol)和15mL无水乙醚的混合液,反应剧烈,要控制反应速率除使用冷水浴外,还可以
(3)提纯:冷却后析出晶体的混合液含有乙醚、溴苯、苯甲酸乙酯和碱式溴化镁等杂质,可先通过
(4)本实验的产率是
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
9. 钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示。
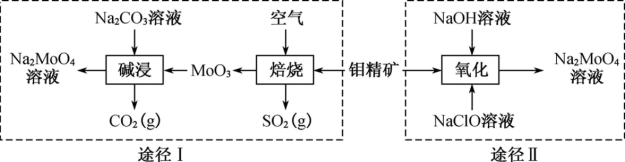
(1)NaClO的电子式为___ 。
(2)途径Ⅰ碱浸时发生反应的化学方程式为____ 。
(3)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为____ 。
(4)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是______ [已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(5)分析纯钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的气体一起通入水中,得到正盐的化学式是_______ 。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图
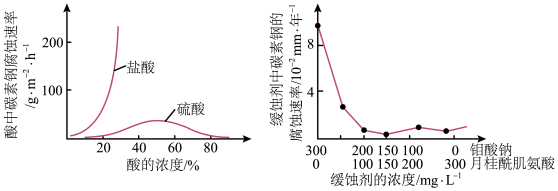
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是____ 。
②若缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M =206g·mol-1) 的物质的量浓度为____ (计算结果保留3位有效数字)。

(1)NaClO的电子式为
(2)途径Ⅰ碱浸时发生反应的化学方程式为
(3)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为
(4)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是
(5)分析纯钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的气体一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图

①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是
②若缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M =206g·mol-1) 的物质的量浓度为
您最近一年使用:0次
10. NOx、SO2的处理转化对环境保护有着重要意义。
(1)利用反应2NO(g)+2CO(g) = N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=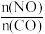 ]的关系如图1所示。
]的关系如图1所示。
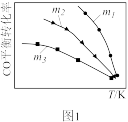

①该反应的ΔH____ 0(填“>”“<”或“=”)。
②下列说法正确的是________ (填字母)。
A.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B.投料比:m1>m2>m3
C.当投料比m=2时,NO转化率是CO转化率的2倍
D.汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为________ 。
(2)若反应2NO(g)+2CO(g) = N2(g)+2CO2(g)的正、逆反应速率可表示为:v正=k正·c2(NO) ·c2(CO);v逆=k逆·c (N2) ·c2(CO2), k正、k逆分别为正、逆反应速率常数, 仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时v正∶v逆=________ 。
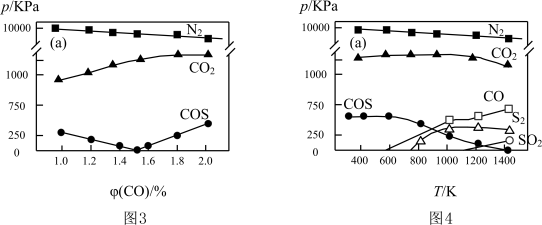
(3)工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图3为298K各气体分压(气体的物质的量分数与总压的乘积)与CO物质的量分数的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。
下列说法不正确的是________ (填字母)。
A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种
B.温度越高脱硫脱硝的效果越好
C.NOx比SO2更易被CO还原
D.体系中可能发生反应:2COS = S2+2CO;4CO2+S2 = 4CO+2SO2
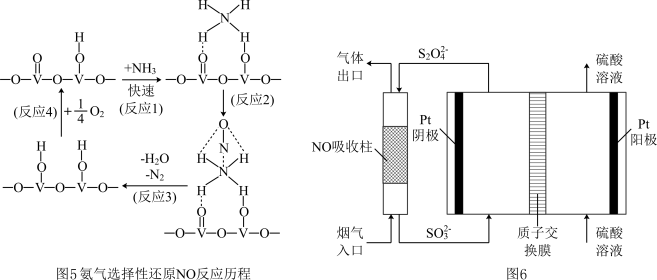
(4)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图5所示,则总反应方程式为________ 。
(5)用间接电化学法去除烟气中NO的原理如图6所示,则阴极的电极反应式为____ 。
(1)利用反应2NO(g)+2CO(g) = N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=
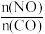 ]的关系如图1所示。
]的关系如图1所示。

①该反应的ΔH
②下列说法正确的是
A.当体系中CO2和CO物质的量浓度之比保持不变时,反应达到平衡状态
B.投料比:m1>m2>m3
C.当投料比m=2时,NO转化率是CO转化率的2倍
D.汽车排气管中的催化剂可提高NO的平衡转化率
③随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为
(2)若反应2NO(g)+2CO(g) = N2(g)+2CO2(g)的正、逆反应速率可表示为:v正=k正·c2(NO) ·c2(CO);v逆=k逆·c (N2) ·c2(CO2), k正、k逆分别为正、逆反应速率常数, 仅与温度有关。一定温度下,在体积为1L的容器中加入2molNO和2molCO发生上述反应,测得CO和CO2物质的量浓度随时间的变化如图2所示,则a点时v正∶v逆=
(3)工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,一定条件下得到以下实验结果。图3为298K各气体分压(气体的物质的量分数与总压的乘积)与CO物质的量分数的关系,图4为CO物质的量分数为2.0%时,各气体分压与温度的关系。

下列说法不正确的是
A.不同温度下脱硝的产物为N2,脱硫的产物可能有多种
B.温度越高脱硫脱硝的效果越好
C.NOx比SO2更易被CO还原
D.体系中可能发生反应:2COS = S2+2CO;4CO2+S2 = 4CO+2SO2
(4)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图5所示,则总反应方程式为

(5)用间接电化学法去除烟气中NO的原理如图6所示,则阴极的电极反应式为
您最近一年使用:0次
2020-04-20更新
|
351次组卷
|
3卷引用:江苏省镇江市2020届高三上学期期末考试化学试题
解答题-结构与性质
|
较难(0.4)
名校
解题方法
11. Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,氯元素的原子核外有____ 种不同运动状态的电子;有___ 种不同能级的电子,基态Fe3+的电子排布式为___ 。
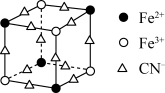
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是____ ;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为 ___ 。
(3)Cu2+能与乙二胺(H2N-CH2-CH2-NH2)形成配离子。该配离子中含有的化学键类型有__ (填字母)
a.配位键 b.极性键 c.离子键 d.非极性键,
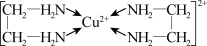
乙二胺中共有____ 个σ键,C原子的杂化方式为 ___ 。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3,则铜原子的直径约为____ pm。
(5)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。回答下列问题。某化合物的化学式为Na3CrO8,其阴离子结构可表示为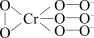 ,则Cr的化合价为
,则Cr的化合价为____ 。CrO42-呈四面体构型,结构为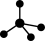 ,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为
,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为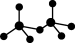 。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为
。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为____ 。
(1)FeCl3是一种常用的净水剂,氯元素的原子核外有
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是
 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为 
(3)Cu2+能与乙二胺(H2N-CH2-CH2-NH2)形成配离子。该配离子中含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键,

乙二胺中共有
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3,则铜原子的直径约为
(5)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。回答下列问题。某化合物的化学式为Na3CrO8,其阴离子结构可表示为
 ,则Cr的化合价为
,则Cr的化合价为 ,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为
,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为 。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为
。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为【知识点】 物质结构与性质综合考查解读 配合物 晶胞的有关计算解读
您最近一年使用:0次
2020-04-20更新
|
334次组卷
|
2卷引用:广东省东莞市2020届普通高中毕业班4月模拟自测(全国I卷)理综化学试题
解答题-有机推断题
|
适中(0.65)
解题方法
12. 1923年,我国化学家吴蕴初先生研制出了廉价生产味精的方案,并向英、美、法等化学工业发达国家申请了专利。以下是利用化学方法合成味精的流程:
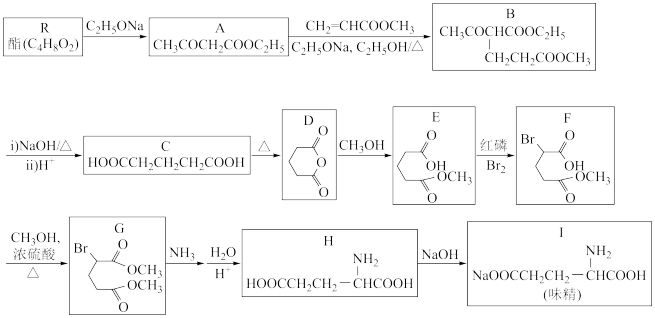
请回答下列问题:
(1)下列有关蛋白质和氨基酸的说法不正确的是____ (填字母)。
a.蛋白质都是高分子化合物
b.谷氨酸(H)自身不能发生反应
c.H分子不含手性碳原子
d.天然蛋白质水解最终产物都是α-氨基酸
(2)C的系统命名法名称是____ ;B中含氧官能团名称是____ 。
(3)E→F的反应类型是____ 。R的结构简式为____ 。
(4)写出G和NH3反应的化学方程式:____ 。
(5)T是H的同分异构体,写出同时具备下列条件的T的结构简式______________ 。
①含有—NH2,且能发生水解反应;
②1molT发生银镜反应能生成4molAg
③核磁共振氢谱上有4组峰且峰面积比为2∶2∶2∶3
(6)参照题给流程图,以 和甲醇为原料(其他无机试剂任选),设计合成苯丙氨酸(
和甲醇为原料(其他无机试剂任选),设计合成苯丙氨酸( 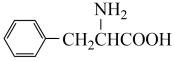 )的流程,写出合成路线
)的流程,写出合成路线____ 。

请回答下列问题:
(1)下列有关蛋白质和氨基酸的说法不正确的是
a.蛋白质都是高分子化合物
b.谷氨酸(H)自身不能发生反应
c.H分子不含手性碳原子
d.天然蛋白质水解最终产物都是α-氨基酸
(2)C的系统命名法名称是
(3)E→F的反应类型是
(4)写出G和NH3反应的化学方程式:
(5)T是H的同分异构体,写出同时具备下列条件的T的结构简式
①含有—NH2,且能发生水解反应;
②1molT发生银镜反应能生成4molAg
③核磁共振氢谱上有4组峰且峰面积比为2∶2∶2∶3
(6)参照题给流程图,以
 和甲醇为原料(其他无机试剂任选),设计合成苯丙氨酸(
和甲醇为原料(其他无机试剂任选),设计合成苯丙氨酸( 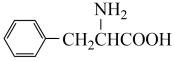 )的流程,写出合成路线
)的流程,写出合成路线
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、化学反应原理、物质结构与性质、认识化学科学
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 甲醛的毒性 加聚反应机理及几个相关概念 化学科学对人类文明发展的意义 | |
| 2 | 0.85 | 有机官能团的性质及结构 含碳碳双键物质的性质的推断 苯的化学性质 多官能团有机物的结构与性质 | |
| 3 | 0.65 | 硫酸 二氧化硫的化学性质 物质性质的探究 | |
| 4 | 0.65 | 化学反应中能量变化的原因 影响化学反应速率的内因 催化剂对化学反应速率的影响 | |
| 5 | 0.65 | 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 6 | 0.65 | 电化学计算 原电池原理 新型电池 电解原理 | |
| 7 | 0.85 | 物质水溶液的导电性 离子反应的发生及书写 离子反应在化合物组成的分析、鉴定的应用 影响水电离的因素 | |
| 二、解答题 | |||
| 8 | 0.65 | 物质分离、提纯综合应用 蒸馏与分馏 常见有机物的制备 探究物质组成或测量物质的含量 | 实验探究题 |
| 9 | 0.65 | 氧化还原反应方程式的配平 铁与强氧化性酸的反应 溶度积常数相关计算 常见无机物的制备 | 工业流程题 |
| 10 | 0.4 | 化学反应原理综合考查 化学平衡的移动及其影响因素 化学平衡的有关计算 化学平衡图像分析 | 原理综合题 |
| 11 | 0.4 | 物质结构与性质综合考查 配合物 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 有机反应类型 同分异构体书写 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



