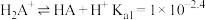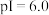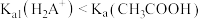乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O
 +OH-,25℃时,Kb1=10-4.07,Kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
+OH-,25℃时,Kb1=10-4.07,Kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )

 +OH-,25℃时,Kb1=10-4.07,Kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
+OH-,25℃时,Kb1=10-4.07,Kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
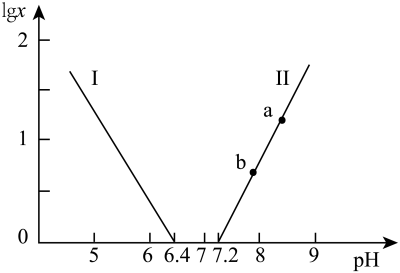
A.曲线Ⅱ代表的微粒符号为H2NCH2CH2NH |
| B.曲线Ⅰ与曲线Ⅱ相交点对应pH=6.85 |
C.0.1 mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>c(H2NCH2CH2NH )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
D.乙二胺在水溶液中第二步电离的方程式:H2NCH2CH2NH +H2O +H2O [H3NCH2CH2NH3]2++OH- [H3NCH2CH2NH3]2++OH- |
更新时间:2020-08-15 10:53:36
|
相似题推荐
单选题
|
较难
(0.4)
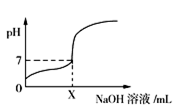
【推荐1】用0.1 mol • L-1的NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol • L-1的HCl溶液和HX溶液,溶液的pH随加入 NaOH溶液体积的变化如图所示。下列说法正确的是
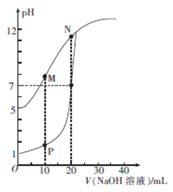

| A.M点对应溶液中:c(HX)<C(X-) |
| B.HX的电离平衡常数Ka约为1×10-5 |
| C.P 点对应溶液中 c(Cl-) = 0.05 mol • L-1 |
D.N点对应溶液pH>7的原因是X-+H20 HX+0H- HX+0H- |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,0.1 mol·L−1 H2R溶液中H2R、HR−、R2−三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是
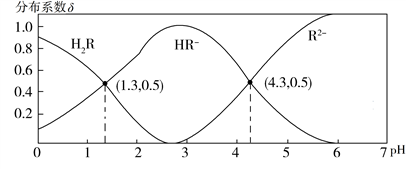

| A.Na2R溶液中:c(Na+)=c(HR−)+2c(R2−) |
B.H2R H++HR−,Ka1=1.0×10−1.3 H++HR−,Ka1=1.0×10−1.3 |
| C.等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3 |
D.HF的Ka=1.0×10−3.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F− 2HF+R2− 2HF+R2− |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】海洋中珊瑚(主要成分 )的减少可能与
)的减少可能与 的过度排放相关。海水中
的过度排放相关。海水中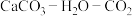 体系各组分lgc-pH关系如下图。
体系各组分lgc-pH关系如下图。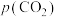 为定值;
为定值;
②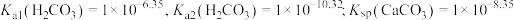 。
。
下列说法错误的是
 )的减少可能与
)的减少可能与 的过度排放相关。海水中
的过度排放相关。海水中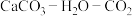 体系各组分lgc-pH关系如下图。
体系各组分lgc-pH关系如下图。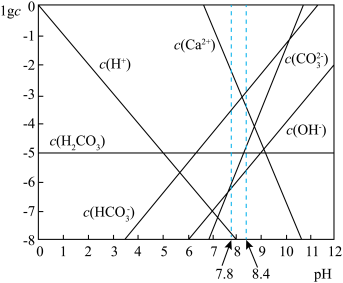
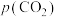 为定值;
为定值;②
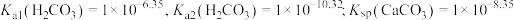 。
。下列说法错误的是
A.通常情况下,海水中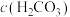 保持不变 保持不变 |
B.天然海水中一定存在: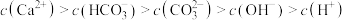 |
C.在pH=8.0的天然海水中,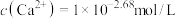 |
D.若 过度排放, 过度排放,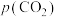 增大,将导致海水pH降低,促进海洋中 增大,将导致海水pH降低,促进海洋中 溶解 溶解 |
您最近一年使用:0次
单选题
|
较难
(0.4)
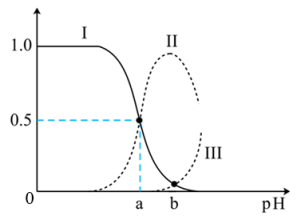
【推荐2】常温下,水溶液中部分缓冲对的微粒浓度之比的对数值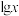 [x表示
[x表示 或
或 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
 [x表示
[x表示 或
或 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
A.曲线Ⅰ表示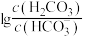 与溶液pH的变化关系 与溶液pH的变化关系 |
B.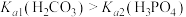 |
| C.a→b的过程中,水的电离程度逐渐减小 |
D.当pH增大时,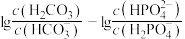 的值逐渐增大 的值逐渐增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向20mL0.1mol/L的醋酸溶液中逐滴滴加等浓度的NaOH溶液,忽略温度变化,溶液pH与NaOH溶液体积之间的关系如图所示,下列说法不正确的是


A.由a点可知 的 的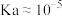 |
B.a、b之间一定存在: ; ; |
C.若e点 ,则a、e两点水的电离程度相同 ,则a、e两点水的电离程度相同 |
D.d点之后可能存在: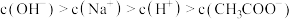 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】下列溶液中微粒的物质的量浓度关系或说法正确的是
A.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O )+c(H2C2O4) )+c(H2C2O4) |
B.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH )大小:①>②>③ )大小:①>②>③ |
| C.0.1mol/L的CH3COOH溶液加水稀释,c(H+)/c(CH3COO-)的比值将增大 |
| D.0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】标准状况下,下列说法正确的是
| A.等体积CH4和HF所含的电子数相同 |
| B.pH=12的Na2CO3溶液中c(OH-)=10-2mol/L |
| C.2.5gMg-Zn合金与足量的盐酸反应,放出的气体体积可能为2.24L |
| D.由H2O2 制2.24LO2转移的电子数目为0.4NA |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】用亚硫酸盐(X)吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数(δ)与溶液pH的变化关系如下图所示。下列说法中不正确 的是


| A.若X为Na2SO3,当吸收液pH=1.85时:c(Na+)=c(HSO3-)+c(H2SO3) |
| B.若X为Na2SO3,当吸收液呈中性时:2c(SO32-)+c(HSO3-)=c(Na+) |
| C.若X为 (NH4)2SO3,(NH4)2SO3溶液呈碱性,说明水解程度:SO32-> NH4+ |
| D.若X为 (NH4)2SO3,图中b点溶液中n(HSO3-)∶n(NH4+)= 1∶3 |
您最近一年使用:0次


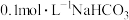 溶液中:
溶液中: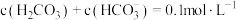
 的磷酸溶液中:
的磷酸溶液中: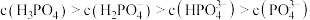
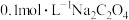 溶液中:
溶液中: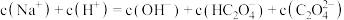
 溶液混合形成
溶液混合形成 的溶液中:
的溶液中: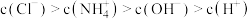
 时,向0.1mol/L甘氨酸水溶液中通入HCl或加入NaOH固体,溶液pH变化曲线如图所示。已知:
时,向0.1mol/L甘氨酸水溶液中通入HCl或加入NaOH固体,溶液pH变化曲线如图所示。已知:
 三种形式存在,且有如下平衡:
三种形式存在,且有如下平衡: