部分弱酸的电离平衡常数如下表:
下列选项错误的是
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
A.CN-+H2O+CO2=HCN+HCO |
B.2HCOOH+ CO =2HCOO-+H2O+CO2↑ =2HCOO-+H2O+CO2↑ |
| C.中和等体积、等 pH 的 HCOOH 和 HCN,消耗 NaOH 的量前者小于后者 |
| D.等体积、等浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者小于后者 |
更新时间:2020-12-22 15:13:53
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】类推是学习和研究化学的重要思维方法。下列有关类推结论正确的是
| 选项 | 化学事实 | 类推结论 |
| A | 铜丝在氧气中加热反应生成CuO | 铜丝在硫蒸汽中加热反应生成CuS |
| B | 常温下,pH=2的稀盐酸加水稀释至100倍后溶液的pH变为4 | 常温下,pH=2的醋酸溶液加水稀释至100倍后溶液的pH变为4 |
| C | 同一周期从左到右,主族元素的非金属性逐渐增强 | 同一周期从左到右,主族元素的电负性逐渐增大 |
| D | 除去Na2CO3粉末中混有少量的NaHCO3,可采用加热的方法 | 除去碘粉中混有少量的NH4Cl,可采用充分加热的方法 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,通过下列实验探究CH3COOH溶液的性质,下列说法正确的是(已知常温下,CH3COOH的电离常数Ka=1.8×10-5)
实验1:用pH试纸测定0.1 mol·L-1CH3COOH溶液的pH,测得pH约为3
实验2:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入10.00mL 0.1 mol·L-1NaOH溶液
实验3:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入NaOH溶液至恰好完全反应
实验4:将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合
实验1:用pH试纸测定0.1 mol·L-1CH3COOH溶液的pH,测得pH约为3
实验2:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入10.00mL 0.1 mol·L-1NaOH溶液
实验3:向20.00mL 0.1 mol·L-1CH3COOH溶液中逐滴加入NaOH溶液至恰好完全反应
实验4:将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合
| A.实验1:水中加入CH3COOH,水的电离程度变大 |
| B.实验2反应后的溶液中: c(CH3COOH)+c(H+)= c(CH3COO- )+c(OH- ) |
| C.实验3反应后的溶液中:反应后溶液pH=7 |
| D.实验4:混合后溶液c(CH3COO- )> c(H+)> c(OH- ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】对下列反应的推断或解释正确的是
| 操作 | 实验现象 | 推断或解释 | |
| A | 将少量饱和硼酸溶液滴加到碳酸钠溶液中 | 无气泡 | 酸性:H2CO3>H3BO3 |
| B | 将C2H4通入溴的四氯化碳溶液中 | 溴的四氯化碳溶液褪色 | C2H4与溴发生了加成反应 |
| C | 同温同压下用pH试纸测定相同浓度的碳酸钠和乙酸铵溶液的酸碱性 | 碳酸钠溶液显碱性,乙酸铵溶液显中性 | 碳酸钠溶液发生了水解,乙酸铵溶液没有水解 |
| D | 向均盛有2mL5%H2O2溶液的两支试管中分别滴入0.3mol/LFeCl3和0.2mol/LCuCl2溶液各1mL | 前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,向 20 mL 0.1 mol·L-1 的 CH3COOH 溶液中不断滴入 0.1 mol·L-1 的 NaOH溶液,溶液的pH变化曲线,如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述错误的是


| A.a 点时: c( CH3COO-)>c( Na+)>c( H+)>c( OH-) |
| B.b 点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-) |
| C.c 点时:c(OH-)=c(CH3COOH) +c(H+) |
| D.d 点时:c(Na+)> c(OH-) > c(CH3COO-) >c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,用一定浓度的盐酸溶液滴定某氨水溶液。滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是
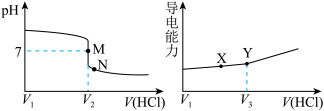

| A.M点对应溶液中c(NH4+)=c(Cl-) |
| B.X→Y溶液导电性增强的主要原因是c(H+)和c(Cl-)增大 |
| C.根据溶液pH和导电能力的变化可判断V2<V3 |
D.M→N过程中 不变 不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温下,用0.01 mol/L的氢氧化钠溶液分别滴定20 mL 0.01 mol/L的两种酸HA、HB,滴定曲线变化趋势都与如图相似(忽略溶液体积变化),下列说法错误的是


| A.可通过a点pH大小判断两种酸的酸性强弱 |
| B.b点时可能存在2c(HB)+2c(B-)=c(Na+) |
| C.若HA为弱酸,c点时V(NaOH)<20 mL |
| D.d点时可能存在c(A-)=c(B-)<c(Na+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】0.02 mol·L-1 HCN 与 0.01 mol·L-1 NaOH 等体积混合,测得c(Na+)>c(CN-)。下列关系正确的是
| A.c(H+)>c(OH-) |
| B.c(HCN)>c(Na+) |
| C.c(H+)+c(HCN)=c(OH-) |
| D.c(HCN)+c(CN-)=0.02 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某水样中含一定浓度的CO 、HCO
、HCO 和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。

下列说法正确的是
 、HCO
、HCO 和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
和其他不与酸碱反应的离子。取10.00mL水样,用0.01000mol•L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是
A.该水样中c(CO )=0.01mol•L-1 )=0.01mol•L-1 |
| B.a点处c(H2CO3)+c(H+)=c(OH—) |
C.当V(HCl)≤20.00mL时,溶液中c(HCO )基本保持不变 )基本保持不变 |
D.曲线上任意一点存在c(CO )+c(HCO )+c(HCO )+c(H2CO3)=0.03mol•L-1 )+c(H2CO3)=0.03mol•L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】实验I浑浊不消失,实验Ⅱ和Ⅲ中浊液变澄清。下列分析正确的是


A.实验I中:c(Na+)>c(HCO ) >c(CO ) >c(CO ) >c(OH-) ) >c(OH-) |
B.实验I中说明HCO 电离程度>HCO 电离程度>HCO 水解程度 水解程度 |
C.实验Ⅱ中NH4Cl溶液抑制了HCO 的水解 的水解 |
| D.实验Ⅲ中发生了反应:2NaHCO3 +2NH3·H2O=(NH4)2CO3+Na2CO3+2H2O |
您最近一年使用:0次

 的醋酸溶液稀释100倍,
的醋酸溶液稀释100倍,
 溶液与
溶液与 溶液中的
溶液中的 ,前者较大
,前者较大 的醋酸钠溶液中,由水电离出的
的醋酸钠溶液中,由水电离出的 相等
相等 减小
减小 、c(NH3•H2O)四种微粒的pX[
、c(NH3•H2O)四种微粒的pX[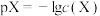 ]随pOH的变化关系如图,已知
]随pOH的变化关系如图,已知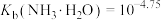 。下列说法错误的是
。下列说法错误的是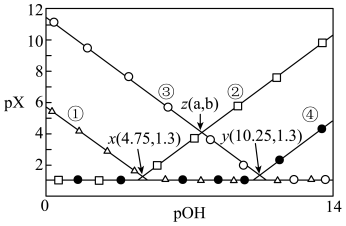
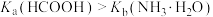
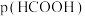 随pOH的变化关系
随pOH的变化关系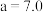
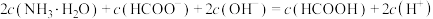
 (苯甲酸)溶液中滴加0.1mol/LNaOH溶液,混合溶液的pH与微粒浓度变化的关系如图所示。下列说法错误的是
(苯甲酸)溶液中滴加0.1mol/LNaOH溶液,混合溶液的pH与微粒浓度变化的关系如图所示。下列说法错误的是

 的水解常数
的水解常数


