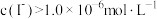下列说法正确的是
| A.向AgCl浊液中加入KBr溶液,沉淀颜色变为浅黄色,即可证明Ksp(AgCl)>Ksp(AgBr) |
| B.常温下向NaOH溶液中滴入HCOOH溶液至pH=5时:c(HCOO-)>c(Na+) |
C.常温下等物质的量浓度的四种溶液①NH3·H2O ②NH4HSO4③(NH4)2CO3④NH4Cl,c( )的关系为②>④>③>① )的关系为②>④>③>① |
D.等物质的量浓度的NaHCO3与Na2CO3混合溶液:3c(Na+)=2[c( )+c( )+c( )+c (H2CO3)] )+c (H2CO3)] |
2021·辽宁·模拟预测 查看更多[3]
(已下线)第八章 水溶液中的离子反应与平衡 第50练 溶液中“粒子”浓度关系(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练辽宁省2021年普通高中学业水平选择考适应性测试化学试题
更新时间:2021-01-25 13:16:09
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】已知: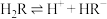 ,
, ,CuR难溶于水。常温下,
,CuR难溶于水。常温下,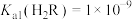 ,
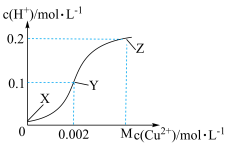
, ,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中
,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中 与
与 的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
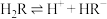 ,
, ,CuR难溶于水。常温下,
,CuR难溶于水。常温下,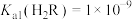 ,
, ,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中
,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中 与
与 的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
A.根据Y点数据可求得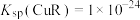 |
B.Y点对应的溶液中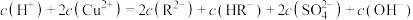 |
| C.常温下,NaHR溶液显碱性 |
| D.X点溶液的pH≈5 |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,调节某醋酸与醋酸钠混合溶液的pH,保持c(CH3COOH)+c(CH3COO-)=0.1mol·L-1,溶液中c(CH3COOH)、c(CH3COO-)随pH的变化如图所示。下列说法正确的是(忽略溶液体积变化)
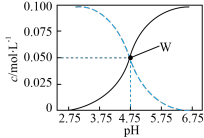

| A.pH=5时,c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.pH=3.5时,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1 |
| C.取W点溶液1L,c(Na+)+2c(OH-)=c(CH3COO-)+2c(H+) |
| D.取W点溶液1L,通入0.05molHCl:c(H+)>c(CH3COOH)+c(OH-) |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是
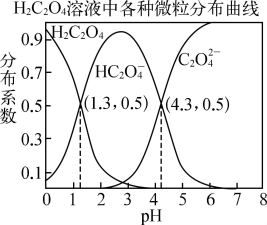

A.HC2O4- H++C2O42- K=1×10-4.3 H++C2O42- K=1×10-4.3 |
| B.将10mL0.1mol/L的H2C2O4溶液与15mL0.1mol/L的NaOH溶液混合后,所得溶液pH等于4.3 |
| C.常温下HF的Ka=1×10-3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为H2C2O4+F-=HF+HC2O4- |
| D.在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )


| A.由图可知,c1>c2>c3 |
| B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-) |
| C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
D.由pH=7的溶液计算得:Ka= (V0是消耗的NaOH溶液的体积) (V0是消耗的NaOH溶液的体积) |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下用0.1000 mol/L的盐酸分别逐滴加入到20.00 mL 0.1000 mol/L的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列说法不正确的是
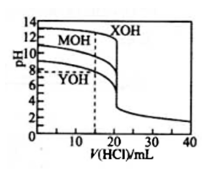

| A.XOH为强碱,MOH、YOH均为弱碱 |
| B.V(HCl)=15.00 mL时,三份溶液中离子总浓度大小顺序:XOH>MOH>YOH |
| C.当盐酸滴加至20.00 mL时,三条曲线刚好相交 |
| D.在逐滴加入盐酸至40.00 mL的过程中,三份溶液中水的电离程度均先增大后减小 |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐3】草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:
实验I:向20mL0.1mol·L-1NaHC2O4溶液中滴加0.1mol·L-1NaOH溶液。
实验II:向20mL0.1mol·L-1NaHC2O4溶液中滴加0.1mol·L-1CaCl2溶液。
已知:H2C2O4的电离常数Ka1=5.4×10-2,Ka2=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。下列说法不正确的是
实验I:向20mL0.1mol·L-1NaHC2O4溶液中滴加0.1mol·L-1NaOH溶液。
实验II:向20mL0.1mol·L-1NaHC2O4溶液中滴加0.1mol·L-1CaCl2溶液。
已知:H2C2O4的电离常数Ka1=5.4×10-2,Ka2=5.4×10-5,Ksp(CaC2O4)=2.4×10-9,溶液混合后体积变化忽略不计。下列说法不正确的是
A.NaHC2O4溶液中存在:c(H+)+c(H2C2O4)=c(OH-)+c( ) ) |
| B.实验I可选用酚酞作指示剂,指示反应终点 |
C.实验I中V(NaOH)=10mL时,存在c( )<c( )<c( ) ) |
D.实验II中发生反应:2 +Ca2+=CaC2O4↓+H2C2O4 +Ca2+=CaC2O4↓+H2C2O4 |
您最近半年使用:0次
【推荐1】根据下列实验操作和现象,所得结论或推论正确的是
| 实验操作和现象 | 实验结论或推论 | |
| A | 向FeCl3溶液中加入Cu片,振荡,溶液颜色变化 | Cu与FeCl3发生了置换反应 |
| B | 用pH试纸测得NaA、NaB溶液的pH分别为9、8 | 酸性:HB>HA |
| C | 用AgNO3标准溶液滴定待测液中c(Cl-),以K2CrO4为指示剂 | 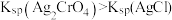 |
| D | 向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀 | SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
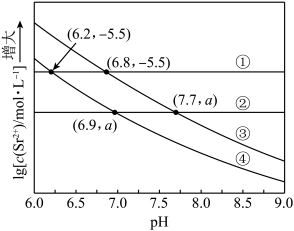
【推荐2】工业上以 为原料生产
为原料生产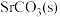 ,对其工艺条件进行研究。现有含
,对其工艺条件进行研究。现有含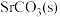 的0.1mol/L、
的0.1mol/L、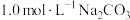 溶液,含
溶液,含 的0.1mol/L、
的0.1mol/L、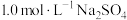 溶液。在一定pH范围内,四种溶液中
溶液。在一定pH范围内,四种溶液中 随pH的变化关系如图所示。下列说法正确的是
随pH的变化关系如图所示。下列说法正确的是
 为原料生产
为原料生产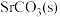 ,对其工艺条件进行研究。现有含
,对其工艺条件进行研究。现有含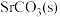 的0.1mol/L、
的0.1mol/L、 溶液,含
溶液,含 的0.1mol/L、
的0.1mol/L、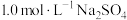 溶液。在一定pH范围内,四种溶液中
溶液。在一定pH范围内,四种溶液中 随pH的变化关系如图所示。下列说法正确的是
随pH的变化关系如图所示。下列说法正确的是
A.曲线④代表含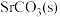 的 的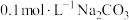 溶液的变化曲线 溶液的变化曲线 |
| B.a=-4.5 |
C.随着pH的增大,反应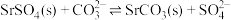 的平衡常数减小 的平衡常数减小 |
D.对含 且 且 和 和 初始浓度均为 初始浓度均为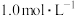 的混合溶液,pH≥6.9时才发生沉淀转化 的混合溶液,pH≥6.9时才发生沉淀转化 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知 =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是

 =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是
| A.a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态 |
| B.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-) |
| C.饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊 |
| D.石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4 +2OH- |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】室温下,向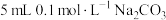 溶液中滴加
溶液中滴加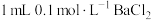 溶液,有白色沉淀生成,过滤,向滤渣中加入
溶液,有白色沉淀生成,过滤,向滤渣中加入 溶液,浸泡一段时间后过滤,向滤渣中加入足量的
溶液,浸泡一段时间后过滤,向滤渣中加入足量的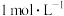 盐酸,无明显现象。已知:
盐酸,无明显现象。已知: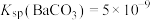 ,
, 。下列说法正确的是
。下列说法正确的是
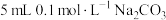 溶液中滴加
溶液中滴加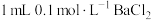 溶液,有白色沉淀生成,过滤,向滤渣中加入
溶液,有白色沉淀生成,过滤,向滤渣中加入 溶液,浸泡一段时间后过滤,向滤渣中加入足量的
溶液,浸泡一段时间后过滤,向滤渣中加入足量的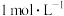 盐酸,无明显现象。已知:
盐酸,无明显现象。已知: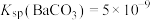 ,
, 。下列说法正确的是
。下列说法正确的是A. 溶液中存在: 溶液中存在: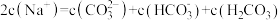 |
B.第二次过滤后所得滤渣中加盐酸发生反应的离子方程式为: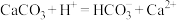 |
C. 溶液的浓度至少为 溶液的浓度至少为 |
D. 溶液浸泡后的溶液中一定存在 溶液浸泡后的溶液中一定存在 |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】下列操作能达到目的的是
| 选项 | 操作 | 目的 |
| A | 向10 mL0.1 mol·L-1草酸溶液中先滴加1 mL0.1 mol·L-1KMnO4溶液,再滴加1 mL 0.2 mol·L-1KMnO4溶液 | 探究浓度对反应速率的影响 |
| B | 分别用pH计测定0.1 mol·L-1的HOCH2COOH溶液在25 °C、45 °C时的pH(浓度变化不考虑) | 探究温度对电离平衡的影响 |
| C | 将铁、铜片插入浓硝酸(常温)构成原电池,并连接电流计 | 验证原电池中较活泼金属为负极 |
| D | 向物质的量浓度均为1 mol·L-1的Na2CO3和Na2SO4混合液中加入等体积的过量AgNO3溶液 | 探究 Ag2CO3和Ag2SO4溶度积的大小 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次

 、
、 浓度均为
浓度均为 )进行实验:滴加一定量
)进行实验:滴加一定量 溶液,产生黄色沉淀;继续滴加,产生白色沉淀。已知:
溶液,产生黄色沉淀;继续滴加,产生白色沉淀。已知: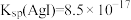 、
、 。下列分析
。下列分析 ,白色沉淀是
,白色沉淀是

 )
)