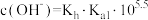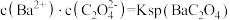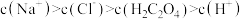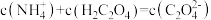某温度下,分别向 和
和 溶液中滴加
溶液中滴加 溶液,滴加过程中
溶液,滴加过程中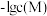 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确 的是
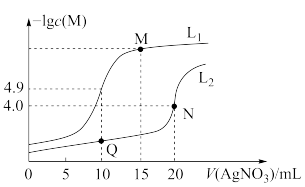
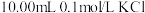 和
和 溶液中滴加
溶液中滴加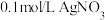 溶液,滴加过程中
溶液,滴加过程中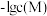 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
A.曲线 表示 表示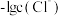 与 与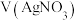 的变化关系 的变化关系 |
B.M点溶液中: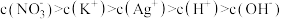 |
C.该温度下,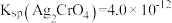 |
D.相同实验条件下,若改为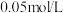 的 的 和 和 溶液,则曲线 溶液,则曲线 中N点移到Q点 中N点移到Q点 |
2020高三·全国·专题练习 查看更多[19]
2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】福建省厦门市2020届高三毕业班五月质量检查理综化学试题福建省厦门市2020届高三高考化学模拟(5月份)理综化学试题(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编河北省石家庄市2019届高三毕业班模拟考试(一)化学试题湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)广东省广州市第六中学2022届高三第三次模拟考试化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)化学(湖南A卷)-学易金卷:2023年高考化学第一次模拟考试卷(已下线)化学(湖北A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)化学(山东B卷)-学易金卷:2023年高考第一次模拟考试卷湖南省长沙市明达中学2022-2023学年高三下学期2月月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第53讲 沉淀溶解平衡图像的分析(已下线)2022年福建省高考真题变式题(选择题6-10)湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题(已下线)第5讲 难溶电解质的溶解平衡陕西省西安交通大学附属中学2023-2024年高二上学期第一次月考化学试题
更新时间:2022-01-11 20:51:21
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】在 时,向
时,向 溶液滴加入
溶液滴加入 的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数
的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数 随pH变化的关系如图2所示,下列表述正确的是
随pH变化的关系如图2所示,下列表述正确的是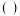
 时,向
时,向 溶液滴加入
溶液滴加入 的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数
的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数 随pH变化的关系如图2所示,下列表述正确的是
随pH变化的关系如图2所示,下列表述正确的是

A.b点时,溶液中微粒浓度大小的关系: |
B.d点溶液垂直的关系: |
| C.图2中的e点对应图1中的c点 |
| D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】下列说法正确 的是( )
| A.常温下将pH均为a的氢氧化钠溶液和氢氧化钡溶液分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a |
| B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(HA-)<c(A2-) |
C.室温时,M(OH)2(s) M2+(aq)+2OH-(aq)Ksp=a;c(M2+)=bmol·L-1时,溶液的pH等于14+ M2+(aq)+2OH-(aq)Ksp=a;c(M2+)=bmol·L-1时,溶液的pH等于14+ lg lg |
| D.Na2C2O4溶液:c(OH-)+2c(H2C2O4)=c(H+)+c(HC2O4-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】羟氨(NH2OH )为一元弱碱 (25℃时 ,电离常数 Kb=9.0×l0-9), 其电离方程式为:NH2OH+H2O NH3OH+ +OH-。用 0.lmol/L 盐酸滴定 20mL0.l mol/L NH2OH 溶液,恒定 25℃时, 滴定过程中由水电离出来OH-浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。 下列说法正确的是
NH3OH+ +OH-。用 0.lmol/L 盐酸滴定 20mL0.l mol/L NH2OH 溶液,恒定 25℃时, 滴定过程中由水电离出来OH-浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。 下列说法正确的是
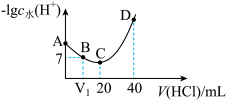
 NH3OH+ +OH-。用 0.lmol/L 盐酸滴定 20mL0.l mol/L NH2OH 溶液,恒定 25℃时, 滴定过程中由水电离出来OH-浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。 下列说法正确的是
NH3OH+ +OH-。用 0.lmol/L 盐酸滴定 20mL0.l mol/L NH2OH 溶液,恒定 25℃时, 滴定过程中由水电离出来OH-浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。 下列说法正确的是
| A.A、B、C、D 四点对应的溶液中 NH2OH 电离常数不相等 |
| B.A 点对应溶液的 pH=8.5 |
| C.D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH) |
| D.B点时溶液呈中性,C 点时溶液呈酸性 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】已知:常温下邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化曲线如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是
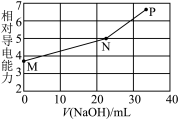

| A.M点离子浓度:c(K+)>c(HA-)>c(H2A)>c(A2-) |
| B.N点溶液中存在:c(Na+)+c(K+)>2c(A2-)+c(HA-) |
| C.P点溶液中一定存在:c(Na+)>c(OH-)>c(K+)>c(A2-) |
| D.从M到P之间的任一点均存在:c(Na+)+c(K+)+c(H+)=c(A2-)+c(HA-)+c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】在下列各溶液中各离子的浓度由大到小排列顺序正确的是
| A.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
| B.Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.NaHSO3溶液中:c(Na+)﹥c(HSO3-)>c(H+)>c(SO32-)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
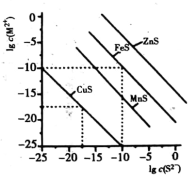
【推荐1】下图所示与对应叙述相符的是
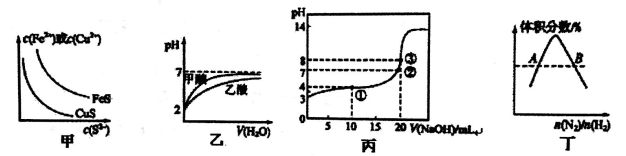

| A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)<Ksp(CuS) |
| B.图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 |
| C.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,pH变化曲线如图丙所示(忽略温度变化),则①点c(CH3COO-)>c(Na+)>c(CH3COOH) |
D.图丁表示反应N2(g)+3H2(g) 2NH3(g)平衡时NH3体积分数随起始 2NH3(g)平衡时NH3体积分数随起始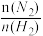 变化的曲线,则转化率:αA(H2)=αB(H2) 变化的曲线,则转化率:αA(H2)=αB(H2) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】已知室温时Ksp(CaCO3)=3.36×10-9,Ksp(CaF2)=3.45×10-11。下列关于CaCO3和CaF2两悬浊液说法错误的是
| A.CaCO3和CaF2两悬浊液中前者的c(Ca2+)较小 |
| B.分别滴加稀硫酸,CaCO3与CaF2的溶度积常数均增大 |
C.分别加入0.1 mol·L-1的CaCl2溶液,c( )和c(F-)均减小 )和c(F-)均减小 |
D.CaCO3和CaF2共存的饱和溶液中,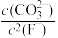 的值约为97.4 的值约为97.4 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的pH可使
。通过调节溶液的pH可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 mol/L,体系中
mol/L,体系中 、
、 、
、 ,
, 浓度(mol/L)的负对数pM与pH的关系如图所示。已知:
浓度(mol/L)的负对数pM与pH的关系如图所示。已知: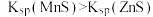 。下列说法不正确的是
。下列说法不正确的是
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的pH可使
。通过调节溶液的pH可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 mol/L,体系中
mol/L,体系中 、
、 、
、 ,
, 浓度(mol/L)的负对数pM与pH的关系如图所示。已知:
浓度(mol/L)的负对数pM与pH的关系如图所示。已知: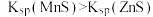 。下列说法不正确的是
。下列说法不正确的是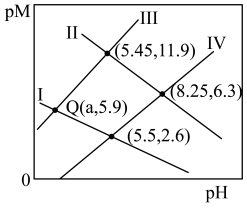
A.Ⅱ表示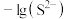 与pH的关系曲线 与pH的关系曲线 |
B.Q点对应 的数量级为 的数量级为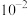 |
C.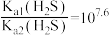 |
D.溶液中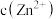 和 和 均为0.1mol/L, 均为0.1mol/L, 完全沉淀时溶液的最小pH为2 完全沉淀时溶液的最小pH为2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,CaCO3和CaF2的沉淀溶解平衡曲线如图[ pX=-lgc(Xn-)、pCa=-lgc( Ca2+)],已知Ksp( CaCO3)>Ksp( CaF2),下列说法正确的是
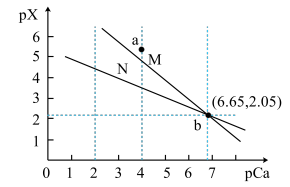

| A.曲线M为CaF2的沉淀溶解平衡曲线 |
B.常温下,CaCO3(s) +2F-(aq)  CaF2(s) + CaF2(s) +  (aq)的化学平衡常数K= 10-2.05 (aq)的化学平衡常数K= 10-2.05 |
C.在CaCl2溶液中加碳酸钠溶液,当溶液中c( )的浓度大于1. 0 ×10-3时,可以确定Ca2+沉淀完全 )的浓度大于1. 0 ×10-3时,可以确定Ca2+沉淀完全 |
| D.a点为悬浊液,过滤可得固体 |
您最近一年使用:0次

 (
( 为
为 为
为 电离平衡常数)溶液的性质。
电离平衡常数)溶液的性质。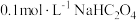 溶液的pH,测得约为5.5
溶液的pH,测得约为5.5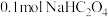 稀溶液中加入
稀溶液中加入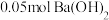 ,产生沉淀
,产生沉淀