下表是25℃时某些弱酸的电离常数,其中多元弱酸分步电离。
(1)等浓度的HCOOH、 和
和 溶液中,水电离出的氢离子浓度:
溶液中,水电离出的氢离子浓度:_______ >_______ >_______ 。
(2)根据表中数据判断下述反应可以发生的是_______ 。(填编号)
①
②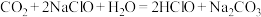
③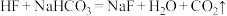
④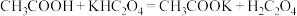
(3)少量 通入NaCN溶液中发生反应的离子方程式为
通入NaCN溶液中发生反应的离子方程式为_______ 。
(4)常温下在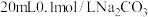 溶液中逐滴滴加
溶液中逐滴滴加 盐酸溶液40mL,溶液中含碳元素的三种微粒
盐酸溶液40mL,溶液中含碳元素的三种微粒 、
、 、
、 (
( 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
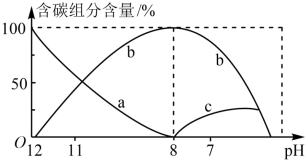
①各字母代表的粒子为b_______ ,c_______ 。
②在同一溶液中, 、
、 、
、
_______ (填“能”或“不能”)大量共存。
③当 时,溶液中含碳元素的主要微粒为
时,溶液中含碳元素的主要微粒为_______ 。
(5)若以熔融 作为电解质,写出
作为电解质,写出 燃料电池负极的电极反应式
燃料电池负极的电极反应式_______ 。
(6)等浓度等体积的 溶液和
溶液和 溶液混合,写出离子浓度由大到小的排序:
溶液混合,写出离子浓度由大到小的排序:_______ 。
| 弱酸 | K | 弱酸 | K |
| HF | 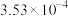 |  | 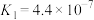  |
| HCN | 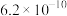 | ||
| HCOOH | 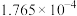 |  |  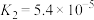 |
 | 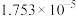 |
 和
和 溶液中,水电离出的氢离子浓度:
溶液中,水电离出的氢离子浓度:(2)根据表中数据判断下述反应可以发生的是
①

②
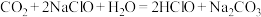
③
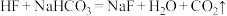
④
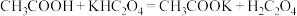
(3)少量
 通入NaCN溶液中发生反应的离子方程式为
通入NaCN溶液中发生反应的离子方程式为(4)常温下在
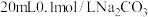 溶液中逐滴滴加
溶液中逐滴滴加 盐酸溶液40mL,溶液中含碳元素的三种微粒
盐酸溶液40mL,溶液中含碳元素的三种微粒 、
、 、
、 (
( 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
①各字母代表的粒子为b
②在同一溶液中,
 、
、 、
、
③当
 时,溶液中含碳元素的主要微粒为
时,溶液中含碳元素的主要微粒为(5)若以熔融
 作为电解质,写出
作为电解质,写出 燃料电池负极的电极反应式
燃料电池负极的电极反应式(6)等浓度等体积的
 溶液和
溶液和 溶液混合,写出离子浓度由大到小的排序:
溶液混合,写出离子浓度由大到小的排序:
21-22高三上·天津南开·阶段练习 查看更多[2]
更新时间:2022-04-08 19:32:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】酸、碱和盐是化学中常见的试剂。依据题给信息,回答下列问题:
Ⅰ.酸碱质子理论认为:凡能给出质子( )的物质都是酸;凡能接受质子的物质都是碱。酸和碱不是孤立的,酸给出质子后生成碱,碱接受质子后变成酸,存在共轭关系。
)的物质都是酸;凡能接受质子的物质都是碱。酸和碱不是孤立的,酸给出质子后生成碱,碱接受质子后变成酸,存在共轭关系。
(1)下列微粒中,可看作酸的是___________ 。
a. B.
B. C.
C. D.
D. E.
E. F.
F.
(2) 对应的共轭酸是
对应的共轭酸是___________ , 对应的共轭碱是
对应的共轭碱是___________ 。
Ⅱ.酸、碱在某种溶液中表现出的酸或碱的强度,不仅与其本质有关,也与溶剂的性质有关。t℃下 、
、 、
、 和HCl四种酸在冰醋酸中的
和HCl四种酸在冰醋酸中的 如表所示。
如表所示。
(3)四种酸在冰醋酸中电离程度由大到小的顺序为___________ 。
(4)t℃在冰醋酸中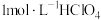 的电离度约为
的电离度约为___________ 。
(5)已知 在冰醋酸(用HAc表示)中的电离方程式可表示为:
在冰醋酸(用HAc表示)中的电离方程式可表示为: ;HCl在
;HCl在 中的电离情况与此类似,则电离方程式表示为
中的电离情况与此类似,则电离方程式表示为___________ 。
Ⅲ.已知: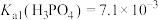 ,
,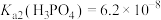 ,
,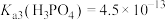 ,
,
(6)室温下将100mL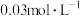 的
的 与50mL
与50mL 的
的 溶液混合后,磷元素的主要存在形式为
溶液混合后,磷元素的主要存在形式为___________ ,该混合溶液的pH___________ 7(填“>”“<”“=”)。
Ⅰ.酸碱质子理论认为:凡能给出质子(
 )的物质都是酸;凡能接受质子的物质都是碱。酸和碱不是孤立的,酸给出质子后生成碱,碱接受质子后变成酸,存在共轭关系。
)的物质都是酸;凡能接受质子的物质都是碱。酸和碱不是孤立的,酸给出质子后生成碱,碱接受质子后变成酸,存在共轭关系。(1)下列微粒中,可看作酸的是
a.
 B.
B. C.
C. D.
D. E.
E. F.
F.
(2)
 对应的共轭酸是
对应的共轭酸是 对应的共轭碱是
对应的共轭碱是Ⅱ.酸、碱在某种溶液中表现出的酸或碱的强度,不仅与其本质有关,也与溶剂的性质有关。t℃下
 、
、 、
、 和HCl四种酸在冰醋酸中的
和HCl四种酸在冰醋酸中的 如表所示。
如表所示。| 酸 | 在冰醋酸中的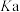 |
 | 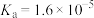 |
 | 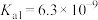 |
 | 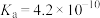 |
| HCl | 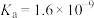 |
(4)t℃在冰醋酸中
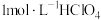 的电离度约为
的电离度约为(5)已知
 在冰醋酸(用HAc表示)中的电离方程式可表示为:
在冰醋酸(用HAc表示)中的电离方程式可表示为: ;HCl在
;HCl在 中的电离情况与此类似,则电离方程式表示为
中的电离情况与此类似,则电离方程式表示为Ⅲ.已知:
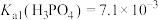 ,
,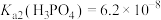 ,
,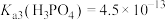 ,
,(6)室温下将100mL
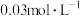 的
的 与50mL
与50mL 的
的 溶液混合后,磷元素的主要存在形式为
溶液混合后,磷元素的主要存在形式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.研究水溶液中的粒子行为在研究中具有重要价值。
(1)常常用 溶液做焊接金属的除锈剂,又最大限度降低对设备的腐蚀,请结合化学用语解释原因:
溶液做焊接金属的除锈剂,又最大限度降低对设备的腐蚀,请结合化学用语解释原因:_______ 。
(2)根据表中所列三种溶液在25℃时的相关数据,按要求填空:
(3)比较溶液(Ⅱ)、(Ⅲ)、(Ⅳ)中 的大小关系是
的大小关系是_______ 。(填序号)
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的 之比是
之比是_______ 。溶液(Ⅱ)中由水电离出的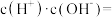
_______ mol ·L
·L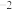 。
。
(5)将相同体积的溶液(Ⅰ)与0.1 mol/L HCl溶液均稀释100倍,则溶液pH醋酸_______ 盐酸(填>、<、=下同),加等浓度的NaOH溶液至恰好完全反应,所需NaOH溶液的体积:醋酸_______ 盐酸。
Ⅱ. 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放,将其通入NaOH溶液中,得到
的排放,将其通入NaOH溶液中,得到 溶液。
溶液。
(6) 溶液呈酸性,其原因是
溶液呈酸性,其原因是_______ 。
(7)向 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是
溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是_______ 。
(1)常常用
 溶液做焊接金属的除锈剂,又最大限度降低对设备的腐蚀,请结合化学用语解释原因:
溶液做焊接金属的除锈剂,又最大限度降低对设备的腐蚀,请结合化学用语解释原因:(2)根据表中所列三种溶液在25℃时的相关数据,按要求填空:
| 溶液 | 物质的量浓度 | pH | 用化学用语表示溶液显酸性/碱性的原因 |
(Ⅰ) | 0.1 mol/L | 3 | ① |
(Ⅱ) | 0.1 mol/L | 6 | (不需要作答) |
(Ⅲ) | 0.1 mol/L | 1 | ② |
(Ⅳ) | 0.1 mol/L | 11 | ③ |
 的大小关系是
的大小关系是(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的
 之比是
之比是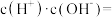
 ·L
·L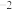 。
。(5)将相同体积的溶液(Ⅰ)与0.1 mol/L HCl溶液均稀释100倍,则溶液pH醋酸
Ⅱ.
 会对环境和人体健康带来极大的危害,工业上采取多种方法减少
会对环境和人体健康带来极大的危害,工业上采取多种方法减少 的排放,将其通入NaOH溶液中,得到
的排放,将其通入NaOH溶液中,得到 溶液。
溶液。(6)
 溶液呈酸性,其原因是
溶液呈酸性,其原因是(7)向
 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是
溶液,溶液中出现浑浊,pH降为2,用平衡移动原理解释溶液pH降低的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】如表是几种常见弱酸的电离平衡常数(25℃)。
(1) 当温度升高时,K值_____ (填“增大”“减小”或“不变”)。
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是_____ ,最弱的是_____ 。由离子反应规律及上述数据判断,下列各组物质在溶液中混合后能发生反应的有_____ (填字母)。
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由_______ 决定。假设某氢硫酸溶液的浓度为0.001 3 mol·L-1,则溶液中c(H+)=______ 。
(4) 请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于碳酸,该方案所用试剂是____ ,反应的化学方程式为_____ 。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3 H++HCO3- H++HCO3- | K1=4.4×10-7 |
HCO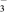  H++CO32- H++CO32- | K2=4.7×10-11 | |
| H2S | H2S H++HS- H++HS- | K1=1.3×10-7 |
HS- H++S2- H++S2- | K2=7.1×10-15 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4- | K1=7.1×10-3 |
H2PO4- H++HPO42- H++HPO42- | K2=6.3×10-8 | |
HPO42- H++PO43- H++PO43- | K3=4.2×10-13 |
(1) 当温度升高时,K值
(2) 若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是
a. CH3COOH+NaH2PO4
b. H2S+Na2CO3
c. CO2+Na2HPO4
(3) 分析多元弱酸各步电离的K值大小,你认为一定浓度的某多元弱酸溶液中,c(H+)的大小主要由
(4) 请设计一种方案,能通过直观的实验现象判断醋酸的酸性强于碳酸,该方案所用试剂是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 已知
已知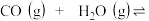
 ,在
,在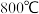 时,该反应的化学平衡常数
时,该反应的化学平衡常数 ,某时刻在2L的密闭容器中含
,某时刻在2L的密闭容器中含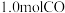 、
、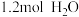 、
、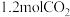 、
、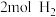 ,则上述条件下此反应
,则上述条件下此反应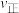
________ 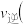 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
 有物质的量浓度相同的盐酸、硫酸、醋酸三种溶液:若三种溶液
有物质的量浓度相同的盐酸、硫酸、醋酸三种溶液:若三种溶液 依次为
依次为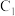 、
、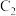 、
、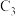 ,则它们的大小关系为
,则它们的大小关系为______________
 已知:
已知: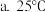 时,
时,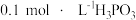 溶液的
溶液的
 与NaOH反应只生成
与NaOH反应只生成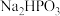 和
和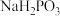 两种盐。
两种盐。

 写出
写出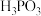 的第二步电离方程式
的第二步电离方程式______________________________ 。
 若将
若将 的
的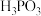 、
、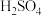 两溶液分别加水稀释,pH变化如图所示,判断图中a、b、c三点对应溶液中水的电离程度由大到小的顺序是
两溶液分别加水稀释,pH变化如图所示,判断图中a、b、c三点对应溶液中水的电离程度由大到小的顺序是________ 。 用a、b、c表示
用a、b、c表示
 和碘水反应,棕黄色退去,再滴加
和碘水反应,棕黄色退去,再滴加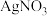 溶液,有黄色沉淀生成。请写出
溶液,有黄色沉淀生成。请写出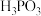 和碘水反应的化学方程式
和碘水反应的化学方程式__________________ 。
 已知
已知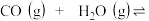
 ,在
,在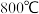 时,该反应的化学平衡常数
时,该反应的化学平衡常数 ,某时刻在2L的密闭容器中含
,某时刻在2L的密闭容器中含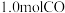 、
、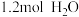 、
、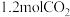 、
、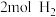 ,则上述条件下此反应
,则上述条件下此反应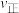
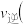 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。  有物质的量浓度相同的盐酸、硫酸、醋酸三种溶液:若三种溶液
有物质的量浓度相同的盐酸、硫酸、醋酸三种溶液:若三种溶液 依次为
依次为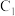 、
、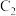 、
、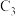 ,则它们的大小关系为
,则它们的大小关系为 已知:
已知: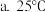 时,
时,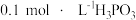 溶液的
溶液的
 与NaOH反应只生成
与NaOH反应只生成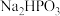 和
和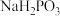 两种盐。
两种盐。
 写出
写出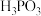 的第二步电离方程式
的第二步电离方程式 若将
若将 的
的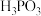 、
、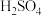 两溶液分别加水稀释,pH变化如图所示,判断图中a、b、c三点对应溶液中水的电离程度由大到小的顺序是
两溶液分别加水稀释,pH变化如图所示,判断图中a、b、c三点对应溶液中水的电离程度由大到小的顺序是 用a、b、c表示
用a、b、c表示
 和碘水反应,棕黄色退去,再滴加
和碘水反应,棕黄色退去,再滴加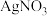 溶液,有黄色沉淀生成。请写出
溶液,有黄色沉淀生成。请写出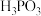 和碘水反应的化学方程式
和碘水反应的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】砷(As)是第四周期VA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途,回答下列问题:
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。化学反应化学方程式为:2As2S3+5O2+6H2O=4H3AsO4+6S。该反应需要在加压下进行,原因是:___________
(2)298K时,将20mL3xmol/L Na3AsO3、20mL3xmol/LI2和20mL NaOH溶液混合,发生反应:AsO (aq)+I2(aq)+2OH-=AsO
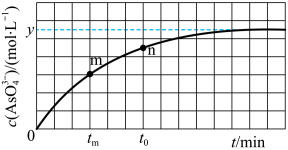
(aq)+I2(aq)+2OH-=AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡状态的是___________ (填标号)
a.溶液的pH不再变化 b.v(I-)=2v(AsO )
)
c.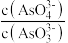 不再变化 d.c(I-)=ymol⋅L-1
不再变化 d.c(I-)=ymol⋅L-1
②tm时,v正___________ v逆(填“大于”“小于”成“等于”)
③若平衡时溶液的pH=14,则该反应的平衡常数K=___________ (用x、y代数式表示)
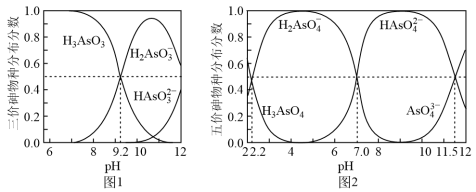
(3)常温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图−1和图−2所示。下列说法错误的是___________
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。化学反应化学方程式为:2As2S3+5O2+6H2O=4H3AsO4+6S。该反应需要在加压下进行,原因是:
(2)298K时,将20mL3xmol/L Na3AsO3、20mL3xmol/LI2和20mL NaOH溶液混合,发生反应:AsO
 (aq)+I2(aq)+2OH-=AsO
(aq)+I2(aq)+2OH-=AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡状态的是
a.溶液的pH不再变化 b.v(I-)=2v(AsO
 )
)c.
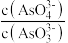 不再变化 d.c(I-)=ymol⋅L-1
不再变化 d.c(I-)=ymol⋅L-1②tm时,v正
③若平衡时溶液的pH=14,则该反应的平衡常数K=
(3)常温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图−1和图−2所示。下列说法错误的是___________

A.以酚酞为指示剂,将氢氧化钠溶液逐滴加入到亚砷酸H3AsO3溶液中,当溶液由无色变为浅红色时,主要反应的离子方程式为:OH-+H3AsO3=H2AsO +H2O +H2O |
| B.常温下,H3AsO4清液中Ka1:Ka2:Ka3=109.3:105.5:1 |
C.H3AsO4水溶液中存在:c(H+)=c(OH-)+c(H2AsO )+2c(HAsO )+2c(HAsO )+3c(AsO )+3c(AsO ) ) |
| D.H3AsO3和Na2HAsO4水溶液可发生复分解反应 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为________ kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=________ mol·L-1;往溶液中加入少量NaOH固体,则溶液中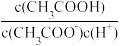
___________ (填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________ 。
(3)25℃时,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
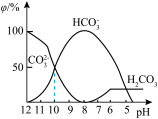
①在同一溶液中,H2CO3、HCO3-、CO32-____________ (填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的微粒主要为___________ 。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=___________ 。
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=
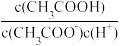
(3)25℃时,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-
②当pH=7时,溶液中含碳元素的微粒主要为
③反应的CO32-+H2O
 HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】(1)含11.2 g KOH的稀溶液与1 L0.1mol/L的H2SO4溶液反应放出11.46 kJ的热量,该反应表示中和热的热化学方程式为___________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g) 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
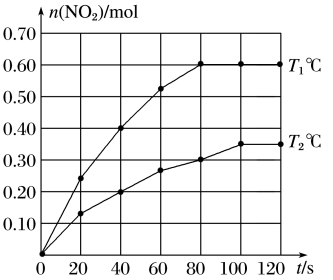
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为________ mol/(L·s)。
②ΔH________ 0(填“>”、“<”或“=”)。
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

①甲容器平衡后物质B的转化率为_______ ;
②T℃ 时该反应的平衡常数为________ 。
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显________ 性(填“酸”“碱”或“中”);
②用含a的代数式表示NH3·H2O的电离常数Kb=__________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g)
 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为
②ΔH
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)
 xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
①甲容器平衡后物质B的转化率为
②T℃ 时该反应的平衡常数为
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显
②用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】现有:①醋酸、②盐酸、③醋酸钠、④碳酸氢钠、⑤氨化钙、⑥氯化铵六种试剂。
(1)醋酸钠溶液呈碱性原因:_______ 。(化学用语)
(2)盐酸溶液与碳酸氢钠反应的离子方程式_______ 。
(3)有关0.1mol•L-1CH3COOH溶液的叙述不正确 的是_______ 。
a.与同浓度盐酸溶液的导电性不相同
b.常温下,等浓度等体积CH3COOH溶液与NaOH溶液混合后溶液pH<7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(H+)>c(OH-)
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是_______ 。
(5)室温下,向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
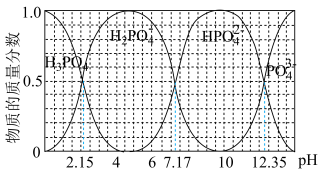
①H3PO4的电离平衡常数Ka1=_______ 。
②滴加NaOH溶液至pH=7,溶液中c(Na+)_______ c(H2PO )+c(HPO
)+c(HPO )+c(PO
)+c(PO )(填“>”“<”“=”)。
)(填“>”“<”“=”)。
(1)醋酸钠溶液呈碱性原因:
(2)盐酸溶液与碳酸氢钠反应的离子方程式
(3)有关0.1mol•L-1CH3COOH溶液的叙述
a.与同浓度盐酸溶液的导电性不相同
b.常温下,等浓度等体积CH3COOH溶液与NaOH溶液混合后溶液pH<7
c.向CH3COOH溶液中加少量CH3COONa固体,c(H+)减小
d.向CH3COOH溶液中加少量Na2CO3固体,c(CH3COO-)增大
e.CH3COOH溶液中离子浓度关系满足:c(CH3COO-)>c(H+)>c(OH-)
(4)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的c(H+)与氯化铵溶液中水电离出的c(H+)之比是
(5)室温下,向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。

①H3PO4的电离平衡常数Ka1=
②滴加NaOH溶液至pH=7,溶液中c(Na+)
 )+c(HPO
)+c(HPO )+c(PO
)+c(PO )(填“>”“<”“=”)。
)(填“>”“<”“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】现有下列物质:①熔融的NaCl;②稀硫酸;③液氯;④冰醋酸;⑤铜;⑥BaSO4;⑦NaHSO4;⑧液氨;⑨SO2;⑩Cu(OH)2固体。请按要求回答下列问题。
(1)以上物质中属于弱电解质的是___________ (填序号,下同):属于非电解质的是___________ 。
(2)已知在t1、t2温度下水的电离平衡曲线如图所示:

①t1温度时,若盐酸中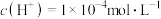 ,则由水电离产生的
,则由水电离产生的
___________  。
。
②t2温度下将pH=2的稀硫酸与pH=10的KOH溶液等体积混合后,溶液的pH=___________ 。
(3)①已知25℃,NH3·H2O的 ,
, 的
的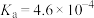 。亚硫酸电离常数为
。亚硫酸电离常数为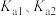 ,改变
,改变 亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,
亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,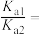
___________ 。
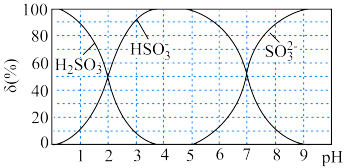
②将SO2通入氨水中,当 降至
降至 时,溶液中的
时,溶液中的
___________ ,
③将少量SO2通入NaNO2溶液发生反应的离子方程式为___________ 。
(1)以上物质中属于弱电解质的是
(2)已知在t1、t2温度下水的电离平衡曲线如图所示:

①t1温度时,若盐酸中
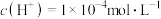 ,则由水电离产生的
,则由水电离产生的
 。
。②t2温度下将pH=2的稀硫酸与pH=10的KOH溶液等体积混合后,溶液的pH=
(3)①已知25℃,NH3·H2O的
 ,
, 的
的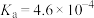 。亚硫酸电离常数为
。亚硫酸电离常数为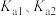 ,改变
,改变 亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,
亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,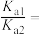

②将SO2通入氨水中,当
 降至
降至 时,溶液中的
时,溶液中的
③将少量SO2通入NaNO2溶液发生反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为___________ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将___________ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c( )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是___________ ,上述四种离子浓度的大小顺序为___________ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为___________ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________ c(NH3·H2O) (填“大于”“小于”或“等于”)。
Ⅲ.用酸碱中和滴定法测定某市售白醋(含 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:
(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴___________ 作指示剂。
②用0.1000mol/L NaOH溶液滴定,当___________ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定4次。
③实验记录如下:
按上述数处理,可得c(市售白醋)=___________ mol/L。
④在本实验的滴定过程中,下列操作会使实验结果偏高的是___________ (填字母)。
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
 +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(
 )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
Ⅲ.用酸碱中和滴定法测定某市售白醋(含
 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴
②用0.1000mol/L NaOH溶液滴定,当
③实验记录如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(稀释白醋)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
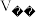 (NaOH)/mL (NaOH)/mL | 15.00 | 15.04 | 14.96 | 16.52 |
④在本实验的滴定过程中,下列操作会使实验结果偏高的是
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上生产硫酸时,将 氧化为
氧化为 是关键一步。
是关键一步。
(1)某温度下, 。开始时在10L的密闭容器中加入
。开始时在10L的密闭容器中加入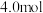
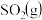 和
和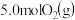 ,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=___________ 。
(2)一定条件下,向一带活塞的密闭容器中充入 和
和 ,发生下列反应:
,发生下列反应: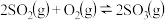 达到平衡后改变下述条件,
达到平衡后改变下述条件, 、
、 、
、 气体平衡浓度都比原来增大的是
气体平衡浓度都比原来增大的是 ___________ 。
A.保持温度和容器体积不变,充入2mol
B.保持温度和容器体积不变,充入2mol
C.保持温度和容器体积不变,充入
 和
和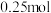

D.保持温度和容器内压强不变,充入1mol
E.升高温度
F.移动活塞压缩气体
(3)某人设想以如图所示装置用电化学原理生产硫酸,写出通入 的电极的电极反应式:
的电极的电极反应式: ___________ 。
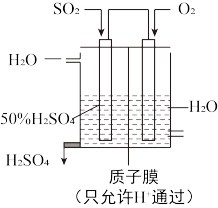
(4)在 的
的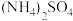 溶液中,离子浓度由大到小的顺序是
溶液中,离子浓度由大到小的顺序是 ___________ 。
 氧化为
氧化为 是关键一步。
是关键一步。(1)某温度下,
 。开始时在10L的密闭容器中加入
。开始时在10L的密闭容器中加入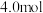
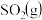 和
和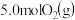 ,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=(2)一定条件下,向一带活塞的密闭容器中充入
 和
和 ,发生下列反应:
,发生下列反应: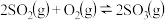 达到平衡后改变下述条件,
达到平衡后改变下述条件, 、
、 、
、 气体平衡浓度都比原来增大的是
气体平衡浓度都比原来增大的是 A.保持温度和容器体积不变,充入2mol

B.保持温度和容器体积不变,充入2mol

C.保持温度和容器体积不变,充入

 和
和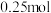

D.保持温度和容器内压强不变,充入1mol

E.升高温度
F.移动活塞压缩气体
(3)某人设想以如图所示装置用电化学原理生产硫酸,写出通入
 的电极的电极反应式:
的电极的电极反应式: 
(4)在
 的
的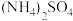 溶液中,离子浓度由大到小的顺序是
溶液中,离子浓度由大到小的顺序是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】“一碳化学”是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。发展“一碳化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“一碳化学”途径制取乙二醇的过程: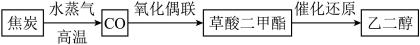
(1)在容积为2L的密闭容器中,由CO和H2合成乙醇的反应为
2CO(g)+ 4H2(g) ⇌ CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
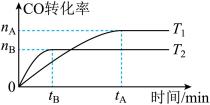
①根据上图可推知该反应ΔH_________ 0(填“>”、“<”或“=”)。
②该反应的平衡常数表达式为____________ ,降低温度平衡常数将_____ (填“变大”、“变小”或“不变”)。
③下列说法中能判断该反应达到化学平衡状态的是_________ (选填编号)。
a.容器中的压强不变 b.混合气体的密度不再变化
c.v正(CO)=2v逆(H2O) d.混合气体的平均相对分子质量不再变化
(2)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①用离子方程式解释KHC2O4溶液显酸性的原因:_______________ 。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是________ (填序号)。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>c(Na+)
(3)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式______________________________ 。以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为_____________ 。

(1)在容积为2L的密闭容器中,由CO和H2合成乙醇的反应为
2CO(g)+ 4H2(g) ⇌ CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):

①根据上图可推知该反应ΔH
②该反应的平衡常数表达式为
③下列说法中能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.混合气体的密度不再变化
c.v正(CO)=2v逆(H2O) d.混合气体的平均相对分子质量不再变化
(2)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①用离子方程式解释KHC2O4溶液显酸性的原因:
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>c(Na+)
(3)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式
您最近一年使用:0次



