甲醇和甲醛是重要的化工原料。利用气态甲醇在催化剂条件下脱氢制备甲醛的主要反应为: ,反应机理图示如下:(其中虚线部分为副反应)
,反应机理图示如下:(其中虚线部分为副反应)
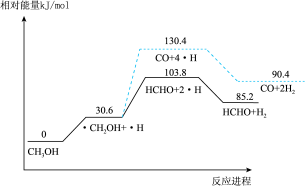
回答下列问题:
(1)主要反应的最大能垒为_______  。
。
(2)副反应的热化学方程式为_______ 。
(3)已知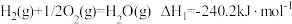
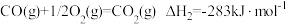
则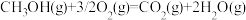 的
的
_______  。
。
(4)在体积 的刚性容器中,投入
的刚性容器中,投入 气态
气态 ,在一定催化剂作用下,反应时间
,在一定催化剂作用下,反应时间 时,分别测得甲醇转化率和甲醛的选择性与温度的关系,如下图所示:(甲醛的选择性:转化的
时,分别测得甲醇转化率和甲醛的选择性与温度的关系,如下图所示:(甲醛的选择性:转化的 中生成
中生成 的百分比)。
的百分比)。
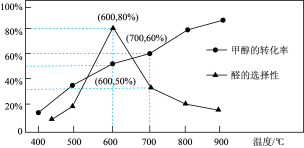
① 时
时 内生成甲醛的平均反应速率是
内生成甲醛的平均反应速率是_______ 。
②若 时
时 恰好平衡,容器的初始压强为
恰好平衡,容器的初始压强为 ,甲醇的转化率为
,甲醇的转化率为 ,甲醛的选择性为
,甲醛的选择性为 ,主要反应
,主要反应 的压强平衡常数
的压强平衡常数 为
为_______ 。
③ 以后,甲醛的选择性下降的可能原因为
以后,甲醛的选择性下降的可能原因为_______ 。
(5)利用甲醇、氯气和氢气为原料在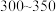 ℃及一定催化剂条件下制取一氯甲烷,反应原理如下:
℃及一定催化剂条件下制取一氯甲烷,反应原理如下: 。现将等物质的量的反应物分别投入到温度相同,容积是1L、2L的甲乙两个恒温、恒容的容器中,达到平衡(不考虑副反应发生),下列说法正确的是_______(填字母代号)。
。现将等物质的量的反应物分别投入到温度相同,容积是1L、2L的甲乙两个恒温、恒容的容器中,达到平衡(不考虑副反应发生),下列说法正确的是_______(填字母代号)。
 ,反应机理图示如下:(其中虚线部分为副反应)
,反应机理图示如下:(其中虚线部分为副反应)
回答下列问题:
(1)主要反应的最大能垒为
 。
。(2)副反应的热化学方程式为
(3)已知
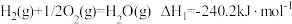
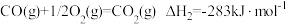
则
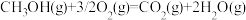 的
的
 。
。(4)在体积
 的刚性容器中,投入
的刚性容器中,投入 气态
气态 ,在一定催化剂作用下,反应时间
,在一定催化剂作用下,反应时间 时,分别测得甲醇转化率和甲醛的选择性与温度的关系,如下图所示:(甲醛的选择性:转化的
时,分别测得甲醇转化率和甲醛的选择性与温度的关系,如下图所示:(甲醛的选择性:转化的 中生成
中生成 的百分比)。
的百分比)。
①
 时
时 内生成甲醛的平均反应速率是
内生成甲醛的平均反应速率是②若
 时
时 恰好平衡,容器的初始压强为
恰好平衡,容器的初始压强为 ,甲醇的转化率为
,甲醇的转化率为 ,甲醛的选择性为
,甲醛的选择性为 ,主要反应
,主要反应 的压强平衡常数
的压强平衡常数 为
为③
 以后,甲醛的选择性下降的可能原因为
以后,甲醛的选择性下降的可能原因为(5)利用甲醇、氯气和氢气为原料在
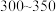 ℃及一定催化剂条件下制取一氯甲烷,反应原理如下:
℃及一定催化剂条件下制取一氯甲烷,反应原理如下: 。现将等物质的量的反应物分别投入到温度相同,容积是1L、2L的甲乙两个恒温、恒容的容器中,达到平衡(不考虑副反应发生),下列说法正确的是_______(填字母代号)。
。现将等物质的量的反应物分别投入到温度相同,容积是1L、2L的甲乙两个恒温、恒容的容器中,达到平衡(不考虑副反应发生),下列说法正确的是_______(填字母代号)。A.甲乙密度相同,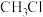 的体积分数不同 的体积分数不同 |
| B.甲乙正反应速率不同,放出的热量相同 |
| C.甲乙压强不同,混合气体的平均相对分子质量相同 |
D.甲乙 的转化率相同,混合气体的颜色相同 的转化率相同,混合气体的颜色相同 |
更新时间:2022-04-30 19:03:16
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】燃煤造成的S2的大量排放已经给我们的生存环境造成了严重破坏,科学研究发现:一定条件下,通过下列反应可实现燃煤烟气中硫的回收。
(1)已知:2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
则反应2CO(g)+SO2(g)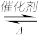 2CO2(g)十S(l) △H=
2CO2(g)十S(l) △H=________ kJ/mol
(2)燃煤烟气中硫的回收反应的平衡常数表达式K=_________ 。在温度和容积不变时,下列说法正确的是_________ (填字母序号)
A.容器内压强不再改变时,反应达到平衡状态
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.当n((CO):n(SO2):n(CO2)=2:1:2时,反应达到平衡状态
D.其他条件不变,使用不同催化剂,该反应平衡常数变化
(3)假设在容器中发生上述反应,下列能提高SO2转化率的是_________ (填字母序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.增大容器的体积
(4)SO2尾气处理的方法之一是将尾气直接通入NaOH溶液中。若将 1mol SO2气体通入1L2mol/L的NaOH溶液中所得溶液中离子浓度由大到小的顺序为_____________ ;
(5)尾气中的CO可以制成CO-----空气燃料电池。CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。该电池负极的电极反应式为_______________ ;总反应式为__________________________________________________ 。
(1)已知:2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
则反应2CO(g)+SO2(g)
 2CO2(g)十S(l) △H=
2CO2(g)十S(l) △H=(2)燃煤烟气中硫的回收反应的平衡常数表达式K=
A.容器内压强不再改变时,反应达到平衡状态
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.当n((CO):n(SO2):n(CO2)=2:1:2时,反应达到平衡状态
D.其他条件不变,使用不同催化剂,该反应平衡常数变化
(3)假设在容器中发生上述反应,下列能提高SO2转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.增大容器的体积
(4)SO2尾气处理的方法之一是将尾气直接通入NaOH溶液中。若将 1mol SO2气体通入1L2mol/L的NaOH溶液中所得溶液中离子浓度由大到小的顺序为
(5)尾气中的CO可以制成CO-----空气燃料电池。CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。该电池负极的电极反应式为
您最近一年使用:0次
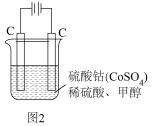
【推荐2】甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。
(1) ,
,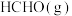 燃烧热
燃烧热 分别
分别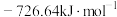 和
和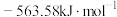 ,则
,则 与
与 反应生成
反应生成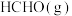 和
和 热化学反应方程式:
热化学反应方程式:___________ 。
(2)利用工业废气中的CO2可制取甲醇,其反应为: 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:___________ 。
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为___________ 。
②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象);阳极上收集到氧气的物质的量为___________ mol。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
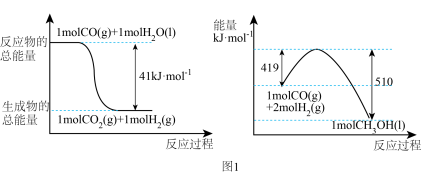
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
写出阳极电极反应式:___________ 。
(1)
 ,
,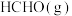 燃烧热
燃烧热 分别
分别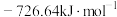 和
和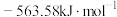 ,则
,则 与
与 反应生成
反应生成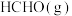 和
和 热化学反应方程式:
热化学反应方程式:(2)利用工业废气中的CO2可制取甲醇,其反应为:
 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了
 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
| 离子 | 铜离子 | 氢离子 | 氯离子 | 硫酸根离子 |
 | 1 | 4 | 4 | 1 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将
 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
写出阳极电极反应式:
您最近一年使用:0次
【推荐3】“氯碱工业”以电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。请回答:
(1)电解饱和食盐水制取氯气的化学方程式是___ 。
(2)下列说法不正确 的是___ 。
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g) Cl2(aq) K1=
Cl2(aq) K1=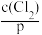
Cl2(aq)+H2O(l) H+(aq)+Cl-(aq)+HClO(aq) K2
H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g) Cl2(aq)的熵变△S1
Cl2(aq)的熵变△S1___ 0(填“>”、“=”或“<”,右同),焓变△H1___ 0。
②平衡常数K2的表达式为K2=___ 。
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为:
Ⅰ.TiO2(s)+2Cl2(g) TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29
TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29
Ⅱ.2C(s)+O2(g) 2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048
2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048
Ⅲ.TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g) △H3=
TiCl4(g)+2CO(g) △H3=___ ,K3=___ 。结合数据说明 氯化过程中加碳的理由___ 。
(1)电解饱和食盐水制取氯气的化学方程式是
(2)下列说法
| A.可采用碱石灰干燥氯气 |
| B.可通过排饱和食盐水法收集氯气,遵循平衡移动原理 |
| C.常温下,可通过加压使氯气液化而储存于钢瓶中 |
| D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸 |
Cl2(g)
 Cl2(aq) K1=
Cl2(aq) K1=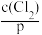
Cl2(aq)+H2O(l)
 H+(aq)+Cl-(aq)+HClO(aq) K2
H+(aq)+Cl-(aq)+HClO(aq) K2其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)
 Cl2(aq)的熵变△S1
Cl2(aq)的熵变△S1②平衡常数K2的表达式为K2=
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为:
Ⅰ.TiO2(s)+2Cl2(g)
 TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29
TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29Ⅱ.2C(s)+O2(g)
 2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048
2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048Ⅲ.TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(g)+2CO(g) △H3=
TiCl4(g)+2CO(g) △H3=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】某工厂的废渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,为实现变废为宝,设计了以下工艺流程制备七水硫酸镁。
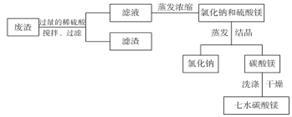
在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为_____________________________ ;
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、 、Cl-,为了除去H+,最好加入适量的
、Cl-,为了除去H+,最好加入适量的_____________________________ (填化学式)。
(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸气并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠____________ (“大”或“小”)。 结晶槽中硫酸镁结晶的方法为_______________ 。
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为____________ 。

在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、
 、Cl-,为了除去H+,最好加入适量的
、Cl-,为了除去H+,最好加入适量的(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸气并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】火法有色金属冶炼烟气制酸过程中会产生大量含砷污酸,采用硫化-石膏中和法处理含砷污酸可获得达标废水,同时实现变废为宝得到多级产品,工艺流程如下:
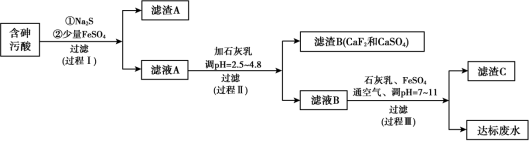
资料:
ⅰ. 常温下H2CO3的Ka1 = 4.4×10-7 ,Ka2 = 4.7×10-11;H2S的Ka1 = 1.3×10-7 ,Ka2 = 7.1×10-15;
ⅱ. 含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F-、SO 含量均超标;
含量均超标;
ⅲ.室温下三价砷在水溶液中的存在形式与溶液pH的关系:
(1)工业上制备Na2S时,用NaOH溶液吸收H2S,不能以纯碱代替NaOH。结合方程式解释不能使用纯碱的原因___________ 。
(2)过程Ⅰ可除去含砷污酸中的Cu2+和部分砷,滤渣A 的主要成分为CuS和As2S3,生成As2S3的离子方程式是___________ 。
(3)过程Ⅰ会发生副反应As2S3(s)+3S2-(aq) 2AsS
2AsS (aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因
(aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因___________ 。
(4)过程Ⅲ中获得的滤渣C主要成分是FeAsO4, 该过程通入空气的作用是___________ 。
(5)利用反应AsO +2I-+2H+ =AsO
+2I-+2H+ =AsO +I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到
+I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到___________ 现象说明已到滴定终点,重复三次实验,记录用去Na2S2O3溶液体积为V mL,计算样品纯度为 ___________ (用字母表示)。
资料:2Na2S2O3+I2=Na2S4O6+2NaI;FeAsO4相对分子质量为195

资料:
ⅰ. 常温下H2CO3的Ka1 = 4.4×10-7 ,Ka2 = 4.7×10-11;H2S的Ka1 = 1.3×10-7 ,Ka2 = 7.1×10-15;
ⅱ. 含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F-、SO
 含量均超标;
含量均超标;ⅲ.室温下三价砷在水溶液中的存在形式与溶液pH的关系:
| pH值 | pH<7 | pH=10~11 |
| 主要存在形式 | H3AsO3 | H2AsO |
(2)过程Ⅰ可除去含砷污酸中的Cu2+和部分砷,滤渣A 的主要成分为CuS和As2S3,生成As2S3的离子方程式是
(3)过程Ⅰ会发生副反应As2S3(s)+3S2-(aq)
 2AsS
2AsS (aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因
(aq),影响后续处理。加入Na2S充分反应后加入少量FeSO4,结合平衡移动原理解释加入FeSO4的原因(4)过程Ⅲ中获得的滤渣C主要成分是FeAsO4, 该过程通入空气的作用是
(5)利用反应AsO
 +2I-+2H+ =AsO
+2I-+2H+ =AsO +I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到
+I2+H2O 测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解,加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,观察到资料:2Na2S2O3+I2=Na2S4O6+2NaI;FeAsO4相对分子质量为195
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在铁系催化剂作用下,二氧化碳催化加氢合成乙烯。发生的主要反应如下:
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H1
C2H4(g)+4H2O(g) △H1
II.CO2(g)+H2(g) CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0
回答下列问题:
(1)在密闭容器中通入1mol CO2和3mol H2,在铁系催化剂作用下进行反应,某一压强下,CO2的平衡转化率随温度的变化如图1所示。
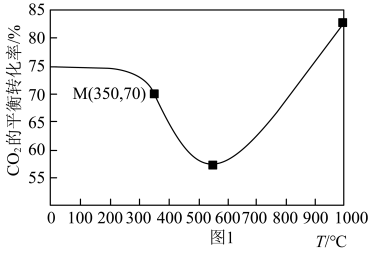
①下列说法正确的是______ (填选项字母)。
A.由图1可知:在该压强下,200-550℃之间以反应I为主,550℃后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以增大压强反应II的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将CO2和H2的初始物质的量之比变为2:3,可提高CO2平衡转化率
②图1中点M(350,70),此时乙烯的选择性为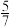 [选择性=
[选择性=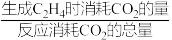 ]。
]。
计算该温度时反应II的平衡常数K=_______ (结果用分数表示)。
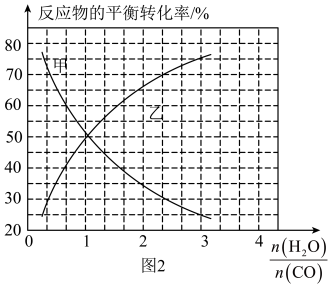
(2)恒温恒容密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[
CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[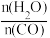 ]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向
]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向________ (填“正向”或“逆向”)进行。
(3)工业上乙醇脱水可制得二乙醚:2C2H5OH(g) C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。
C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。
①C2H5OC2H5的体积分数为________ 。
②平衡常数K=________ (用k正、k逆表示)。
③当温度变为T2时,k正=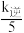 ,则T1
,则T1________ T2(填“大于”“小于”或“等于”)。
I.2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H1
C2H4(g)+4H2O(g) △H1II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0回答下列问题:
(1)在密闭容器中通入1mol CO2和3mol H2,在铁系催化剂作用下进行反应,某一压强下,CO2的平衡转化率随温度的变化如图1所示。

①下列说法正确的是
A.由图1可知:在该压强下,200-550℃之间以反应I为主,550℃后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以增大压强反应II的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将CO2和H2的初始物质的量之比变为2:3,可提高CO2平衡转化率
②图1中点M(350,70),此时乙烯的选择性为
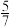 [选择性=
[选择性=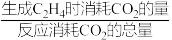 ]。
]。计算该温度时反应II的平衡常数K=
(2)恒温恒容密闭容器中发生反应CO(g)+H2O(g)
 CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[
CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[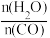 ]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向
]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向
(3)工业上乙醇脱水可制得二乙醚:2C2H5OH(g)
 C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。
C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。①C2H5OC2H5的体积分数为
②平衡常数K=
③当温度变为T2时,k正=
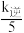 ,则T1
,则T1
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】为解决大气中CO2的含量增大的问题,某科学家提出把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,再转变为燃料甲醇的“绿色自由”构想,其部分技术流程如图:
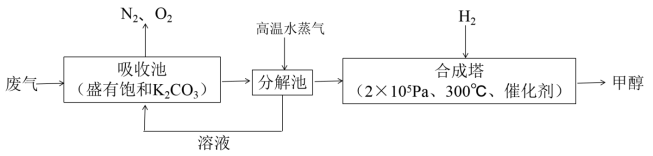
(1) 吸收池中主要反应的离子方程式为____
(2) 合成塔中合成1molCH3OH(g)的反应热是ΔH1,则该反应的热化学方程式为____ ;工业上CO也可用于合成甲醇,已知:2CO(g)+O2(g)=2CO2(g) ΔH2;2H2(g)+O2(g)=2H2O(g) ΔH3;则CO(g)+2H2(g)=CH3OH(g) ΔH4=____ (用ΔH1、ΔH2、ΔH3表示)。
(3) 一定温度下,向2L恒容密闭容器中加入1molCH3OH(g),发生反应CH3OH(g) CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。

① 反应达到平衡状态的标志是____ (填序号)。
A. 气体的密度保持不变
B. 气体的平均摩尔质量保持不变
C . 2v正(H2)=v逆(CO)
D. c(CH3OH):c(CO):c(H2)=1:1:2的时候
E. 气体的体积分数保持不变
② 在该温度下,此反应的化学平衡常数K=______ ,若在t1时刻再加入1mol CH3OH(g),在t2时刻重新达到平衡,则在t2时刻CO的体积分数____ 0.25(填“>”、“<”或“=”)。

(1) 吸收池中主要反应的离子方程式为
(2) 合成塔中合成1molCH3OH(g)的反应热是ΔH1,则该反应的热化学方程式为
(3) 一定温度下,向2L恒容密闭容器中加入1molCH3OH(g),发生反应CH3OH(g)
 CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
CO(g)+2H2(g),CO的体积分数随时间的变化如图所示。
① 反应达到平衡状态的标志是
A. 气体的密度保持不变
B. 气体的平均摩尔质量保持不变
C . 2v正(H2)=v逆(CO)
D. c(CH3OH):c(CO):c(H2)=1:1:2的时候
E. 气体的体积分数保持不变
② 在该温度下,此反应的化学平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】一氧化碳可用于制甲酸钠,也可以在冶金工业中作还原剂,还可以作气体燃料,如水煤气(一氧化碳和氢气等气体的混合物)。在一恒容密闭容器中发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) △H。请回答下列问题:
CO2(g)+H2(g) △H。请回答下列问题:
(1)加快该反应的反应速率的措施是____ (写一条即可)。
(2)已知化学键数据如表:
由此计算△H=____ 。
(3)判断该反应达到平衡的依据是____ 。
a.正、逆反应速率都为零 b.容器内压强不在变化
c.CO、H2O、CO2、H2的浓度都不再发生变化 d.单位时间内生成1molH2,同时生成1molCO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:
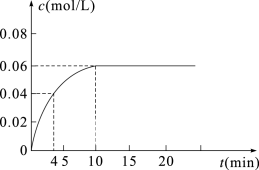
①反应到4min时,H2O(g)的转化率为____ 。
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率为v(CO)=____ mol/(L•min);反应达平衡时,H2的体积分数为____ ,该温度下的平衡常数K=____ 。
 CO2(g)+H2(g) △H。请回答下列问题:
CO2(g)+H2(g) △H。请回答下列问题:(1)加快该反应的反应速率的措施是
(2)已知化学键数据如表:
| 化学键 | H-H | C=O | C≡O(CO) | H-O |
| E/(kJ•mol-1) | 436 | 750 | 1076 | 463 |
(3)判断该反应达到平衡的依据是
a.正、逆反应速率都为零 b.容器内压强不在变化
c.CO、H2O、CO2、H2的浓度都不再发生变化 d.单位时间内生成1molH2,同时生成1molCO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:

①反应到4min时,H2O(g)的转化率为
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率为v(CO)=
您最近一年使用:0次
【推荐3】二甲醚(CH3OCH3)被称为“21世纪的清洁燃料”。以CO2、H2为原料制备二甲醚涉及的主要反应如下:
Ⅰ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ·mol-1
CO(g)+H2O(g) △H2=+41.1kJ·mol-1
回答下列问题:
(1)反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=
CH3OCH3(g)+H2O(g)的△H=___________ 。该反应在___________ (填“较高温度”、“较低温度”或“任意温度”)下能自发进行。
(2)在压强不变、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。
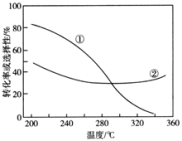
已知:CH3OCH3的选择性=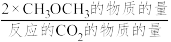
其中表示平衡时CH3OCH3的选择性的是曲线___________ (填“①”或“②”);投料一定时,为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为___________ ;
A.高温高压 B.低温高压 C.高温低压 D.低温低压
温度高于300℃时,曲线②随温度升高而升高的原因是___________ 。
(3)对于反应CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
①升高温度,k正-k逆___________ (填“增大”、“减小”或“不变”);
②在TK、101kPa下,按照n(CO2)∶n(H2)=1∶1投料,CO2转化率为50%时, 逆=1.25
逆=1.25 正,计算用气体分压表示的平衡常数KP=
正,计算用气体分压表示的平衡常数KP=___________ 。
(4)下图为绿色“二甲醚燃料电池”的工作原理示意图。
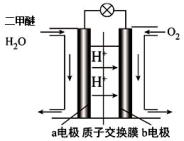
①a电极的电极反应式为___________ 。
②标准状况下,该电池每消耗11.2LO2,有___________ molH+向___________ 极移动(填“a”或“b”)。
Ⅰ.2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ·mol-1
CO(g)+H2O(g) △H2=+41.1kJ·mol-1回答下列问题:
(1)反应2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)的△H=
CH3OCH3(g)+H2O(g)的△H=(2)在压强不变、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。

已知:CH3OCH3的选择性=
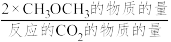
其中表示平衡时CH3OCH3的选择性的是曲线
A.高温高压 B.低温高压 C.高温低压 D.低温低压
温度高于300℃时,曲线②随温度升高而升高的原因是
(3)对于反应CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。①升高温度,k正-k逆
②在TK、101kPa下,按照n(CO2)∶n(H2)=1∶1投料,CO2转化率为50%时,
 逆=1.25
逆=1.25 正,计算用气体分压表示的平衡常数KP=
正,计算用气体分压表示的平衡常数KP=(4)下图为绿色“二甲醚燃料电池”的工作原理示意图。

①a电极的电极反应式为
②标准状况下,该电池每消耗11.2LO2,有
您最近一年使用:0次



