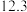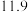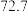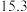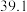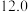在铁系催化剂作用下,二氧化碳催化加氢合成乙烯。发生的主要反应如下:
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H1
C2H4(g)+4H2O(g) △H1
II.CO2(g)+H2(g) CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0
回答下列问题:
(1)在密闭容器中通入1mol CO2和3mol H2,在铁系催化剂作用下进行反应,某一压强下,CO2的平衡转化率随温度的变化如图1所示。
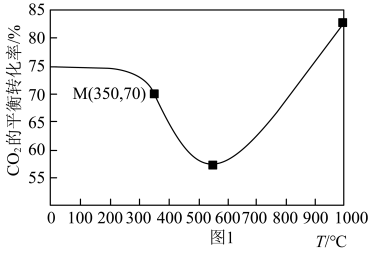
①下列说法正确的是______ (填选项字母)。
A.由图1可知:在该压强下,200-550℃之间以反应I为主,550℃后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以增大压强反应II的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将CO2和H2的初始物质的量之比变为2:3,可提高CO2平衡转化率
②图1中点M(350,70),此时乙烯的选择性为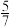 [选择性=
[选择性=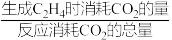 ]。
]。
计算该温度时反应II的平衡常数K=_______ (结果用分数表示)。
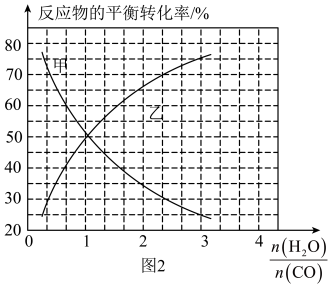
(2)恒温恒容密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[
CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[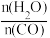 ]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向
]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向________ (填“正向”或“逆向”)进行。
(3)工业上乙醇脱水可制得二乙醚:2C2H5OH(g) C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。
C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。
①C2H5OC2H5的体积分数为________ 。
②平衡常数K=________ (用k正、k逆表示)。
③当温度变为T2时,k正=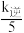 ,则T1
,则T1________ T2(填“大于”“小于”或“等于”)。
I.2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H1
C2H4(g)+4H2O(g) △H1II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0
CO(g)+H2O(g) △H2>0回答下列问题:
(1)在密闭容器中通入1mol CO2和3mol H2,在铁系催化剂作用下进行反应,某一压强下,CO2的平衡转化率随温度的变化如图1所示。

①下列说法正确的是
A.由图1可知:在该压强下,200-550℃之间以反应I为主,550℃后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以增大压强反应II的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将CO2和H2的初始物质的量之比变为2:3,可提高CO2平衡转化率
②图1中点M(350,70),此时乙烯的选择性为
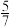 [选择性=
[选择性=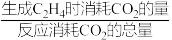 ]。
]。计算该温度时反应II的平衡常数K=
(2)恒温恒容密闭容器中发生反应CO(g)+H2O(g)
 CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[
CO2(g)+H2(g),反应物的平衡转化率分别随着水、一氧化碳的物质的量之比[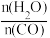 ]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向
]的变化曲线如图2所示。若在此温度下,向容积为2.0L的恒容密闭容器中通入2.0mol CO(g)、1.6mol H2O(g)、3.2mol CO2(g)、1.2mol H2(g),发生上述反应,则反应向
(3)工业上乙醇脱水可制得二乙醚:2C2H5OH(g)
 C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。
C2H5OC2H5(g)+H2O(g) △H>0。实验测得:v正=k正c2(C2H5OH),v逆=k逆c(C2H5OC2H5)·c(H2O),k正、k逆为速率常数。T1温度下,向2L恒容密闭容器中加入0.2mol C2H5OH,10min时达到平衡,H2O的体积分数为25%。①C2H5OC2H5的体积分数为
②平衡常数K=
③当温度变为T2时,k正=
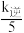 ,则T1
,则T1
更新时间:2023-10-02 14:33:03
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】氮及化合物用途广泛,可制化肥、燃料、医药等化学工业。
(1)氨气易溶于水可电离出 和OH-、易液化,液氨也与水一样发生双聚电离,但比水弱,能溶解一些金属等性质。下列说法不正确的是
和OH-、易液化,液氨也与水一样发生双聚电离,但比水弱,能溶解一些金属等性质。下列说法不正确的是__________ 。
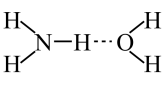
A.NH3可看作比水弱的电解质
B.NH3的双聚电离为2NH3
 +
+
C.NH3易溶于水是由于与水形成氢键,如图所示
D.NH3可与Na反应2NH3+2Na=2NaNH2+H2↑
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g)
4NO2(g)+O2(g)  >0
>0
①该反应自发进行的条件是___________ 。
②下表为反应在T1温度下的部分实验数据:
若在T2温度下进行实验,1000s时测得反应体系中NO2浓度为4.98mol·L-1,则T2__________ T1(填“>”、“<”或“=”)。
(3)N2H4是二元弱碱,其水溶液呈碱性的原因是(用电离方程式表示)__________ 。N2H4的制法可用过量NH3与CH3CHO的混合物与氯气进行气相反应合成出异肼(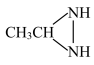 ),异肼水解得到肼,写出第一步的化学反应方程式
),异肼水解得到肼,写出第一步的化学反应方程式__________ 。
(4)有一种化合物NH4H,据推断NH4H不能稳定存在,原因是__________ 。
(1)氨气易溶于水可电离出
 和OH-、易液化,液氨也与水一样发生双聚电离,但比水弱,能溶解一些金属等性质。下列说法不正确的是
和OH-、易液化,液氨也与水一样发生双聚电离,但比水弱,能溶解一些金属等性质。下列说法不正确的是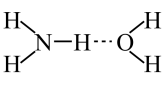
A.NH3可看作比水弱的电解质
B.NH3的双聚电离为2NH3

 +
+
C.NH3易溶于水是由于与水形成氢键,如图所示
D.NH3可与Na反应2NH3+2Na=2NaNH2+H2↑
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g)
4NO2(g)+O2(g)  >0
>0①该反应自发进行的条件是
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
(3)N2H4是二元弱碱,其水溶液呈碱性的原因是(用电离方程式表示)
 ),异肼水解得到肼,写出第一步的化学反应方程式
),异肼水解得到肼,写出第一步的化学反应方程式(4)有一种化合物NH4H,据推断NH4H不能稳定存在,原因是
您最近一年使用:0次
【推荐2】(1)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则该燃料电池的负极的电极反应为___________ 。
(2)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
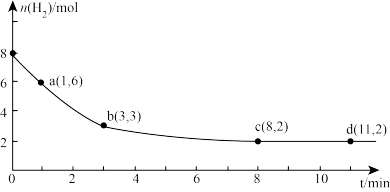
①a点正反应速率______ (填“大于等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是________ mol/L。
③能够说明该反应达到化学平衡状态的标志是__________ (双选)。
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
(2)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率
②平衡时CO2的物质的量浓度是
③能够说明该反应达到化学平衡状态的标志是
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
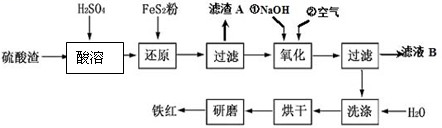
回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是_________________________________________ 。
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:_________ FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.
(3)滤渣A的主要成分为_________ 。
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是___________ ;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是____________________ 。
(5)当离子浓度≤1×10-5mol/L时可认为其沉淀完全。若要使Mg2+完全沉淀则要保持c(OH-)≥_____________ 。(已知Ksp[Mg(OH)2]=5.6×10-12,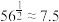 )
)

回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:
(3)滤渣A的主要成分为
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是
(5)当离子浓度≤1×10-5mol/L时可认为其沉淀完全。若要使Mg2+完全沉淀则要保持c(OH-)≥
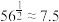 )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某小组利用氯气与NaOH制取NaClO并探究其性质。
资料:①Ag2SO4是白色固体,微溶于水。
②在Fe3+的水溶液中存在平衡:[Fe(H2O)4(OH)2]+(黄色)+2H+ [Fe(H2O)6]3+(淡紫色或无色)
[Fe(H2O)6]3+(淡紫色或无色)
I.制备
(1)A中反应的离子方程式是____ 。一段时间后,测得A中溶液pH=10。
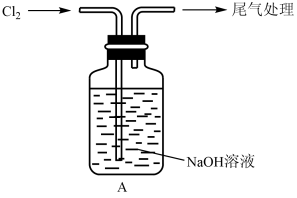
II.探究性质
取I所得A中溶液5mL于试管中,向其中加入稍过量的0.1mol/LFeSO4溶液和适量H2SO4溶液,观察到无沉淀产生,溶液变为黄色。
(2)甲同学对溶液变黄色可能发生的反应提出下列三种猜想:.
猜想1:2Fe2++ClO-+2H+=2Fe3++C1-+H2O
猜想2:2Fe2++2ClO-+4H+=2Fe3++Cl2↑+2H2O
猜想3:Cl-+ClO-+2H+=Cl2↑+H2O
乙同学认为猜想2和3不合理,用离子方程式表示原因____ 。
经证实,猜想1正确。
III.进一步探究
取II中黄色溶液,分为4份,进行下列操作。
(3)实验i的现象是____ 。
(4)实验ii加入AgNO3出现白色沉淀,不能说明溶液中存在Cl-,原因是____ 。
(5)资料表明,氧化性:ClO->Br2>Fe3+>I2。甲同学认为由实验iii的现象证明溶液中仍存在ClO-。乙同学认为甲同学的推断不严谨,设计了能确证溶液中是否存在ClO-的实验方案:____ 。
(6)实验iv中黄色溶液变浅至几乎无色,用化学平衡移动原理解释原因____ 。
资料:①Ag2SO4是白色固体,微溶于水。
②在Fe3+的水溶液中存在平衡:[Fe(H2O)4(OH)2]+(黄色)+2H+
 [Fe(H2O)6]3+(淡紫色或无色)
[Fe(H2O)6]3+(淡紫色或无色)I.制备
(1)A中反应的离子方程式是

II.探究性质
取I所得A中溶液5mL于试管中,向其中加入稍过量的0.1mol/LFeSO4溶液和适量H2SO4溶液,观察到无沉淀产生,溶液变为黄色。
(2)甲同学对溶液变黄色可能发生的反应提出下列三种猜想:.
猜想1:2Fe2++ClO-+2H+=2Fe3++C1-+H2O
猜想2:2Fe2++2ClO-+4H+=2Fe3++Cl2↑+2H2O
猜想3:Cl-+ClO-+2H+=Cl2↑+H2O
乙同学认为猜想2和3不合理,用离子方程式表示原因
经证实,猜想1正确。
III.进一步探究
取II中黄色溶液,分为4份,进行下列操作。
| 序号 | 操作 | 现象 |
| i | 加入NaOH溶液 | |
| ii | 加入AgNO3溶液 | 白色沉淀 |
| iii | 加入NaI溶液,再加入一定量CCl4,振荡 | 下层呈紫红色 |
| iv | 加入一定量H2SO4溶液 | 黄色变浅几乎无色 |
(4)实验ii加入AgNO3出现白色沉淀,不能说明溶液中存在Cl-,原因是
(5)资料表明,氧化性:ClO->Br2>Fe3+>I2。甲同学认为由实验iii的现象证明溶液中仍存在ClO-。乙同学认为甲同学的推断不严谨,设计了能确证溶液中是否存在ClO-的实验方案:
(6)实验iv中黄色溶液变浅至几乎无色,用化学平衡移动原理解释原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ: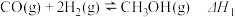
反应Ⅱ: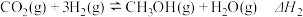
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
(1)在一定条件下将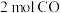 和
和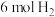 充入
充入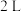 的密闭容器中发生反应Ⅰ,
的密闭容器中发生反应Ⅰ, 后测得
后测得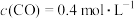 ,计算可得此段时间的反应速率(用
,计算可得此段时间的反应速率(用 表示)为
表示)为_______________________ 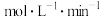 。
。
(2)由表中数据判断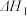
______________ (填“>”“<”或“=”)0;
反应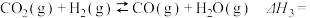
_____________ (用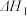 和
和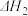 表示)。
表示)。
(3)若容器容积不变,则下列措施可抛高反应Ⅰ中CO转化率的是______________ (填序号)。
a.充入 ,使体系总压强增大 b.将
,使体系总压强增大 b.将 从体系中分离
从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡__________ (填“正向”“逆向”或“不”)移动,平衡常数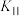
____________ (填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是______________ (填“Ⅰ”或“Ⅱ”)。
反应Ⅰ:
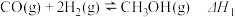
反应Ⅱ:
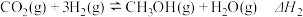
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度/ | 250 | 300 | 350 |
|
|
|
|
(1)在一定条件下将
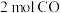 和
和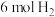 充入
充入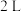 的密闭容器中发生反应Ⅰ,
的密闭容器中发生反应Ⅰ, 后测得
后测得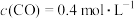 ,计算可得此段时间的反应速率(用
,计算可得此段时间的反应速率(用 表示)为
表示)为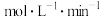 。
。(2)由表中数据判断
反应
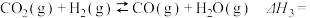
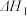 和
和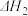 表示)。
表示)。(3)若容器容积不变,则下列措施可抛高反应Ⅰ中CO转化率的是
a.充入
 ,使体系总压强增大 b.将
,使体系总压强增大 b.将 从体系中分离
从体系中分离c.充入He,使体系总压强增大 d.使用高效催化剂
(4)保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡
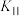
(5)比较这两种合成甲醇的方法,原子利用率较高的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷)=CH4(g)+C3H6(g) ΔH1
反应2:C4H10(g,正丁烷)=C2H6(g)+C2H4(g) ΔH2
已知几种共价键的键能如下表:
(1)根据上述数据估算,ΔH1=_______ kJ·mol-1。
(2)正丁烷和异丁烷之间转化的能量变化如图1所示。
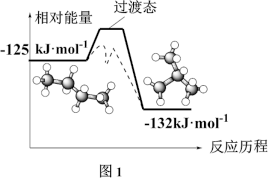
①正丁烷气体转化成异丁烷气体的热化学方程式为_______ 。
②下列有关催化剂的叙述错误的是_______ (填标号)。
A.能改变反应途径 B.能加快反应速率
C.能降低反应焓变 D.能增大平衡常数
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图2所示。
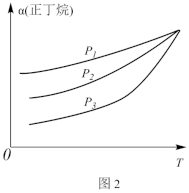
①p1、p2、p3由小到大的顺序为_______ 。
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是_______ 。
(4)在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如图3,平衡时压强为17a kPa。
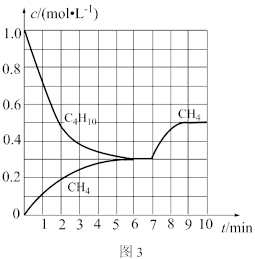
①7 min时改变的条件可能是_______ (填标号)。
A.增大压强 B.增大正丁烷的浓度 C.加入催化剂
②该温度下,反应1的平衡常数Kp=_____ kPa。(提示:组分分压=总压×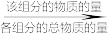 )
)
反应1:C4H10(g,正丁烷)=CH4(g)+C3H6(g) ΔH1
反应2:C4H10(g,正丁烷)=C2H6(g)+C2H4(g) ΔH2
已知几种共价键的键能如下表:
| 共价键 | C-H | C=C | C-C |
| 键能(kJ∙mol-1) | 413 | 624 | 349 |
(2)正丁烷和异丁烷之间转化的能量变化如图1所示。

①正丁烷气体转化成异丁烷气体的热化学方程式为
②下列有关催化剂的叙述错误的是
A.能改变反应途径 B.能加快反应速率
C.能降低反应焓变 D.能增大平衡常数
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图2所示。

①p1、p2、p3由小到大的顺序为
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是
(4)在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如图3,平衡时压强为17a kPa。

①7 min时改变的条件可能是
A.增大压强 B.增大正丁烷的浓度 C.加入催化剂
②该温度下,反应1的平衡常数Kp=
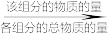 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是_______ ,ΔH3=_______ kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)⇌2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(ψ)如图所示。
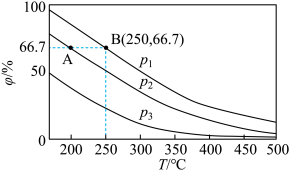
①其中,p1,p2和p3由大到小的顺序是_______ ,其原因是_______ 。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)_______ vB(N2)(填“ ”“
”“ ”或“
”或“ ”
” 。
。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_______ Pa(分压=总压×物质的量分数,保留一位小数)。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)⇌2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(ψ)如图所示。

①其中,p1,p2和p3由大到小的顺序是
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)
 ”“
”“ ”或“
”或“ ”
” 。
。③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:


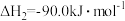
写出 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式_____ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是______ (填序号)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比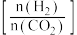 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
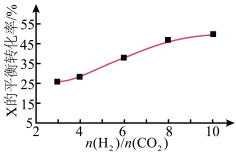
反应物X是___ (填“ ”或“
”或“ ”)。
”)。
(4)250℃时,在体积为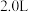 的恒容密闭容器中加入
的恒容密闭容器中加入 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。
①前10min内 的平均反应速率
的平均反应速率
____  。
。
②化学平衡常数
________ 。
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为___ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:



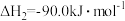
写出
 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由
 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比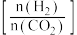 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
反应物X是
 ”或“
”或“ ”)。
”)。(4)250℃时,在体积为
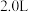 的恒容密闭容器中加入
的恒容密闭容器中加入 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。①前10min内
 的平均反应速率
的平均反应速率
 。
。②化学平衡常数

③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
实验编号 | 温度/K | 催化剂 |
| 甲醇的选择性/% |
A | 543 |
|
|
|
B | 543 |
|
|
|
C | 553 |
|
|
|
D | 553 |
|
|
|
根据上表所给数据,用
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
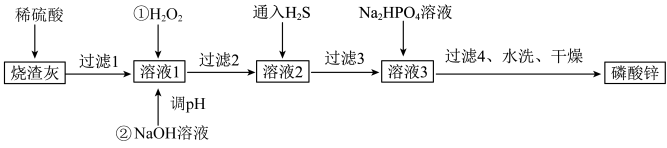
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)烧渣灰加入稀硫酸时,请写出ZnO与稀硫酸反应的离子方程式___________
(2)加入H2O2的作用___________
(3)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(4)加入Na2HPO4溶液发生反应的离子方程式为___________ 。
(5)洗涤磷酸锌沉淀时应选用___________ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是___________ 。
(6)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1 mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=___________ (已知:25°C时,H2S的电离平衡常数Ka1=1×10-7 mol∙L-1,Ka2=1×10-15 mol∙L-1)。

已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)烧渣灰加入稀硫酸时,请写出ZnO与稀硫酸反应的离子方程式
(2)加入H2O2的作用
(3)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(4)加入Na2HPO4溶液发生反应的离子方程式为
(5)洗涤磷酸锌沉淀时应选用
(6)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1 mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=
您最近一年使用:0次
【推荐1】“氯碱工业”以电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。请回答:
(1)电解饱和食盐水制取氯气的化学方程式是___ 。
(2)下列说法不正确 的是___ 。
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g) Cl2(aq) K1=
Cl2(aq) K1=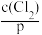
Cl2(aq)+H2O(l) H+(aq)+Cl-(aq)+HClO(aq) K2
H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g) Cl2(aq)的熵变△S1
Cl2(aq)的熵变△S1___ 0(填“>”、“=”或“<”,右同),焓变△H1___ 0。
②平衡常数K2的表达式为K2=___ 。
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为:
Ⅰ.TiO2(s)+2Cl2(g) TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29
TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29
Ⅱ.2C(s)+O2(g) 2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048
2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048
Ⅲ.TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g) △H3=
TiCl4(g)+2CO(g) △H3=___ ,K3=___ 。结合数据说明 氯化过程中加碳的理由___ 。
(1)电解饱和食盐水制取氯气的化学方程式是
(2)下列说法
| A.可采用碱石灰干燥氯气 |
| B.可通过排饱和食盐水法收集氯气,遵循平衡移动原理 |
| C.常温下,可通过加压使氯气液化而储存于钢瓶中 |
| D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸 |
Cl2(g)
 Cl2(aq) K1=
Cl2(aq) K1=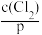
Cl2(aq)+H2O(l)
 H+(aq)+Cl-(aq)+HClO(aq) K2
H+(aq)+Cl-(aq)+HClO(aq) K2其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)
 Cl2(aq)的熵变△S1
Cl2(aq)的熵变△S1②平衡常数K2的表达式为K2=
(4)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为:
Ⅰ.TiO2(s)+2Cl2(g)
 TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29
TiCl4(g)+O2(g) △H1=181 kJ•mol-1,K1=3.4×10-29Ⅱ.2C(s)+O2(g)
 2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048
2CO(g) △H2=-221 kJ•mol-1,K2=1.2×1048Ⅲ.TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(g)+2CO(g) △H3=
TiCl4(g)+2CO(g) △H3=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】含硫化合物在生产、生活中有较广泛的应用。请按要求回答下列问题。
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。它的制备工艺流程如下图所示,请按要求回答下列问题。
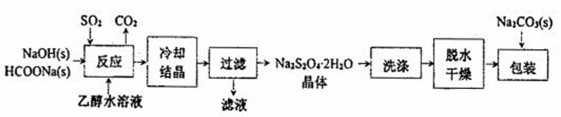
(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:__________ 。
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是__________ 。
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如右图所示:(忽略溶液体积的变化)。
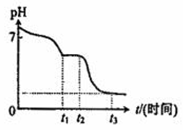
① t1~t2段溶液中S元素的化合价为____________ 。
② t3时刻后溶液的pH为__________ 。
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g) 2SO3(g),推测此反应的△S(填“>”或“<”)
2SO3(g),推测此反应的△S(填“>”或“<”) ______ 0,△H(填“>”或“<”)______ 0。
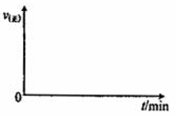
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)] 随时间(t)的变化曲线图:
______
(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
则三容器中反应分别平衡时K的大小关系是_____________ ;
SO2的平衡转化率的大小关系是____________________ 。
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。它的制备工艺流程如下图所示,请按要求回答下列问题。

(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如右图所示:(忽略溶液体积的变化)。

① t1~t2段溶液中S元素的化合价为
② t3时刻后溶液的pH为
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)
 2SO3(g),推测此反应的△S(填“>”或“<”)
2SO3(g),推测此反应的△S(填“>”或“<”) (l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)] 随时间(t)的变化曲线图:

(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
则三容器中反应分别平衡时K的大小关系是
SO2的平衡转化率的大小关系是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)常温常压下,H2S在空气中可以缓慢氧化为S:2H2S + O2 = 2H2O + 2S。
该反应的△H__________ 0,△S___________ 0。(填“>”,“<”,“=”)
(2)土壤中的微生物可将大气中 H2S经两步反应氧化成SO ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
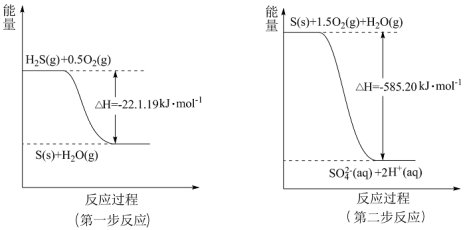
则H2S气体被氧气氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为_________________ 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含 SO2快速启动,其装置示意图如下:
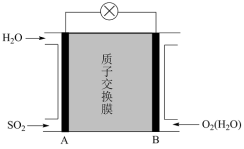
①质子的流动方向为________________ (“从A到B”或“从B到A ”)
②负极的电极反应式为________________ 。
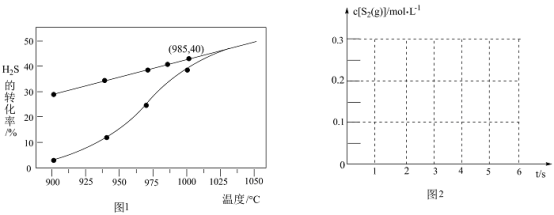
(4)在容积2 L的恒容密闭容器中,控制不同温度进行H2S分解:2H2S(g)⇌2H2(g) +S2(g)。H2S的起始物质的量均为1 mol,实验过程中测得H2S的转化率如图1所示。曲线a表示 H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同 时间H2S的转化率。
①随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是_______
②在985 ℃时,该反应经过5 s达到平衡,则该反应的平衡常数为_________
③在图2中画出985 ℃时,0〜6 s体系中S2(g)浓度随时间的变化曲线_________ 。
(1)常温常压下,H2S在空气中可以缓慢氧化为S:2H2S + O2 = 2H2O + 2S。
该反应的△H
(2)土壤中的微生物可将大气中 H2S经两步反应氧化成SO
 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
则H2S气体被氧气氧化成SO
 (aq)的热化学方程式为
(aq)的热化学方程式为(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含 SO2快速启动,其装置示意图如下:

①质子的流动方向为
②负极的电极反应式为
(4)在容积2 L的恒容密闭容器中,控制不同温度进行H2S分解:2H2S(g)⇌2H2(g) +S2(g)。H2S的起始物质的量均为1 mol,实验过程中测得H2S的转化率如图1所示。曲线a表示 H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同 时间H2S的转化率。
①随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是
②在985 ℃时,该反应经过5 s达到平衡,则该反应的平衡常数为
③在图2中画出985 ℃时,0〜6 s体系中S2(g)浓度随时间的变化曲线

您最近一年使用:0次


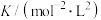

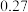

 纳米棒
纳米棒