已知25℃时有关弱酸的电离平衡常数如表。下列说法正确的是
| 弱酸 | CH3COOH | HCN | H2SO3 | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 4.9×10-10 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.3×10-7 K2=5.6×10-11 |
| A.amol/LHCN溶液与bmol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| B.等体积等浓度的CH3COONa和NaCN溶液中的阳离子离子数大小:前者<后者 |
C.HCO 溶液中通入少量SO2:2HCO 溶液中通入少量SO2:2HCO +SO2=2CO2+SO +SO2=2CO2+SO +H2O +H2O |
| D.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)>pH(NaHSO3) |
21-22高二下·河南三门峡·期末 查看更多[3]
四川省成都市树德中学2022-2023学年高二上学期期中考试化学试题(已下线)第13练 以pH的计算突破弱电解质的电离、溶液酸碱性-2022年【暑假分层作业】高二化学(2023届一轮复习通用)河南省三门峡市2021-2022学年度高二下学期期末质量检测化学试题
更新时间:2022-06-15 23:47:00
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下表是在相同温度下三种酸的一些数据, 下列判断正确的是
酸 | HX | HY | HZ | ||
浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
电离常数 | Ka1 | Ka2 | Ka3 | Ka4 | Ka5 |
| A.同温时,从HX的数据可以说明:弱电解质溶液,浓度降低,电离度越大,且Ka1>Ka2>Ka3=0.01 |
B.室温时,NaZ 溶液中加水,则 变小,若加盐酸,则 变小,若加盐酸,则 变大 变大 |
| C.等物质的量浓度的NaX、NaY 和NaZ的三种溶液,其pH为:NaX<NaY<NaZ |
| D.在相同温度下,Ka5>Ka4>Ka3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】室温下,下列事实不能说明NH3·H2O为弱电解质的是
| A.相同浓度的NH3·H2O和NaOH溶液,pH 前者小于后者 |
| B.相同条件下,浓度均为0.1 mol/LNaOH溶液和氨水,氨水的导电能力弱 |
| C.0.1 mol/LNH3·H2O能使无色酚酞试液变红色 |
D.OH-浓度相同的NH3·H2O和NaOH溶液分别加水稀释,c(OH-)随溶液体积变化的曲线如图所示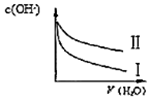 ,其中曲线Ⅱ是NH3·H2O ,其中曲线Ⅱ是NH3·H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,用
 溶液滴定
溶液滴定

 溶液,溶液
溶液,溶液 与滴入
与滴入 溶液的体积间的关系如图所示。下列说法错误的是
溶液的体积间的关系如图所示。下列说法错误的是


 溶液滴定
溶液滴定

 溶液,溶液
溶液,溶液 与滴入
与滴入 溶液的体积间的关系如图所示。下列说法错误的是
溶液的体积间的关系如图所示。下列说法错误的是
A.当 时, 时, |
B.当 时, 时, |
C.当 时, 时, |
D.当 时, 时, |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温时,用0.10mol/L NaOH溶液滴定25.00mL 0.10mol/L一元酸HX的溶液,滴定过程中pH变化曲线如图所示。若忽略反应过程中国液体密度变化而导致的体积变化,则下列判断正确的是


A.常温下,HX溶液的电离常数 | B.A点溶液中: |
C.B点溶液中: | D.C点溶液中: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】草酸(H2C2O4)是一种二元弱酸。实验室配制了0.0100mol·L-lNa2C2O4标准溶液,现对25℃时该溶液的性质进行探究,下列所得结论正确的是
A.已知25℃时Ksp(CaC2O4)=2.5×10-9,向该溶液中加入等体积0.0200mol·L-lCaCl2溶液,所得上层清液中c( )<5×10—5mol·L-l )<5×10—5mol·L-l |
B.向该溶液中滴加稀盐酸至溶液pH=7,此时溶液中存在c(Na+)=c( )+2c( )+2c( ) ) |
C.测得0.0100mol·L-1Na2C2O4溶液pH为8.6,此时溶液中存在:C(Na)+>c( )>c( )>c( )>c(H+) )>c(H+) |
D.向该溶液中加入足量稀硫酸酸化后,再滴加KMnO4溶液,发生反应的离子方程式为 +4 +4 +14H+=2CO2↑+4Mn2++7H2O +14H+=2CO2↑+4Mn2++7H2O |
您最近一年使用:0次




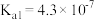
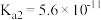


 的能力:
的能力:




