氢氧化铍可用作核技术和制备含铍材料的中间体等。以硅铍石(主要成分Be2SiO4含少量Al2O3)和方解石(主要成分CaCO3,含少量FeCO3、SiO2)为原料,制备Be(OH)2的工艺流程如图所示:

已知:I.硅铍石不易被硫酸直接分解;铍的性质与铝相似;粗Be(OH)2含有少量Al(OH)3;
II.生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)“熔炼”时加入方解石粉的作用为_______ ;生成气体的电子式为_______ 。
(2)浸渣中除含有CaSiO3、H2SiO3外,还含有_______ (填化学式)。
(3)滤渣1中含有NH4Al(SO4)2·12H2O、(NH4)2 Fe(SO4)2·6H2O。NH4Al(SO4)2 ·12H2O能用作净水剂,原因为_______ (用离子方程式表示);(NH4)2 Fe(SO4)2·6H2O可用于测定KMnO4的含量,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)根据已知II信息可知,“深度除铁”的适宜方案为_______ 。
(5)“调pH”所得母液中的主要溶质可返回到_______ 工序循环利用。
(6)“洗涤”的目的是除去粗Be(OH)2中所含的Al(OH)3,若用足量NaOH浓溶液代替NaOH稀溶液,会导致的后果为_______ (用离子方程式表示)。

已知:I.硅铍石不易被硫酸直接分解;铍的性质与铝相似;粗Be(OH)2含有少量Al(OH)3;
II.生成氢氧化物沉淀的pH如下表所示:
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Be(OH)2 |
| 开始沉淀的pH | 7.7 | 2.5 | 3.5 | 4.6 |
| 沉淀完全的pH (溶液中金属离子浓度等于10-5 mol·L-1) | 8.7 | 3.2 | 4.7 | 5.9 |
回答下列问题:
(1)“熔炼”时加入方解石粉的作用为
(2)浸渣中除含有CaSiO3、H2SiO3外,还含有
(3)滤渣1中含有NH4Al(SO4)2·12H2O、(NH4)2 Fe(SO4)2·6H2O。NH4Al(SO4)2 ·12H2O能用作净水剂,原因为
(4)根据已知II信息可知,“深度除铁”的适宜方案为
(5)“调pH”所得母液中的主要溶质可返回到
(6)“洗涤”的目的是除去粗Be(OH)2中所含的Al(OH)3,若用足量NaOH浓溶液代替NaOH稀溶液,会导致的后果为
更新时间:2022-08-16 15:12:35
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】ClO2是一种强氧化性气体,在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过下图所示装置(夹持和加热仪器已略)制备ClO2、并用Na2CO3和H2O2混合溶液吸收ClO2制取NaClO2,同时生成NaHCO3。

(1)装置A中的反应需维持在70℃进行,可采取的措施是____ 。反应停止后通入N2的作用是____ 。
(2)写出装置B中发生反应的离子方程式:____ 。
(3)反应结束后,取装置B中溶液25.00 mL,先除去溶液中剩余的H2O2,接着向其中加入适量稀硫酸和过量KI溶液,充分反应后,再滴入数滴淀粉溶液,消耗20.00 mL 0.1000 mol·L-1 Na2S2O3标准溶液恰好反应至溶液蓝色完全褪去。已知:
I-+ClO +H+——I2+Cl-+H2O(未配平) I2+2Na2S2O3=2NaI+Na2S4O6
+H+——I2+Cl-+H2O(未配平) I2+2Na2S2O3=2NaI+Na2S4O6
①如果不先除去溶液中剩余的H2O2,会导致实验结果____ (填“偏大”、 “偏小”或“无影响”),原因是____ 。
②通过计算确定装置B吸收液中NaClO2物质的量浓度____ (写出计算过程)。

(1)装置A中的反应需维持在70℃进行,可采取的措施是
(2)写出装置B中发生反应的离子方程式:
(3)反应结束后,取装置B中溶液25.00 mL,先除去溶液中剩余的H2O2,接着向其中加入适量稀硫酸和过量KI溶液,充分反应后,再滴入数滴淀粉溶液,消耗20.00 mL 0.1000 mol·L-1 Na2S2O3标准溶液恰好反应至溶液蓝色完全褪去。已知:
I-+ClO
 +H+——I2+Cl-+H2O(未配平) I2+2Na2S2O3=2NaI+Na2S4O6
+H+——I2+Cl-+H2O(未配平) I2+2Na2S2O3=2NaI+Na2S4O6①如果不先除去溶液中剩余的H2O2,会导致实验结果
②通过计算确定装置B吸收液中NaClO2物质的量浓度
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】亚氯酸钠(NaClO2)是一种杀菌漂白剂,可用于棉纺漂白,食品消毒,水处理等,消毒时本身被还原成Cl-。亚氯酸钠晶体的一种生产工艺如图:

已知:①ClO2浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
②NaClO2在温度高于60℃易分解生成NaClO3和NaCl。
(1)在“ClO2发生器”中,NaClO3与SO2反应生成ClO2和Na2SO4,该反应的化学方程式为___________ 。要证明产物中有 生成,检验的方法是:取少量产物溶于水形成溶液,
生成,检验的方法是:取少量产物溶于水形成溶液,___________ 。
(2)向“ClO2发生器”中鼓入空气的作用是(填字母)___________ 。
a.将SO2氧化成SO3,增强酸性
b.将NaClO2氧化成ClO2
c.稀释ClO2,以防分解爆炸
(3)“吸收塔”的作用是将产生的C1O2反应转化为NaClO2,在此过程中,若参加反应的H2O2为1mol,则电子转移的物质的量为___________ 。“吸收塔”中需要控制温度不超过20℃,其原因___________ 。
(4)NaClO2的溶解度曲线如图所示。从NaClO2溶液中获得NaClO2晶体的操作是:将NaClO2溶液___________ 、___________ ,过滤,洗涤,干燥。


已知:①ClO2浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
②NaClO2在温度高于60℃易分解生成NaClO3和NaCl。
(1)在“ClO2发生器”中,NaClO3与SO2反应生成ClO2和Na2SO4,该反应的化学方程式为
 生成,检验的方法是:取少量产物溶于水形成溶液,
生成,检验的方法是:取少量产物溶于水形成溶液,(2)向“ClO2发生器”中鼓入空气的作用是(填字母)
a.将SO2氧化成SO3,增强酸性
b.将NaClO2氧化成ClO2
c.稀释ClO2,以防分解爆炸
(3)“吸收塔”的作用是将产生的C1O2反应转化为NaClO2,在此过程中,若参加反应的H2O2为1mol,则电子转移的物质的量为
(4)NaClO2的溶解度曲线如图所示。从NaClO2溶液中获得NaClO2晶体的操作是:将NaClO2溶液

您最近半年使用:0次
【推荐3】某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Fe2+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
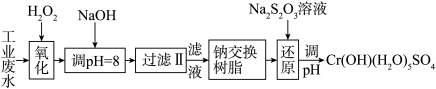
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
(1)氧化过程中可代替H2O2加入的试剂是________ (填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________ ;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________ 。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O72-转移4.8 mol e-,该反应离子方程式为____________ 。

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O72-转移4.8 mol e-,该反应离子方程式为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
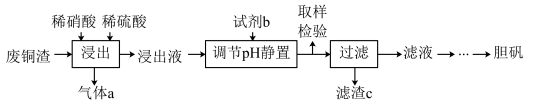
已知生成氢氧化物沉淀的pH如下表所示:
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:________________ 。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是__________________________ 。
(3)试剂b是____________ ,滤渣c是______________ (均写化学式)。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、__________________ 。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:________________ 。
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:______________ 。


已知生成氢氧化物沉淀的pH如下表所示:
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀 | 4.2 | 6.5 | 1.5 |
| 完全沉淀 | 6.7 | 9.7 | 3.7 |
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是
(3)试剂b是
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2===2NO2、
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:
(6)某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:

您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】利用某废矿渣(主要成分为 ,还含有
,还含有 、
、 、
、 等杂质)提取高附加值的铁红(
等杂质)提取高附加值的铁红( )的一种工艺流程如图所示。
)的一种工艺流程如图所示。

回答下列问题:
(1)“酸浸”前一般需将废矿渣粉碎,其目的是
(2)“还原”过程中发生反应的离子方程式为
(3)“净化”时若加入过量氨水,则会使
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为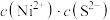 为一定值,数值约为
为一定值,数值约为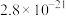 (室温),当溶液中
(室温),当溶液中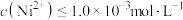 时可认为
时可认为 沉淀完全,试计算此时溶液中的
沉淀完全,试计算此时溶液中的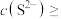
(4)“沉铁”所得“滤渣3”的成分为
 ,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为
,同时得到二氧化碳气体,则“沉铁”时发生反应的离子方程式为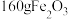 ,理论上消耗氧气(标准状况)的体积为
,理论上消耗氧气(标准状况)的体积为(5)铁红样品的纯度测定:
称取 铁红样品,将样品溶于一定量的硫酸中,得到
铁红样品,将样品溶于一定量的硫酸中,得到 溶液,从中量取
溶液,从中量取 溶液进行如下实验:先加稍过量的
溶液进行如下实验:先加稍过量的 溶液,充分反应后,再向溶液中滴加
溶液,充分反应后,再向溶液中滴加 的
的 溶液,使
溶液,使 恰好转化为
恰好转化为 。三次平行实验所消耗
。三次平行实验所消耗 溶液的体积的平均值为
溶液的体积的平均值为 ,假设杂质始终未参加反应,则铁红样品的纯度为
,假设杂质始终未参加反应,则铁红样品的纯度为 、
、 、
、 的表达式填写)。
的表达式填写)。
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
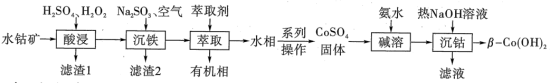
【推荐3】利用水钴矿(主要成分为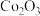 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂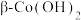 的流程如下。
的流程如下。
已知:i.沉淀过快无法形成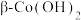 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。
ii.25℃时,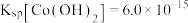 ,
, 的
的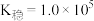 。
。
(1)“酸浸”中 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“沉铁”中 被
被 与空气混合产生的
与空气混合产生的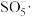 自由基氧化,
自由基氧化,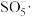 被还原为
被还原为___________ 。
(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是___________ 。(填标号)
A. B.
B.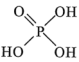 C.
C.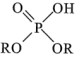
(4) 过程中:
过程中:
①“沉钴”中, 的离子方程式为
的离子方程式为___________ ,该反应的
___________ 。
②制备 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是___________ 。
③“沉钴”中使用热NaOH溶液的目的是___________ 。
(5) 晶胞如图。
晶胞如图。
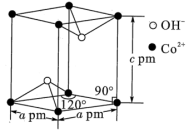
① 处于
处于 形成的
形成的___________ 空隙中。
②晶胞密度为___________  (列出表达式即可)。
(列出表达式即可)。
 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂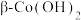 的流程如下。
的流程如下。
已知:i.沉淀过快无法形成
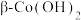 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。ii.25℃时,
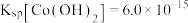 ,
, 的
的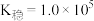 。
。(1)“酸浸”中
 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为(2)“沉铁”中
 被
被 与空气混合产生的
与空气混合产生的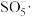 自由基氧化,
自由基氧化,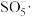 被还原为
被还原为(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是
A.
 B.
B. C.
C.
(4)
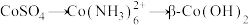 过程中:
过程中:①“沉钴”中,
 的离子方程式为
的离子方程式为
②制备
 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是③“沉钴”中使用热NaOH溶液的目的是
(5)
 晶胞如图。
晶胞如图。
①
 处于
处于 形成的
形成的②晶胞密度为
 (列出表达式即可)。
(列出表达式即可)。
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】向含有NaOH的NaClO溶液中逐滴滴入FeSO4溶液,滴加过程中溶液的pH随FeSO4溶液的体积的变化曲线及实验现象见表。
资料:i.饱和NaClO溶液的pH约为11
ii.Ksp[Fe(OH)3]=2.8×10-39
(1)Cl2和NaOH溶液制取NaClO的离子方程式是____ 。
(2)A点溶液的pH约为13,主要原因是____ 。
(3)结合离子方程式解释A→B溶液的pH显著下降的主要原因:____ 。
(4)NaClO溶液中含氯各微粒的物质的量分数与pH的关系如图。
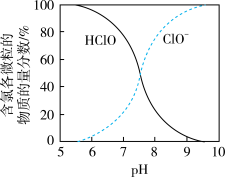
①M点溶液含氯的微粒有____ 。
②C点附近生成红褐色沉淀的主要反应的离子方程式是____ 。
(5)检验iv中气体的方法是____ 。
(6)A→D的过程中,溶液的pH一直下降,原因是____ 。
(7)整个滴加过程中发生的反应与____ 、微粒的浓度等有关。
| 变化曲线 | 实验现象 |
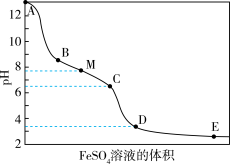 | i.A→B产生红褐色沉淀 ii.B→C红褐色沉淀的量增多 iii.C→D红褐色沉淀的量增多 iv.D点附近产生有刺激性气味的气体 v.D→E红褐色沉淀的量略有增多 |
ii.Ksp[Fe(OH)3]=2.8×10-39
(1)Cl2和NaOH溶液制取NaClO的离子方程式是
(2)A点溶液的pH约为13,主要原因是
(3)结合离子方程式解释A→B溶液的pH显著下降的主要原因:
(4)NaClO溶液中含氯各微粒的物质的量分数与pH的关系如图。

①M点溶液含氯的微粒有
②C点附近生成红褐色沉淀的主要反应的离子方程式是
(5)检验iv中气体的方法是
(6)A→D的过程中,溶液的pH一直下降,原因是
(7)整个滴加过程中发生的反应与
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】处理再利用H2S有多种方法。
(1)碱法脱硫
用K2CO3溶液吸收H2S。
已知:氢硫酸和碳酸的电离常数如表。
①用化学用语表示K2CO3溶液显碱性的原因:____ 。
②用过量的K2CO3溶液吸收H2S的离子方程式是____ 。
(2)热分解法脱硫
在密闭容器中发生反应2H2S(g) S2(?)+2H2(g)。其他条件不变时,H2S的平衡转化率随温度和压强的变化如图。
S2(?)+2H2(g)。其他条件不变时,H2S的平衡转化率随温度和压强的变化如图。
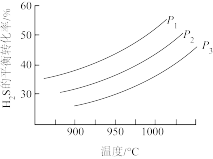
①P3>P2>P1,反应中S2____ (填‘“是”或“不是”)气态,理由是____ 。
②实际反应在高温下进行的原因是____ 。
(3)间接电解法脱硫
间接电解法脱硫过程的示意图如图。
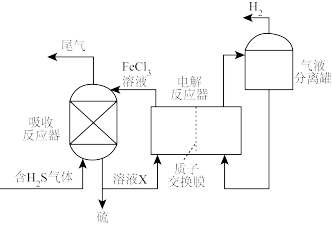
①溶液X的主要溶质是____ 。
②简述在电解反应器中FeCl3溶液再生的原理:____ 。
③不考虑其他副反应,理论上5molH2S反应能生成____ gH2。
(1)碱法脱硫
用K2CO3溶液吸收H2S。
已知:氢硫酸和碳酸的电离常数如表。
| Ka1 | Ka2 | |
| H2S | 1.1×10-7 | 1.3×10-13 |
| H2CO3 | 4.5×10-7 | 4.7×10-11 |
②用过量的K2CO3溶液吸收H2S的离子方程式是
(2)热分解法脱硫
在密闭容器中发生反应2H2S(g)
 S2(?)+2H2(g)。其他条件不变时,H2S的平衡转化率随温度和压强的变化如图。
S2(?)+2H2(g)。其他条件不变时,H2S的平衡转化率随温度和压强的变化如图。
①P3>P2>P1,反应中S2
②实际反应在高温下进行的原因是
(3)间接电解法脱硫
间接电解法脱硫过程的示意图如图。

①溶液X的主要溶质是
②简述在电解反应器中FeCl3溶液再生的原理:
③不考虑其他副反应,理论上5molH2S反应能生成
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】电离常数可以衡量弱电解质电离程度强弱。已知部分弱电解质的电离常数如下表:
请回答下列问题。
(1)25℃时,等浓度的a. 溶液b.
溶液b. 溶液c.NaCN溶液d.
溶液c.NaCN溶液d. 溶液,四种溶液的pH由大到小的顺序为
溶液,四种溶液的pH由大到小的顺序为___________ 。(填溶液前序号)
(2)等浓度、等体积的 溶液与
溶液与 溶液混合,溶液中
溶液混合,溶液中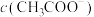
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
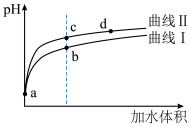
(3)将pH值和体积均相同的 溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
(4)向NaCN溶液中通入少量 反应的化学方程式是
反应的化学方程式是___________ 。
(5)向0.1mol⋅L-1 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,此时溶液
,此时溶液
___________ 。
(6)已知 的
的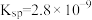 ,现将浓度为
,现将浓度为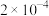 mol⋅L-1
mol⋅L-1 溶液与amol⋅L-1
溶液与amol⋅L-1 溶液等体积混合,生成
溶液等体积混合,生成 沉淀,所需
沉淀,所需 溶液的浓度a最小为
溶液的浓度a最小为___________ mol⋅L-1。
| 化学式 |  |  | HCN |  |
| 电离平衡常数(25℃) |  | 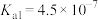  | 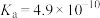 |  |
(1)25℃时,等浓度的a.
 溶液b.
溶液b. 溶液c.NaCN溶液d.
溶液c.NaCN溶液d. 溶液,四种溶液的pH由大到小的顺序为
溶液,四种溶液的pH由大到小的顺序为(2)等浓度、等体积的
 溶液与
溶液与 溶液混合,溶液中
溶液混合,溶液中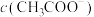
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)将pH值和体积均相同的
 溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
溶液和HCN溶液加水稀释,pH变化如图所示,下列说法正确的是___________。
| A.曲线I代表HCN溶液 | B.酸的浓度: |
C.a点有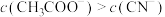 | D.水的电离程度:b点<c点 |
(4)向NaCN溶液中通入少量
 反应的化学方程式是
反应的化学方程式是(5)向0.1mol⋅L-1
 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至 ,此时溶液
,此时溶液
(6)已知
 的
的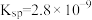 ,现将浓度为
,现将浓度为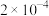 mol⋅L-1
mol⋅L-1 溶液与amol⋅L-1
溶液与amol⋅L-1 溶液等体积混合,生成
溶液等体积混合,生成 沉淀,所需
沉淀,所需 溶液的浓度a最小为
溶液的浓度a最小为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】铟被广泛应用于电子工业、航空航天、太阳能电池新材料等高科技领域。从铜烟灰氧压酸浸渣(主要含 )中提取铟的工艺如图所示。
)中提取铟的工艺如图所示。
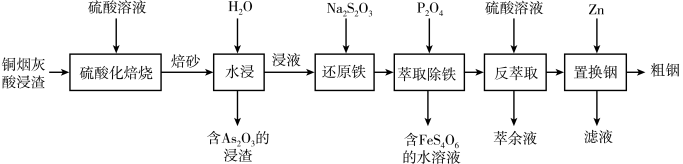
已知:①焙烧后金属元素均以硫酸盐的形式存在;② 微溶于水;③
微溶于水;③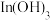 性质与
性质与 类似;④
类似;④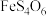 为强电解质。
为强电解质。
回答下列问题:
(1)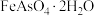 中铁元素化合价为
中铁元素化合价为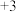 价,
价, 的化合价为
的化合价为_________ .
(2)“硫酸化焙烧”时,其他条件一定,焙烧温度对“水浸”时铟、铁浸出率的影响如图所示。适宜的焙烧温度是_________  。
。
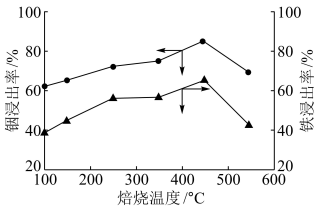
(3)“水浸”工艺中的浸渣除了 外,还含有
外,还含有_________ .
(4)“还原铁”工艺反应的离子方程式为_________ .
(5)“萃取除铁”工艺中,用30%的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是_________ 。
(6)“置换铟”时,发现会有少量的气体 生成,
生成, 的电子式为
的电子式为_________ ,生成 的化学方程式为
的化学方程式为_________ 。
(7)整个工艺流程中,可循环利用的溶液是_________ .
 )中提取铟的工艺如图所示。
)中提取铟的工艺如图所示。
已知:①焙烧后金属元素均以硫酸盐的形式存在;②
 微溶于水;③
微溶于水;③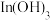 性质与
性质与 类似;④
类似;④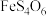 为强电解质。
为强电解质。回答下列问题:
(1)
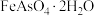 中铁元素化合价为
中铁元素化合价为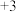 价,
价, 的化合价为
的化合价为(2)“硫酸化焙烧”时,其他条件一定,焙烧温度对“水浸”时铟、铁浸出率的影响如图所示。适宜的焙烧温度是
 。
。
(3)“水浸”工艺中的浸渣除了
 外,还含有
外,还含有(4)“还原铁”工艺反应的离子方程式为
(5)“萃取除铁”工艺中,用30%的
 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是(6)“置换铟”时,发现会有少量的气体
 生成,
生成, 的电子式为
的电子式为 的化学方程式为
的化学方程式为(7)整个工艺流程中,可循环利用的溶液是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】Ni(镍)和Ni2O3在工业和国防上有重要的用途。铜镍矿(主要成分为镍、镁、铜、铁、硅的氧化物)的湿法冶炼是获取镍的重要途径,其工艺流程如下图所示:

(1)“氧压酸浸”滤液中含有Fe3+、Mg2+、Ni2+、Cu2+等离子,通入氧气时加压的目的是______ 。
(2)已知铁矾渣的成分是Na2Fe6(SO4)4(OH)12,MgO在“沉淀除铁”过程中的作用是___________ ,请将其参与生成铁矾渣的离子反应方程式补充完整___________ 。
=Na2Fe6(SO4)4(OH)12+Mg2++10H+
(3)“沉镍”步骤所得滤液中的溶质主要是___________ (填化学式);25℃时,沉镍过程中MgO的加入量对镍沉淀的影响如图所示,当pH为8.0时,溶液中Ni2+的浓度___________ (已知该温度下Ksp[Ni(OH)2]=2.0×10-15);结合图中信息回答,选择MgO加入量为3.0g的理由是___________ 。

(4)工业上可用电解法制取Ni2O3.用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-和Cl-,ClO-再把Ni(OH)2氧化为Ni2O3.电解时阴极的电极反应式为___________ ,2amol二价镍全部转化为三价镍时,外电路中通过的电子的物质的量为___________ mol(假设电解时阳极只考虑Cl-放电)。

(1)“氧压酸浸”滤液中含有Fe3+、Mg2+、Ni2+、Cu2+等离子,通入氧气时加压的目的是
(2)已知铁矾渣的成分是Na2Fe6(SO4)4(OH)12,MgO在“沉淀除铁”过程中的作用是
=Na2Fe6(SO4)4(OH)12+Mg2++10H+
(3)“沉镍”步骤所得滤液中的溶质主要是

(4)工业上可用电解法制取Ni2O3.用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-和Cl-,ClO-再把Ni(OH)2氧化为Ni2O3.电解时阴极的电极反应式为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】铋及其化合物广泛应用于电子材料、医药等领域。一种以氧化铋渣(主要成分是 、
、 、
、 、
、 和
和 等)为原料,制取高纯
等)为原料,制取高纯 的工业流程如图所示:
的工业流程如图所示:
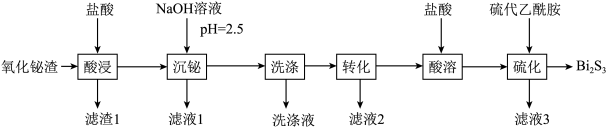
已知:①该工艺条件下,相关金属离子形成氢氧化物沉淀的 范围如下:
范围如下:
② 不溶于稀硫酸
不溶于稀硫酸
③常温下, ,
,
④硫代乙酰胺(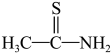 )在酸性溶液中会水解为乙酰胺(
)在酸性溶液中会水解为乙酰胺(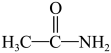 )和
)和 回答下列问题:
回答下列问题:
(1) 与
与 同族,
同族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为_________ 形。
(2)“滤渣1”的主要成分为_________ (填化学式)。
(3)“沉铋”时, 转化为
转化为 沉淀。往“滤液1”中加入铁粉,可回收其中的
沉淀。往“滤液1”中加入铁粉,可回收其中的_________ 金属。
(4)“洗涤”时先用水洗,再用稀硫酸洗涤。用稀硫酸洗涤的目的是__________________ 。
(5)“转化”分两步进行:
第一步,用 溶液将
溶液将 转化为
转化为 。常温下,当该过程达到平衡状态时,测得溶液的
。常温下,当该过程达到平衡状态时,测得溶液的 ,则此时溶液中
,则此时溶液中
_________  ;
;
第二步 受热分解为
受热分解为 。
。
(6)“酸溶”工序通常会加入过量的盐酸,其作用为:①充分溶出 ;②
;②_________ 。
(7)从“滤液3”中分离出乙酰胺以后,可返回“酸溶”或“酸浸”工序中循环使用,则“硫化”过程的化学方程式为_________ 。
 、
、 、
、 、
、 和
和 等)为原料,制取高纯
等)为原料,制取高纯 的工业流程如图所示:
的工业流程如图所示:
已知:①该工艺条件下,相关金属离子形成氢氧化物沉淀的
 范围如下:
范围如下:离子 |
|
|
|
开始沉淀的 | 1.5 | 3.6 | 4.5 |
沉淀完全的 | 3.2 | 4.7 | 6.7 |
 不溶于稀硫酸
不溶于稀硫酸③常温下,
 ,
,
④硫代乙酰胺(
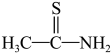 )在酸性溶液中会水解为乙酰胺(
)在酸性溶液中会水解为乙酰胺(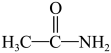 )和
)和 回答下列问题:
回答下列问题:(1)
 与
与 同族,
同族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为(2)“滤渣1”的主要成分为
(3)“沉铋”时,
 转化为
转化为 沉淀。往“滤液1”中加入铁粉,可回收其中的
沉淀。往“滤液1”中加入铁粉,可回收其中的(4)“洗涤”时先用水洗,再用稀硫酸洗涤。用稀硫酸洗涤的目的是
(5)“转化”分两步进行:
第一步,用
 溶液将
溶液将 转化为
转化为 。常温下,当该过程达到平衡状态时,测得溶液的
。常温下,当该过程达到平衡状态时,测得溶液的 ,则此时溶液中
,则此时溶液中
 ;
;第二步
 受热分解为
受热分解为 。
。(6)“酸溶”工序通常会加入过量的盐酸,其作用为:①充分溶出
 ;②
;②(7)从“滤液3”中分离出乙酰胺以后,可返回“酸溶”或“酸浸”工序中循环使用,则“硫化”过程的化学方程式为
您最近半年使用:0次






