氧族元素及其化合物在生产、生活中发挥着重要作用。回答下列问题:
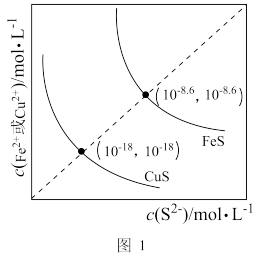
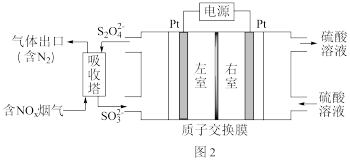
(1)常用硫化物作沉淀剂除去废水中的重金属离子。用FeS作沉淀剂除去Cu2+时,反应的离子方程式为_______ ;当Cu2+沉淀完全时,溶液中n(Fe2+):n(Cu2+)=_______ 。(已知①常温下FeS、CuS的沉淀溶解平衡曲线如图1所示;②当溶液中离子浓度小于l×l0-6mol·L-1时,该离子沉淀完全。)_______ 。当右室产生气体5.6L时,理论上消除NO的体积为_______ 。(气体均为标况下)
①室温下,已知亚硒酸的Ka1=10-2.5,Ka2=10-7.5。则H2SeO3水解常数为_______ 。
②证明亚硒酸是弱电解质的实验方法是_______ 。(可用试剂:0.1mol·L-1 H2SeO3)
③已知0.lmol·L-1硒酸溶液中存在c(H2SeO4)<0.lmol·L-1<c(H+),无H2SeO4,其可能的原因是_______ 。
(1)常用硫化物作沉淀剂除去废水中的重金属离子。用FeS作沉淀剂除去Cu2+时,反应的离子方程式为
①室温下,已知亚硒酸的Ka1=10-2.5,Ka2=10-7.5。则H2SeO3水解常数为
②证明亚硒酸是弱电解质的实验方法是
③已知0.lmol·L-1硒酸溶液中存在c(H2SeO4)<0.lmol·L-1<c(H+),无H2SeO4,其可能的原因是
21-22高二上·江苏南通·期末 查看更多[3]
江苏省海门中学2021-2022学年高二上学期期末质量调研化学试题 河南省南阳市2022-2023学年高二上学期期终质量评估化学试题(已下线)专题13 化学反应原理综合题-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)
更新时间:2022-04-11 09:41:25
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】已知Ka(Kb)、Kw、Kh、Ksp分别表示弱酸的电离平衡常数(弱碱的电离平衡常数)、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11。
(1)25℃时,1.0mol·L-1HF溶液的pH约等于_____ (已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈_____ (填“酸”“碱”或“中”)性,并结合有关数据解释原因:_____ 。
(2)已知CH3COONH4溶液呈中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:
A.NH4Cl B.NH4SCN C.CH3COONH4 D.NH4HCO3
回答下列问题:
①试推断NH4HCO3溶液的pH_____ (填“>”“<”或“=”)7。
②将四种溶液按 的浓度由大到小的顺序排列:
的浓度由大到小的顺序排列:_____ (填字母)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_____ 。
(3)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=_____ ,并据此推断Mg(OH)2_____ (填“能”或“不能”)溶解于醋酸(已知1.83≈5.8)。
(1)25℃时,1.0mol·L-1HF溶液的pH约等于
(2)已知CH3COONH4溶液呈中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:
A.NH4Cl B.NH4SCN C.CH3COONH4 D.NH4HCO3
回答下列问题:
①试推断NH4HCO3溶液的pH
②将四种溶液按
 的浓度由大到小的顺序排列:
的浓度由大到小的顺序排列:③NH4SCN溶液中所有离子浓度由大到小的顺序为
(3)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)
 Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室模拟拉希法用氨和次氯酸钠反应制备肼(N2H4),并探究肼的性质,制备装置如图所示。
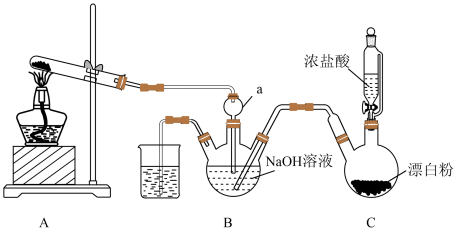
回答下列问题:
(1)肼的电子式为_______ 。
(2)装置A试管中的试剂为_______ 。
(3)装置B中制备肼的化学方程式为_______ 。
(4)上述装置中存在一处缺陷,会导致肼的产率降低,改进方法是_______ 。
(5)①探究性质。
已知N2H4是一种二元弱碱,在水中的电离与NH3相似,请写出肼的第二步电离的电离方程式:_______ ,室温下向N2H4水溶液中滴加某强酸,溶液的pH与 或
或 的变化关系如图所示,下列说法正确的是
的变化关系如图所示,下列说法正确的是_______ (填标号)。

A.N2H4在水溶液中第二步电离的平衡常数为10-1
B. 的平衡常数为109
的平衡常数为109
C.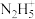 的水解能力大于其电离能力
的水解能力大于其电离能力
D.N2H6Cl2溶液中: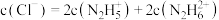
②测定产品中肼的质量分数。
称取装置B中溶液m g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH=6),加水配成100 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2~3滴指示剂,用c mol/L的碘标准溶液滴定,滴定过程中有无色无味无毒气体产生,定终点时平均消耗标准溶液V mL,产品中肼的质量分数为_______ (用含m、c、V的式子表示)。

回答下列问题:
(1)肼的电子式为
(2)装置A试管中的试剂为
(3)装置B中制备肼的化学方程式为
(4)上述装置中存在一处缺陷,会导致肼的产率降低,改进方法是
(5)①探究性质。
已知N2H4是一种二元弱碱,在水中的电离与NH3相似,请写出肼的第二步电离的电离方程式:
 或
或 的变化关系如图所示,下列说法正确的是
的变化关系如图所示,下列说法正确的是
A.N2H4在水溶液中第二步电离的平衡常数为10-1
B.
 的平衡常数为109
的平衡常数为109C.
 的水解能力大于其电离能力
的水解能力大于其电离能力D.N2H6Cl2溶液中:
②测定产品中肼的质量分数。
称取装置B中溶液m g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH=6),加水配成100 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2~3滴指示剂,用c mol/L的碘标准溶液滴定,滴定过程中有无色无味无毒气体产生,定终点时平均消耗标准溶液V mL,产品中肼的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究化学平衡对学习化学具有重要意义。
Ⅰ.在恒容密闭容器中发生如下反应:2NO2(g) N2O4(g) ΔH<0
N2O4(g) ΔH<0
(1)升高温度,该反应的平衡常数_______ (填“增大”“减小”或“不变”)。
(2)判断该反应是否达到平衡,下列可以作为判断依据的是_______。
Ⅱ.一定温度下,向2L的恒容密闭容器中充入一定量的N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

(3)0~10min内NO的反应速率为_______ 。
(4)图中A点υ(正)_______ υ(逆)(填“>”“<”或“=”)。
(5)第10min时,外界改变的条件可能是_______。
Ⅲ.含氯化合物广泛用于水处理剂及漂白剂。已知:工业上将Cl2通入7mol/L的NaOH溶液中制备NaClO;25℃时NaClO溶液中HClO、ClO-的物质的量分数随pH变化的分布如下图所示。

(6)写出上述制备NaClO的离子方程式_______ ;
(7)当NaClO溶液pH=9时,该溶液中主要存在的含氯阴离子有_______ (填离子符号);
(8)25℃时,反应ClO-+H2O HClO+OH-的平衡常数K=
HClO+OH-的平衡常数K=_______ (填数值)。
Ⅰ.在恒容密闭容器中发生如下反应:2NO2(g)
 N2O4(g) ΔH<0
N2O4(g) ΔH<0(1)升高温度,该反应的平衡常数
(2)判断该反应是否达到平衡,下列可以作为判断依据的是_______。
| A.容器内气体密度不再变化 | B.容器内各气体浓度不再变化 |
| C.体系中颜色不再变化 | D.υ正(NO2)=2υ正(N2O4) |
Ⅱ.一定温度下,向2L的恒容密闭容器中充入一定量的N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g)。其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
(3)0~10min内NO的反应速率为
(4)图中A点υ(正)
(5)第10min时,外界改变的条件可能是_______。
| A.加催化剂 | B.增大C(s)的量 |
| C.升温 | D.减小CO2的量 |
Ⅲ.含氯化合物广泛用于水处理剂及漂白剂。已知:工业上将Cl2通入7mol/L的NaOH溶液中制备NaClO;25℃时NaClO溶液中HClO、ClO-的物质的量分数随pH变化的分布如下图所示。

(6)写出上述制备NaClO的离子方程式
(7)当NaClO溶液pH=9时,该溶液中主要存在的含氯阴离子有
(8)25℃时,反应ClO-+H2O
 HClO+OH-的平衡常数K=
HClO+OH-的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】已知:I2+2S2O32-=S4O62-+2I-;CuI是不溶于水的白色沉淀。
相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_________ ,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________ 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用文字叙述):____________________________________________ 。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________ 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用_______________ 作滴定指示剂,滴定终点的现象是________________________ 。
②CuCl2溶液与KI反应的离子方程式为___________________________________________ 。
③该试样中CuCl2·2H2O的质量百分数为__________________
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用文字叙述):
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用
②CuCl2溶液与KI反应的离子方程式为
③该试样中CuCl2·2H2O的质量百分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】烟道灰中含有 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:

已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
② 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。

回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为___________ 。
(2)试剂X可能为___________。
(3)步骤M的目的是___________ ;
(4)步骤M后应调节 的范围为
的范围为___________ ;不同 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为___________ 。
(5) 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为___________ 。
(6)某实验室设计了如图b所示装置,通过通入 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为___________ 。

 等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下:
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示。
| 金属离子 |  |  |  |
| 开始沉淀的pH | 7.0 | 1.9 | 8.1 |
| 完全沉淀的pH | 9.0 | 3.2 | 10.1 |
 的化学性质与
的化学性质与 相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数(lgc)与pH的关系如图所示。
回答下列问题:
(1)基态Fe原子、Mn原子核外未成对电子数之比为
(2)试剂X可能为___________。
A. 溶液 溶液 | B.氨水 | C. 溶液 溶液 | D.稀 |
(3)步骤M的目的是
(4)步骤M后应调节
 的范围为
的范围为 ,含
,含 微粒在体系中的存在形式不同,依据图a数据,求该温度下
微粒在体系中的存在形式不同,依据图a数据,求该温度下 的
的 为
为(5)
 在空气中易被氧化为
在空气中易被氧化为 ,反应的化学方程式为
,反应的化学方程式为(6)某实验室设计了如图b所示装置,通过通入
 来制备
来制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。石墨电极反应式为
并可分别通过阴、阳膜定向移动。石墨电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】四氯化钛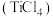 是制取航天航空工业材料——钛合金的重要原料。实验室以
是制取航天航空工业材料——钛合金的重要原料。实验室以 和
和 为原料制取液态
为原料制取液态 的装置如图所示(部分夹持装置省略)。
的装置如图所示(部分夹持装置省略)。

已知:①制取制取 的反应原理为
的反应原理为 。
。
②有关物质的性质如下表:
回答下列问题:
(1)仪器N的名称是_______ ,仪器A中盛装的试剂是_______ 。
(2)组装仪器并检查装置气密性,在反应前通一段时间 的目的是
的目的是_______ 。
(3)装置B中热水的作用是_______ 。
(4)产品纯度测定:取 产品于烧瓶中,向安全漏斗(如图所示)中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成
产品于烧瓶中,向安全漏斗(如图所示)中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成 溶液,取
溶液,取 所配溶液于锥形瓶中,滴加几滴
所配溶液于锥形瓶中,滴加几滴 的
的 溶液作指示剂,用
溶液作指示剂,用 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液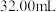 。
。

已知:① 遇水会发生反应
遇水会发生反应 。
。
② 是一种深红色固体,常温下,
是一种深红色固体,常温下, ,
, 。
。
①安全漏斗中的水在本实验中的作用除与 反应外,还有
反应外,还有_______ 。
②该沉淀滴定终点的判断方法是_______ 。
③该产品纯度为_______ %。
 是制取航天航空工业材料——钛合金的重要原料。实验室以
是制取航天航空工业材料——钛合金的重要原料。实验室以 和
和 为原料制取液态
为原料制取液态 的装置如图所示(部分夹持装置省略)。
的装置如图所示(部分夹持装置省略)。
已知:①制取制取
 的反应原理为
的反应原理为 。
。②有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
 | -23 | 76 | 与 互溶 互溶 |
 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)仪器N的名称是
(2)组装仪器并检查装置气密性,在反应前通一段时间
 的目的是
的目的是(3)装置B中热水的作用是
(4)产品纯度测定:取
 产品于烧瓶中,向安全漏斗(如图所示)中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成
产品于烧瓶中,向安全漏斗(如图所示)中加入足量蒸馏水后,立即夹紧弹簧夹,充分反应后将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成 溶液,取
溶液,取 所配溶液于锥形瓶中,滴加几滴
所配溶液于锥形瓶中,滴加几滴 的
的 溶液作指示剂,用
溶液作指示剂,用 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液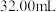 。
。
已知:①
 遇水会发生反应
遇水会发生反应 。
。②
 是一种深红色固体,常温下,
是一种深红色固体,常温下, ,
, 。
。①安全漏斗中的水在本实验中的作用除与
 反应外,还有
反应外,还有②该沉淀滴定终点的判断方法是
③该产品纯度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】硝酸厂的烟气中含有一定量的氮氧化物(NOx),通常要将烟气中的氮氧化物转化为无毒无害的物质即脱硝。
(1)用空气-水脱硝的方法是最经济的方法。
已知:①2NO(g)+O2(g)=2NO2(g)△H1=-123.4kJ·mol-1
②3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)△H2=-73.6kJ·mol-1
写出NO(g)、O2(g)和液体水反应生成HNO3(aq)的热化学方程式______ 。
(2)吸收电解法是脱硝的种重要方法。先用稀硝酸吸收NOx、反应生成HNO2(一元弱酸),再将吸收液加入电解槽中进行电解,使之转化为硝酸,其电解装置如下图所示。

①图中a应连接电源的________ (正极或负极),其电极反应式为_____ 。
②电解过程中总反应的化学方程式是_____ 。有10 mol HNO2参加反应.氧化产物的物质的量是_____ 。
③阴极区产生1mol氮气时,理论上阳极区减少H+的物质的量约为_____ 。
(1)用空气-水脱硝的方法是最经济的方法。
已知:①2NO(g)+O2(g)=2NO2(g)△H1=-123.4kJ·mol-1
②3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)△H2=-73.6kJ·mol-1
写出NO(g)、O2(g)和液体水反应生成HNO3(aq)的热化学方程式
(2)吸收电解法是脱硝的种重要方法。先用稀硝酸吸收NOx、反应生成HNO2(一元弱酸),再将吸收液加入电解槽中进行电解,使之转化为硝酸,其电解装置如下图所示。

①图中a应连接电源的
②电解过程中总反应的化学方程式是
③阴极区产生1mol氮气时,理论上阳极区减少H+的物质的量约为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如图:
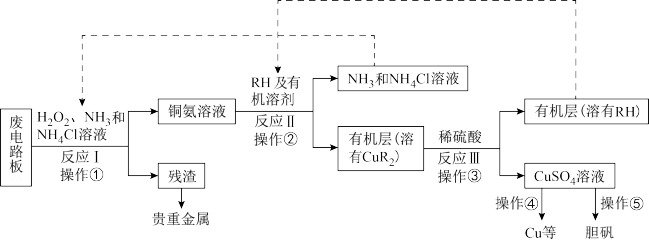
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3) ,反应中H2O2的作用是
,反应中H2O2的作用是___ 。写出操作①的名称:___ 。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3) 与有机物RH反应,写出该反应的离子方程式:
与有机物RH反应,写出该反应的离子方程式:___ 。操作②用到的主要仪器名称为___ ,其目的是(填序号)___ 。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和___ 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是___ 。
(5)操作⑤由硫酸铜溶液制胆矾的主要步骤是___ 。

回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)
 ,反应中H2O2的作用是
,反应中H2O2的作用是(2)反应Ⅱ是铜氨溶液中的Cu(NH3)
 与有机物RH反应,写出该反应的离子方程式:
与有机物RH反应,写出该反应的离子方程式:a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是
(5)操作⑤由硫酸铜溶液制胆矾的主要步骤是
您最近一年使用:0次
【推荐3】根据要求回答下列问题:
Ⅰ.中和热是指在稀溶液中,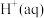 与
与 发生中和反应生成
发生中和反应生成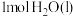 时的反应热。利用如图所示装置测定中和热,取
时的反应热。利用如图所示装置测定中和热,取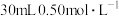 稀硫酸与
稀硫酸与 溶液进行实验,实验数据如表。
溶液进行实验,实验数据如表。

回答下列问题:
(1)上述实验中温度变化的平均值为___________  ,若近似认为
,若近似认为 稀硫酸与
稀硫酸与 溶液的密度均为
溶液的密度均为 (忽略溶液混合后体积变化),反应所得溶液的比热容
(忽略溶液混合后体积变化),反应所得溶液的比热容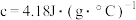 ,则中和热
,则中和热 的数值为
的数值为___________  (保留1位小数)。
(保留1位小数)。
(2)上述实验结果与中和热数值 有偏差,产生偏差的原因不可能是因为___________ (填标号)。
有偏差,产生偏差的原因不可能是因为___________ (填标号)。
Ⅱ. 在下图所示装置中,试管 、
、 中的电极为多孔的惰性电极,
中的电极为多孔的惰性电极, 、
、 为两个铜夹,夹在被
为两个铜夹,夹在被 溶液浸湿的滤纸条上,滤纸条的中部滴有
溶液浸湿的滤纸条上,滤纸条的中部滴有 液滴;电源有、
液滴;电源有、 两极。若在
两极。若在 、
、 中充满
中充满 溶液后倒立于盛
溶液后倒立于盛 溶液的水槽中,断开
溶液的水槽中,断开 ,闭合
,闭合 、
、 ,通直流电,实验现象如图所示,则:
,通直流电,实验现象如图所示,则:

(3) 是电源的
是电源的___________ 极。
(4)在 溶液浸湿的滤纸条中部的
溶液浸湿的滤纸条中部的 处现象为
处现象为___________ 。写出电极 的电极反应式
的电极反应式___________ 。
(5)断开 、
、 ,闭合
,闭合 ,一段时间后KOH溶液
,一段时间后KOH溶液
___________ (填“变大”“变小”或“不变”)。
Ⅰ.中和热是指在稀溶液中,
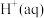 与
与 发生中和反应生成
发生中和反应生成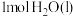 时的反应热。利用如图所示装置测定中和热,取
时的反应热。利用如图所示装置测定中和热,取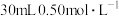 稀硫酸与
稀硫酸与 溶液进行实验,实验数据如表。
溶液进行实验,实验数据如表。
| 温度 实验次数 | 起始温度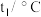 | 终止温度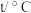 | ||
 |  | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.2 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.3 |
(1)上述实验中温度变化的平均值为
 ,若近似认为
,若近似认为 稀硫酸与
稀硫酸与 溶液的密度均为
溶液的密度均为 (忽略溶液混合后体积变化),反应所得溶液的比热容
(忽略溶液混合后体积变化),反应所得溶液的比热容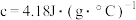 ,则中和热
,则中和热 的数值为
的数值为 (保留1位小数)。
(保留1位小数)。(2)上述实验结果与中和热数值
 有偏差,产生偏差的原因不可能是因为___________ (填标号)。
有偏差,产生偏差的原因不可能是因为___________ (填标号)。| A.实验装置保温、隔热效果差 |
| B.用量筒量取NaOH溶液的体积时仰视读数 |
| C.分多次把NaOH溶液倒入内筒中 |
| D.测过稀硫酸的温度计未洗净直接用于测定NaOH溶液的温度 |
Ⅱ. 在下图所示装置中,试管
 、
、 中的电极为多孔的惰性电极,
中的电极为多孔的惰性电极, 、
、 为两个铜夹,夹在被
为两个铜夹,夹在被 溶液浸湿的滤纸条上,滤纸条的中部滴有
溶液浸湿的滤纸条上,滤纸条的中部滴有 液滴;电源有、
液滴;电源有、 两极。若在
两极。若在 、
、 中充满
中充满 溶液后倒立于盛
溶液后倒立于盛 溶液的水槽中,断开
溶液的水槽中,断开 ,闭合
,闭合 、
、 ,通直流电,实验现象如图所示,则:
,通直流电,实验现象如图所示,则:
(3)
 是电源的
是电源的(4)在
 溶液浸湿的滤纸条中部的
溶液浸湿的滤纸条中部的 处现象为
处现象为 的电极反应式
的电极反应式(5)断开
 、
、 ,闭合
,闭合 ,一段时间后KOH溶液
,一段时间后KOH溶液
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】我国力争于2030年前做到碳达峰,2060年前实现碳中和。
(1)已知下列热化学方程式:
①

②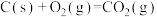

③

写出由 、
、 和
和 化合生成
化合生成 的热化学方程式
的热化学方程式___________ 。
(2)在稀硫酸中利用电催化可将 同时转化为多种燃料,其原理如图甲所示。
同时转化为多种燃料,其原理如图甲所示。


①阳极的电极反应式为___________
②铜电极上产生 的电极反应式为
的电极反应式为___________ ,若铜电极上只生成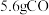 ,则铜极区溶液质量变化了
,则铜极区溶液质量变化了___________ g。
③若铜极上只生成 和
和 ,则电路中转移
,则电路中转移___________  电子。
电子。
(3)我国科学家报道了机理如图乙所示的电化学过程。
① 电极为
电极为___________ 极,
②理论上,每有 与
与 结合,电路中转移电子数为
结合,电路中转移电子数为___________ 。
(1)已知下列热化学方程式:
①


②
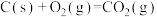

③


写出由
 、
、 和
和 化合生成
化合生成 的热化学方程式
的热化学方程式(2)在稀硫酸中利用电催化可将
 同时转化为多种燃料,其原理如图甲所示。
同时转化为多种燃料,其原理如图甲所示。

①阳极的电极反应式为
②铜电极上产生
 的电极反应式为
的电极反应式为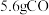 ,则铜极区溶液质量变化了
,则铜极区溶液质量变化了③若铜极上只生成
 和
和 ,则电路中转移
,则电路中转移 电子。
电子。(3)我国科学家报道了机理如图乙所示的电化学过程。
①
 电极为
电极为②理论上,每有
 与
与 结合,电路中转移电子数为
结合,电路中转移电子数为
您最近一年使用:0次
【推荐2】从CO2捕获技术应用中分离出CO2,作原料气体来合成基础化工品是很有前景的方法。
(1)研究表明二氧化碳与氢气在某催化剂作用下可以还原为甲醇,该反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示单个CO2分子吸附在催化剂表面;图中*H已省略)。
CH3OH(g)+H2O(g)。反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示单个CO2分子吸附在催化剂表面;图中*H已省略)。

①上述合成甲醇的反应过程中决定反应速率的步骤是___________ (用化学方程式表示)。
②该过程的热化学反应方程式为___________ 。
③有利于提高平衡时CO2转化率的措施有___________ (填字母)。
a.使用催化剂 b.增大压强 c.增大CO2和H2的初始投料比 d.升高温度
(2)在催化剂(Ni/xMg)作用下二氧化碳与氢气反应还可以还原为甲烷,反应如下CO2(g)+4H2(g) CH4(g)+2H2O(g)。以5 mol H2和1 mol CO2为初始原料,保持总压为P0发生反应,不同温度下在相同时间测得CO2的转化率如图。
CH4(g)+2H2O(g)。以5 mol H2和1 mol CO2为初始原料,保持总压为P0发生反应,不同温度下在相同时间测得CO2的转化率如图。

①三种催化剂(Ni/xMg)中,催化效果最好的是___________ 。使用Ni催化反应1.2 min达到A点,化学反应速率v(H2)=___________ g∙min-1。
②下列表述能说明反应达到平衡的是___________ 。
a.v正(H2)=2v逆(H2O) b.气体压强不变 c.气体总质量不变 d.气体总体积不变
③B点的平衡常数Kp计算式为___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)催化电解吸收CO2的KOH溶液(主要溶质为KHCO3)可将CO2转化为有机物。在相同条件下,随电解电压的变化阴极产物也发生变化。
①当电压较低时,电解过程中没有含碳产物生成,阴极主要还原产物为___________ 。
②当电压较高时,电解生成C2H4和HCOO-消耗的电量之比为3:1,则C2H4和HCOO-物质的量之比为___________ 。
(1)研究表明二氧化碳与氢气在某催化剂作用下可以还原为甲醇,该反应如下:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示单个CO2分子吸附在催化剂表面;图中*H已省略)。
CH3OH(g)+H2O(g)。反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示单个CO2分子吸附在催化剂表面;图中*H已省略)。
①上述合成甲醇的反应过程中决定反应速率的步骤是
②该过程的热化学反应方程式为
③有利于提高平衡时CO2转化率的措施有
a.使用催化剂 b.增大压强 c.增大CO2和H2的初始投料比 d.升高温度
(2)在催化剂(Ni/xMg)作用下二氧化碳与氢气反应还可以还原为甲烷,反应如下CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。以5 mol H2和1 mol CO2为初始原料,保持总压为P0发生反应,不同温度下在相同时间测得CO2的转化率如图。
CH4(g)+2H2O(g)。以5 mol H2和1 mol CO2为初始原料,保持总压为P0发生反应,不同温度下在相同时间测得CO2的转化率如图。
①三种催化剂(Ni/xMg)中,催化效果最好的是
②下列表述能说明反应达到平衡的是
a.v正(H2)=2v逆(H2O) b.气体压强不变 c.气体总质量不变 d.气体总体积不变
③B点的平衡常数Kp计算式为
(3)催化电解吸收CO2的KOH溶液(主要溶质为KHCO3)可将CO2转化为有机物。在相同条件下,随电解电压的变化阴极产物也发生变化。
①当电压较低时,电解过程中没有含碳产物生成,阴极主要还原产物为
②当电压较高时,电解生成C2H4和HCOO-消耗的电量之比为3:1,则C2H4和HCOO-物质的量之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】学习化学反应原理能够指导促进人类生活质量的提高。
(1)氢气是最理想的能源。1g氢气完全燃烧放出热量121.6kJ,其中断裂1mol H-H键吸收436kJ,断裂1mol O=O键吸收496kJ,则形成1mol H-O键放出热量_______ kJ。
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某兴趣小组拟将刻蚀电路板的反应2FeCl3+Cu=2FeCl2+CuCl2设计成原电池,则负极所用电极材料为_______ ,当线路中转移0.4mol电子时,则被腐蚀铜的质量为_______ g。
(3)CH4—空气碱性燃料电池的能量转化率高,某甲烷燃料电池如图所示。放电时,电子由铂极流出,经电流表流向石墨电极。
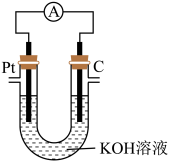
①在石墨电极附近充入_______ (填“CH4”或“空气”)。
②铂极上发生反应的电极反应式为_______ 。
(4)在开始工作的Zn、Cu原电池中,电解质的稀溶液中含CuSO4、H2SO4各0.100mol,则:当电路中通过的电子在0.200~0.300mol时,正极发生的电极反应式是_______ ;当电路中通过0.300mol电子时,电池中共产生标准状况下的气体_______ L。
(1)氢气是最理想的能源。1g氢气完全燃烧放出热量121.6kJ,其中断裂1mol H-H键吸收436kJ,断裂1mol O=O键吸收496kJ,则形成1mol H-O键放出热量
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某兴趣小组拟将刻蚀电路板的反应2FeCl3+Cu=2FeCl2+CuCl2设计成原电池,则负极所用电极材料为
(3)CH4—空气碱性燃料电池的能量转化率高,某甲烷燃料电池如图所示。放电时,电子由铂极流出,经电流表流向石墨电极。

①在石墨电极附近充入
②铂极上发生反应的电极反应式为
(4)在开始工作的Zn、Cu原电池中,电解质的稀溶液中含CuSO4、H2SO4各0.100mol,则:当电路中通过的电子在0.200~0.300mol时,正极发生的电极反应式是
您最近一年使用:0次



