(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。已知:
反应I:CO2(g)+H2(g)
 CO(g)+H2O(g) △H =+41.2kJ·mol-1
CO(g)+H2O(g) △H =+41.2kJ·mol-1反应Ⅱ:2CO(g)+2H2(g)
 CO2(g)+CH4(g)△H =-247.1kJ·mol-1
CO2(g)+CH4(g)△H =-247.1kJ·mol-1①CO2甲烷化反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的△H =
CH4(g)+2H2O(g)的△H =A.高温高压 B.高温低压 C.低温高压 D.低温低压
②反应I:CO2(g)+H2(g)
 CO(g)+H2O(g) △H = +41.2kJ·mol-1,已知反应的
CO(g)+H2O(g) △H = +41.2kJ·mol-1,已知反应的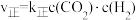 ,
,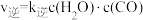 (
( 和
和 为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,与温度、催化剂有关)。若平衡后升高温度,则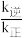
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(CO2):c(H2):c(CO):c(H2O)=1:1:1:1
D.单位时间内,断开C=O的数目和断开H—O的数目相同
(2)在某催化剂表面发生如下反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2mol CO2和6mol H2发生反应,图甲表示压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2mol CO2和6mol H2发生反应,图甲表示压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。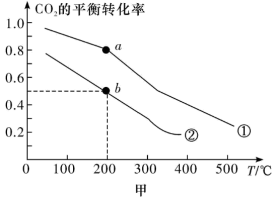
其中表示压强为5.0MPa下CO2的平衡转化率随温度的变化曲线为
 =
= 为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。(3)科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC),从而实现CO2的综合利用。图乙为理想的CeO2的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图丙)。
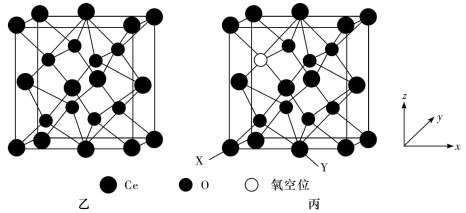
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知:CeO2缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为
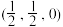 ,则氧空位处原子的分数坐标为
,则氧空位处原子的分数坐标为②设阿伏加德罗常数的值为
 ,晶胞参数为apm,CeO2理想晶型的密度为
,晶胞参数为apm,CeO2理想晶型的密度为相似题推荐
I.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.2kJ•mol-1
CO(g)+H2O(g) ΔH1=+41.2kJ•mol-1II.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-49.4kJ•mol-1
CH3OH(g)+H2O(g) ΔH2=-49.4kJ•mol-1(1)CO(g)和H2(g)的反应生成CH3OH(g)的热化学方程式为
(2)温度为T℃时,向容积为2L的密闭容器中投入3molH2和1molCO2发生反应I和II。
①反应达到平衡时,测得CO2的转化率为50%,生成CO的选择性(CO的选择性=
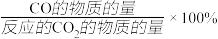 )为20%,则T℃时反应I的平衡常数K=
)为20%,则T℃时反应I的平衡常数K=②下图为T℃时,c(CH3OH)随时间的变化图象。请从分子碰撞理论角度分析下图曲线中c(CH3OH)在0~t2区间变化的原因
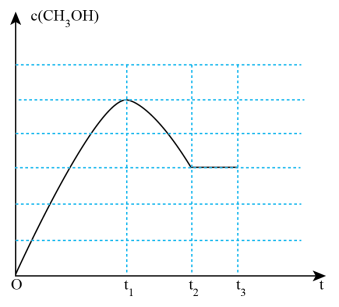
③维持其它条件不变,在容器中加入一种合适的催化剂能大幅提高反应I的速率,而对反应II的速率影响不大,请在上图中画出c(CH3OH)随时间的变化曲线
④当其他条件相同时,以催化剂A和C进行实验,在相同时间内测得CH3OH浓度变化情况如图所示。下列说法正确的是
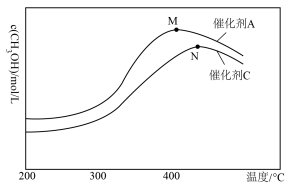
A.在催化剂A的作用下反应的平衡常数比催化剂C时大
B.反应在N点已达到平衡,此后甲醇浓度减小的原因可能是温度升高,平衡向左移动
C.M点后甲醇浓度减小的原因可能是温度升高使催化剂活性降低
D.上升一定温度时,两条曲线可能相交
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是
a.PM2.5空气中形成了胶体
b.PM2.5表面积能大面积吸附大量的有毒有害物质
c.机动车尾气排放等过程中经过燃烧而排放的残留物,大多还有重金属等有毒物质
d.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2
 CH3OH+H2O
CH3OH+H2O已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)= H2O(l) △H=-c kJ·mol-1;
CH3OH(g)= CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。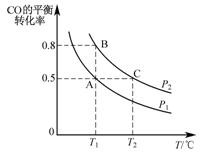
①下列说法不能判断该反应达到化学平衡状态的是
a.H2 的消耗速率等于 CH3OH 的生成速率的 2 倍
b.H2 的体积分数不再改变
c.体系中 H2 的转化率和 CO 的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较 A、B 两点压强大小 PA
③若达到化学平衡状态 A 时,容器的体积为 20 L。如果反应开始时仍充入 10 mol CO 和 20 mol H2,则在平衡状态 B 时容器的体积 V(B)=
(4)SO2 在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:

①该电池的负极反应:
②当甲中消耗2.24 L O2(标准状况)时,乙中
【推荐3】煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)⇌CaO(s)+CO2(g) ∆H1= +178.30kJ/mol
②CaO(s)+SO2(g)+0.5O2(g)⇌CaSO4(s) ∆H2= -501.92 kJ/mol
③CO(g) + 0.5O2(g)⇌CO2(g) ∆H3
④CaSO4(s) + CO(g)⇌CaO(s) + SO2(g) + CO2(g) ∆H4= +218.92kJ/mol
(1)温度升高,反应①的化学平衡常数
(2)∆H3=
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比),结合反应②、③、④分析其原因:
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。
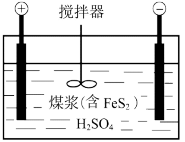
(4)将煤打成煤浆加入电解槽的目的是
(5)阳极的电极反应式为
(6)用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式为(补全并配平):FeS2+·OH =Fe3++SO + H2O +_______
+ H2O +_______
(7)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如图所示。pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;
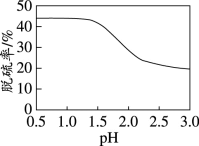
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566.0kJ·mol-1
2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(l) △H2=-1453kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
(2)利用反应CO2(g)+H2(g)⇌CO(g)+H2O(g) △H,可获得化工原料CO,CO2的平衡转化率与温度的关系如图1。
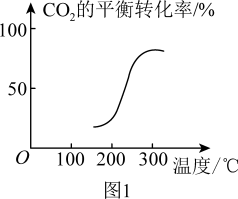
①△H
②240℃时,将2molCO2和2molH2通入容积为8L的恒容密闭容器中,达到平衡时CO2的转化率为50%。此时该反应的平衡常数K=
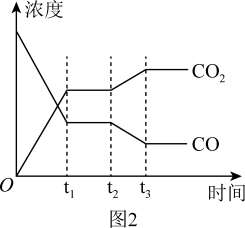
③该反应在一恒容密闭容器中进行,反应过程如图2,t1时达到平衡,t2时仅改变一个条件,该条件是
(3)300℃时,向一体积为10L的恒容密闭容器中充入1.32molCH3OH和1.2molH2O,发生反应:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) △H1=+49kJ·mol-1。
①高温下,CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)能自发进行的原因是
②反应经5min达到平衡,测得H2的物质的量为2.97mol。0~5min内,H2的反应速率为
③CH3OH(g)与H2O(g)反应相对于电解水制备H2的优点是
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1①
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1②
N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ·mol-1③
某反应的平衡常数表达式为K=
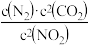 ,写出该反应的热化学方程式
,写出该反应的热化学方程式(2)利用氨气可将汽车尾气中的NOx还原为N2和H2O,反应原理是:NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g) ΔH
3H2O(g)+2N2(g) ΔH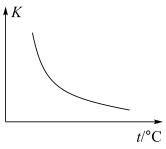
①该反应化学平衡常数K与温度t关系如上图所示,则ΔH
②能增加平衡时NOx去除率的条件是
A.高温高压 B.低温低压 C.选择优异催化剂 D.一定条件下分离出水
③500℃时,在2 L恒容密闭容器中充入1 mol NO、1 mol NO2和2 mol NH3,10 min时反应达到平衡,此时NH3的转化率为50%,体系压强为pMPa,则0~10 min内用NH3表示的平均反应速率v(NH3)=
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向一恒压密闭容器中加入活性炭(足量)和NO,t1时到达平衡。在t2时刻继续充入一定量NO,t3时刻重新到达平衡,请在下图中作出逆反应速率在t2~t3变化的曲线
N2(g)+CO2(g)。向一恒压密闭容器中加入活性炭(足量)和NO,t1时到达平衡。在t2时刻继续充入一定量NO,t3时刻重新到达平衡,请在下图中作出逆反应速率在t2~t3变化的曲线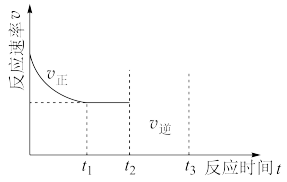
(4)在恒温恒容密闭容器中发生反应C(s)+2NO(g)
 N2(g)+CO2(g) ,下列说法正确的是___________。
N2(g)+CO2(g) ,下列说法正确的是___________。| A.NO与CO2的物质的量之比不变时说明反应已达平衡 |
| B.混合气体的压强不变时说明反应已达平衡 |
| C.该反应能否自发的判断依据主要由ΔH决定 |
| D.增加碳的量,导致Qc<K,平衡正向移动 |
(1)已知反应
 ,
,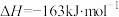 ,1mol
,1mol 、1mol
、1mol 分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则2mol
分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则2mol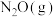 分子中化学键断裂时需要吸收的能量为
分子中化学键断裂时需要吸收的能量为(2)实验1:在t℃时,无催化剂的恒容容器中,反应
 起始压强为p0的部分实验数据如下:
起始压强为p0的部分实验数据如下:| 反应时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
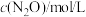 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0-30min 时段,反应速率
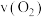 为
为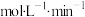 。
。②若
 起始浓度c0为
起始浓度c0为 ,则反应至50min时
,则反应至50min时 的转化率α=
的转化率α= 的分解速率:
的分解速率: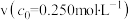
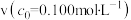 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。③在该温度下,反应的平衡常数Kp=
④在t℃时,不同催化剂下产生氧气的体积
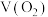 与分解时间的关系如下图,下列说法正确的是
与分解时间的关系如下图,下列说法正确的是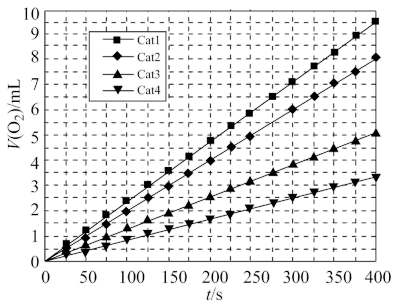
A.其他条件不变时,增大
 的浓度,提高了单位体积
的浓度,提高了单位体积 的活化分子数,
的活化分子数, 的分解速率加快
的分解速率加快B.保持温度不变,缩小反应容器的体积,
 分解的速率加快
分解的速率加快C.由上图可知,Catl催化效率最高
D.其他条件相同时,Catl催化分解
 的活化能比用Cat4催化分解
的活化能比用Cat4催化分解 的活化能小。
的活化能小。⑤不同温度(T)下,
 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 消耗一半时所需的相应时间),则
消耗一半时所需的相应时间),则
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。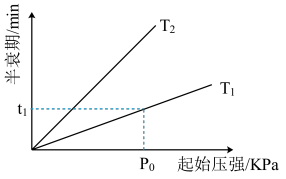
Ⅱ.科学家利用反应对汽车尾气进行无害化处理,发生如下反应:
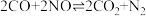 。CO的平衡转化率与温度、起始投料比m的关系如图所示,图中起始投料比
。CO的平衡转化率与温度、起始投料比m的关系如图所示,图中起始投料比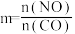 。
。
(3)图中
 与
与 大小关系是
大小关系是(4)a、b、c三点对应的平衡常数
 、
、 、
、 相对大小关系是
相对大小关系是(5)随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为
(2)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)
 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:| 时间/s | 20 | 40 | 60 | 80 | 100 |
| C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20 s内,v(NO2)=
②升高温度时,气体颜色加深,则正反应是
③该温度下反应的化学平衡常数数值为
④相同温度下,若开始向该容器中充入0.80molNO2,则达到平衡后: c(NO2)
(3)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
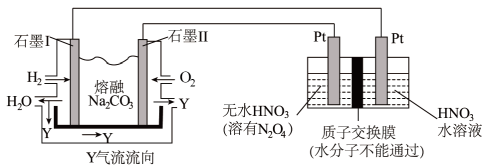
①写出石墨I电极上发生反应的电极反应式
②在电解池中生成N2O5的电极反应式为
a.EB(g)=ST(g)+H2(g) △H1
b.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2 kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g) △H3=+158.8 kJ·mol-1
回答下列问题:
(1)为提高EB平衡转化率,应选择的反应条件为_______(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
 CO(g)+H2O(g)。
CO(g)+H2O(g)。①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图。
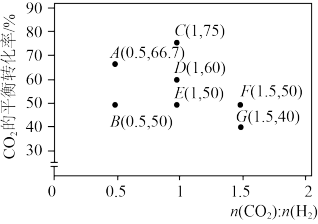
已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
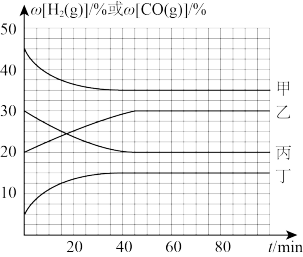
 =
=②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[CO(g)]的曲线是
(3)恒压0.1 MPa下,改变原料气配比为下列三种情况:仅EB、n(EB):n(CO2)=1:10、n(EB):n(N2)=1:10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图所示。
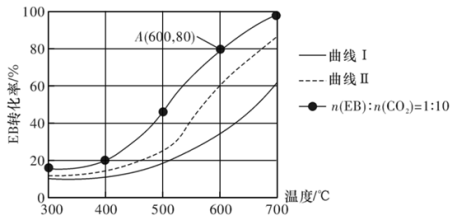
①图中,表示原料气配比n(EB):n(N2)=1:10的曲线是曲线
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:
③设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1 MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的Kpr为
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)△H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是
2NO(g)△H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是A.混合气体的密度不再变化
B.容器内的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的百分含量不再变化
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ·mol- 1
②洗涤含SO2的烟气。
写出焦炭与水蒸气反应的热化学方程式:
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式
②计算上述反应T1℃时的平衡常数K1=
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为
 )制造。
)制造。(1)钛在元素周期表中位于
(2)高温条件下,可用
 和
和 反应制取
反应制取 。
。①
 的熔点为
的熔点为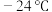 ,易溶于乙醇等有机溶剂,说明
,易溶于乙醇等有机溶剂,说明 属于
属于 的熔点为
的熔点为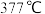 ,
, 的熔点明显高于
的熔点明显高于 的原因是
的原因是②用锌还原
 的盐酸溶液,经后续处理可制得配合物
的盐酸溶液,经后续处理可制得配合物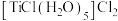 ,
, 该配合物中含
该配合物中含 键
键 。
。(3)
 的天然晶体最常见的有两种:金红石型和锐钛型。
的天然晶体最常见的有两种:金红石型和锐钛型。①金红石型
 是最稳定的一种晶体,其晶胞结构如图所示,则黑球表示
是最稳定的一种晶体,其晶胞结构如图所示,则黑球表示
②研究发现,天然锐钛型
 晶体中掺杂一定量的氮原子后生成
晶体中掺杂一定量的氮原子后生成 对可见光具有活性,掺杂前后晶胞的变化如图所示:
对可见光具有活性,掺杂前后晶胞的变化如图所示: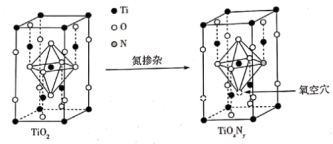
 晶胞中
晶胞中 位于六个
位于六个 围成的正八面体的中心,则该晶胞中含有
围成的正八面体的中心,则该晶胞中含有 晶胞中x=
晶胞中x=(1)基态铁原子的价电子排布式为
(2)摩尔盐中的组成元素N、O的电负性大小顺序是
(3)SO2、SO3、SO
 是三种常见含硫微粒。
是三种常见含硫微粒。①SO
 微粒的立体构型为
微粒的立体构型为②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是
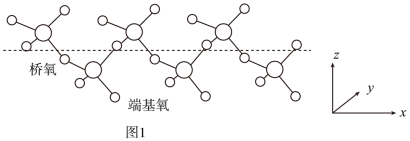
(4)噻吩(
 )、吡咯(
)、吡咯(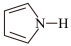 )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。
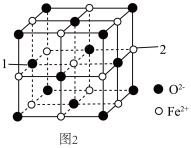
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0,
 ,
, ),则原子2的坐标为
),则原子2的坐标为②Fe2+处于O2﹣围成的
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为
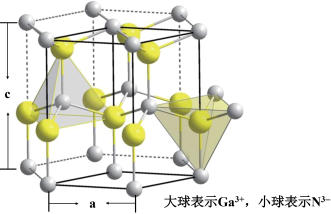
(1)基态Ga原子的电子排布式为
(2)B能形成很多类似于烃类的物质,比如B2H6,分子中B也形成四根键,但不含B-B键,试画出B2H6的结构式
(3)电解氧化铝需要添加冰晶石Na3AlF6,它的阴离子的空间结构为
(4)AlF3,AlCl3熔点分别为1290 oC和192 oC,熔点呈现如此变化的原因是
(5)H3BO3晶体形成层状结构,每一层的结构如下图所示,层与层之间距离为318 pm(大于氢键的长度),硼酸晶体属于

(6)GaN是二元Ⅲ-Ⅴ A族的直接带隙半导体,非常适合制造光电器件,GaN具有六方纤锌矿结构,晶胞示意图如下图所示,该晶胞的边长a = 318 pm,c = 517 pm。该GaN晶体的密度ρ =