NH4HCO3是我国除尿素外使用最广泛的一种氮肥产品,还用作缓冲剂、充气剂和分析试剂。常温下,0.1mol·L-1NH4HCO3溶液pH是7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
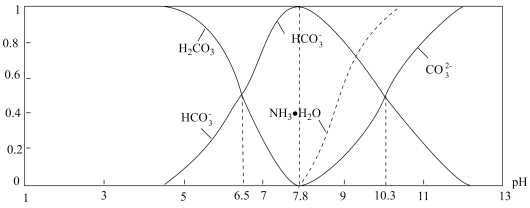
A.pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时, 和 和 浓度逐渐减小 浓度逐渐减小 |
B.NH4HCO3溶液中:c(NH3·H2O) + c( ) >c(H2CO3) ) >c(H2CO3) |
C.分析可知,常温下水解平衡常数Kh( )的数量级为10-7 )的数量级为10-7 |
D.常温下,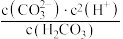 = 10-16.8 = 10-16.8 |
2023·云南曲靖·一模 查看更多[4]
云南省曲靖市2023届高三第一次教学质量检测理科综合化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(不定项选择题)(已下线)专题14 水溶液中的离子平衡(已下线)T13-水溶液中的离子平衡
更新时间:2023-03-09 16:34:12
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列叙述正确 的是
A.用水稀释0.1 mol/L的氨水,则溶液中 增大 增大 |
| B.pH=3的盐酸和醋酸分别升高相同的温度,pH均不变 |
| C.在等体积等pH 的盐酸和醋酸两溶液中分别加入等质量的相同锌粒,若只有一种溶液中的锌粒有剩余,则该溶液一定是盐酸; |
| D.两种氨水溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c2=10 c1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】改变0.1mol/L草酸溶液的pH,溶液中 、
、 、
、 的分布系数δ(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示,已知
的分布系数δ(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示,已知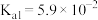 ,
,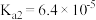 ,
, ,
, ,下列叙述错误的是
,下列叙述错误的是

 、
、 、
、 的分布系数δ(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示,已知
的分布系数δ(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示,已知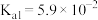 ,
,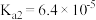 ,
, ,
, ,下列叙述错误的是
,下列叙述错误的是
A.pH=3.5时,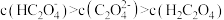 |
B.pH=1.23时,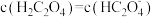 |
C.a的分布系数为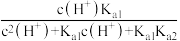 |
D.pH=2.5时,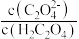 约为0.38 约为0.38 |
您最近一年使用:0次
单选题
|
较难
(0.4)
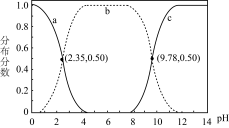
【推荐1】甘氨酸(NH2CH2CO0H)是人体必需氨基酸之一,在25℃时, 、
、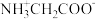 、
、 的分布分数[如
的分布分数[如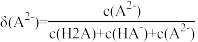 ]与溶液pH关系如图,下列说法错误的是
]与溶液pH关系如图,下列说法错误的是
 、
、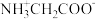 、
、 的分布分数[如
的分布分数[如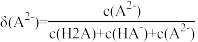 ]与溶液pH关系如图,下列说法错误的是
]与溶液pH关系如图,下列说法错误的是
| A.甘氨酸具有两性 |
B.曲线a代表NH CH2COOH CH2COOH |
C.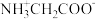 +H2O= +H2O= +OH-的平衡常数K=10-11.65 +OH-的平衡常数K=10-11.65 |
D.c( )·c( )·c( )>c2( )>c2(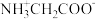 ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是


| A.点①所示溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B.点②所示溶液中:c(Na+)=c(CH3COO-) |
| C.点③所示溶液中:c(Na+) +c(H+)< c(CH3COOH)+c(CH3COO-) +c(OH-) |
| D.滴定过程中可能出现:c(CH3COOH)> c(H+)>c(CH3COO-)>c(Na+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】KHC2O4•H2C2O4•2H2O(草酸三氢钾)主要用于缓冲溶液的配制。室温时,H2C2O4的Ka1=5.9×10-2,Ka2=6.4×10-5。下列有关0.1mol·L-1草酸三氢钾溶液的说法正确的是
A.c(H2C2O4)>c(K+)>c(HC2O ) ) |
B.c(K+)=c(C2O )+c(HC2O )+c(HC2O )+c(H2C2O4) )+c(H2C2O4) |
C.向其中滴加NaOH溶液至溶液呈中性:c(K+)>c(Na+)>c(HC2O )>c(C2O )>c(C2O ) ) |
D.与0.3mol·L-1NaOH溶液等体积混合:c(K+)+c(Na+)>2c(C2O )+c(HC2O )+c(HC2O ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】利用 氧化
氧化 回收单质硫,涉及反应如下:①
回收单质硫,涉及反应如下:①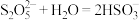 ;②
;②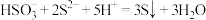 ,③
,③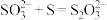 。25℃时,
。25℃时,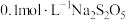 溶液中含硫微粒分布系数随pH变化如图1,
溶液中含硫微粒分布系数随pH变化如图1, 溶液的初始浓度为
溶液的初始浓度为 ,其初始pH与剩余硫化物及单质硫的含量关系如图2,下列说法不正确的是
,其初始pH与剩余硫化物及单质硫的含量关系如图2,下列说法不正确的是
 氧化
氧化 回收单质硫,涉及反应如下:①
回收单质硫,涉及反应如下:①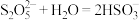 ;②
;②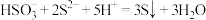 ,③
,③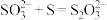 。25℃时,
。25℃时,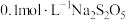 溶液中含硫微粒分布系数随pH变化如图1,
溶液中含硫微粒分布系数随pH变化如图1, 溶液的初始浓度为
溶液的初始浓度为 ,其初始pH与剩余硫化物及单质硫的含量关系如图2,下列说法不正确的是
,其初始pH与剩余硫化物及单质硫的含量关系如图2,下列说法不正确的是
A.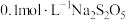 水溶液中 水溶液中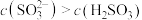 |
B.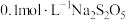 水溶液中 水溶液中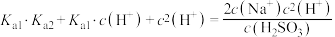 |
C.初始pH由6升至9, 的主要原因是发生反应③ 的主要原因是发生反应③ |
D.初始pH由6降至5,单质S减少的主要原因是部分 转化为 转化为 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃时,向 溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
 溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A.N点溶液可由等体积等浓度的 、 、 溶液混合而成 溶液混合而成 |
B.25℃时, 的一级电离 的一级电离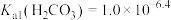 |
C.图中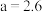 |
D.25℃时, 的 的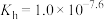 |
您最近一年使用:0次
单选题
|
较难
(0.4)
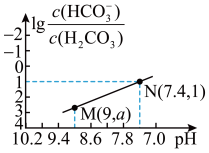
【推荐3】常温下,用 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中 和
和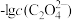 的关系如图所示,已知:
的关系如图所示,已知: 的电离平衡常数
的电离平衡常数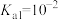 ,下列说法错误的是
,下列说法错误的是

 溶液滴定
溶液滴定 溶液,溶液中
溶液,溶液中 和
和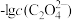 的关系如图所示,已知:
的关系如图所示,已知: 的电离平衡常数
的电离平衡常数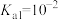 ,下列说法错误的是
,下列说法错误的是
A.常温下, 的电离平衡常数 的电离平衡常数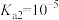 |
B. 溶液呈酸性 溶液呈酸性 |
C.滴定过程中,当 时, 时,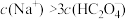 |
D.滴定过程中, 不变 不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】某同学进行如下实验:
 的电离平衡常数:
的电离平衡常数: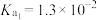 ,
,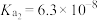 ;
;
 的电离平衡常数:
的电离平衡常数: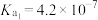 ,
,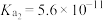 。
。
下列说法不正确的是

 的电离平衡常数:
的电离平衡常数: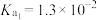 ,
,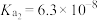 ;
; 的电离平衡常数:
的电离平衡常数: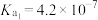 ,
,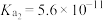 。
。下列说法不正确的是
A.饱和 溶液可以除去 溶液可以除去 中的 中的 |
B.依据 可推知,向 可推知,向 溶液中加入 溶液中加入 ,不能生成 ,不能生成 或 或 |
C.过程Ⅰ所得溶液中存在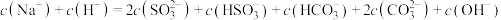 |
D.过程Ⅱ所得溶液中存在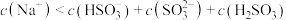 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,用 NaOH溶液滴定20.00mLHCl和
NaOH溶液滴定20.00mLHCl和 混合溶液,滴定过程中
混合溶液,滴定过程中 和
和 分布系数
分布系数 及pH随NaOH溶液体积变化如图。下列说法不正确的是
及pH随NaOH溶液体积变化如图。下列说法不正确的是
 NaOH溶液滴定20.00mLHCl和
NaOH溶液滴定20.00mLHCl和 混合溶液,滴定过程中
混合溶液,滴定过程中 和
和 分布系数
分布系数 及pH随NaOH溶液体积变化如图。下列说法不正确的是
及pH随NaOH溶液体积变化如图。下列说法不正确的是
A. |
B. 时, 时,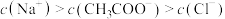 |
C.此混合酸液中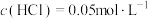 |
| D.已知指示剂甲基红变色范围4.4~6.2,可用它确定第一滴定终点 |
您最近一年使用:0次

 计测定浓度均为0.1
计测定浓度均为0.1 的
的 和
和 溶液的
溶液的 和
和 的
的 的大小
的大小 溶液和
溶液和 溶液,观察产生气泡的速率
溶液,观察产生气泡的速率 和
和 催化能力强弱
催化能力强弱 气体,达平衡后压缩容器体积为原来的一半,观察气体颜色变化
气体,达平衡后压缩容器体积为原来的一半,观察气体颜色变化 溶液的
溶液的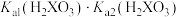 与
与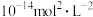 的大小
的大小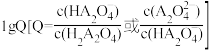 随溶液pH的变化关系如图所示,下列说法正确的是
随溶液pH的变化关系如图所示,下列说法正确的是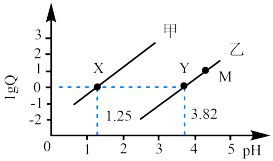
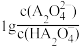 随溶液pH的变化关系
随溶液pH的变化关系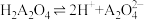 的平衡常数K=10-5.07
的平衡常数K=10-5.07 )>c(OH-)>c(HA2O
)>c(OH-)>c(HA2O )
)

