氮氧化物是形成酸雨和光化学烟雾的主要物质之一。研究消除氮氧化物的反应机理,对建设生态文明、美丽中国具有重要意义。回答下列问题:
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g) △H。
CO2(g)+2H2O(g)+N2(g) △H。
①已知:CH4的燃烧热△H1=-890.3kJ•mol-1
N2(g)+2O2(g)=2NO2(g) △H2=+133kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则△H=________ kJ•mol-1。
②在3.0L恒温密闭容器中通入1molCH4和2molNO2,进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
则0~4min用NO2表示该反应的平均速率v(NO2)=________ mol/(L•min),该温度下的平衡常数Kp=_________ kPa。
(2)N2O曾用作麻醉剂,其分解的方程式为2N2O(g) 2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
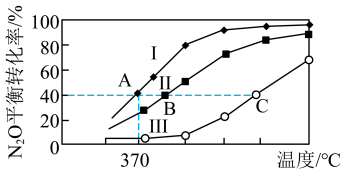
①若容器IV保持370℃,则起始反应速率v正(N2O)_______ 2v逆(O2)(填“>”“<”或“=”)。
②A、B、C三点中压强最大的是_______ 。
③碘蒸气的存在能大幅度提高N2O的分解速率,反应历程如下:
第一步I2(g) 2I(g)(快速平衡,平衡常数为K)
2I(g)(快速平衡,平衡常数为K)
第二步I(g)+N2O(g) N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步2IO(g)+2N2O(g) 2N2(g)+2O2(g)+I2(g)(快反应)
2N2(g)+2O2(g)+I2(g)(快反应)
则第二步的活化能________ (填“>”“<”或“=”)第三步的活化能。
实验表明,碘蒸气存在时N2O分解速率方程v=k•c(N2O)•c0.5(I2)(k为速率常数),已知第二步反应不影响第一步的平衡,其反应速率方程v=k1•c(N2O)•c(I)(k1为速率常数)。则第一步反应的平衡常数K=________ (用k和k1表示)。
(1)NO2是工业合成硝酸的中间产物,也是一种主要的大气污染物,工业可采用CH4消除NO2污染,主要原理为CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2(g) △H。
CO2(g)+2H2O(g)+N2(g) △H。①已知:CH4的燃烧热△H1=-890.3kJ•mol-1
N2(g)+2O2(g)=2NO2(g) △H2=+133kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则△H=
②在3.0L恒温密闭容器中通入1molCH4和2molNO2,进行上述反应,容器内气体总压强(p)随反应时间(t)变化的数据如表所示:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/×100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
(2)N2O曾用作麻醉剂,其分解的方程式为2N2O(g)
 2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
2N2(g)+O2(g),分别向四个密闭容器中充入如表所示相应气体,进行上述反应。容器I、II、III中N2O的平衡转化率随温度变化的曲线如图所示:
| 容器 | 物质的量/mol | |||
| 编号 | 体积/L | N2O | N2 | O2 |
| I | V1=1.0 | 0.1 | 0 | 0 |
| II | V2 | 0.1 | 0 | 0 |
| III | V3 | 0.1 | 0 | 0 |
| IV | V4=1.0 | 0.06 | 0.04 | 0.04 |
②A、B、C三点中压强最大的是
③碘蒸气的存在能大幅度提高N2O的分解速率,反应历程如下:
第一步I2(g)
 2I(g)(快速平衡,平衡常数为K)
2I(g)(快速平衡,平衡常数为K)第二步I(g)+N2O(g)
 N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)第三步2IO(g)+2N2O(g)
 2N2(g)+2O2(g)+I2(g)(快反应)
2N2(g)+2O2(g)+I2(g)(快反应)则第二步的活化能
实验表明,碘蒸气存在时N2O分解速率方程v=k•c(N2O)•c0.5(I2)(k为速率常数),已知第二步反应不影响第一步的平衡,其反应速率方程v=k1•c(N2O)•c(I)(k1为速率常数)。则第一步反应的平衡常数K=
更新时间:2023-09-14 07:52:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ、已知下面在298K时的热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH=-890.3 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是___ 。
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___ 。
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:___ 。
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
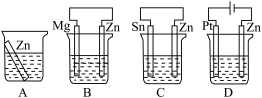
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是___ 。
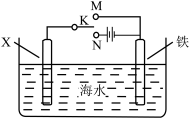
(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于___ 处。若X为锌,开关K置于M处,该电化学防护法称为___ 。
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是

(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】热力学标准态(298 K、101 kPa)下,由稳定单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。图甲为ⅥA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
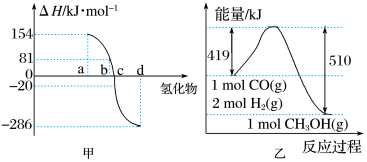
(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:________________________________________________________________________ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为______________________________ 。
(2)在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________ 。
(3)根据图乙写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:___________________________ 。
(4)由金红石(TiO2)制取单质Ti的步骤为:
TiO2―→TiCl4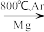 Ti
Ti
已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=________________ 。
(5)肼(N2H4)可作为火箭发动机的燃料,肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)===N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
试计算1 mol N2H4(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为__________ ,写出N2H4(l)和N2O4(l)反应的热化学方程式:______________________________________ 。
(6)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、N—N为154,则断裂1 mol N—H键所需的能量是______ kJ。


(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:
②硒化氢在上述条件下发生分解反应的热化学方程式为
(2)在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是
(3)根据图乙写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:
(4)由金红石(TiO2)制取单质Ti的步骤为:
TiO2―→TiCl4
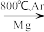 Ti
Ti已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=
(5)肼(N2H4)可作为火箭发动机的燃料,肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)===N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
试计算1 mol N2H4(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为
(6)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、N—N为154,则断裂1 mol N—H键所需的能量是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
由此计算ΔH2=____ kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____ kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为470K时,图中P点____ (填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随温度升高而增大,490K之后,甲醇产率随温度升高而减小的原因分别是____ 。
②一定能提高甲醇产率的措施是____ 。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
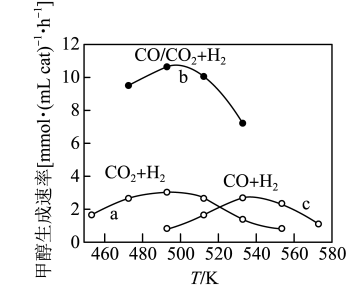
①490K时,根据曲线a、c判断合成甲醇的反应机理是____ (填“I”或“II”)。
Ⅰ.CO2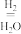 CO
CO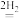 CH3OH II.CO
CH3OH II.CO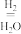 CO2
CO2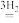 CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因____ 。
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2③CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
| 化学键 | H-H | C=O | C≡O | H-O |
| E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为470K时,图中P点
②一定能提高甲醇产率的措施是
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。

①490K时,根据曲线a、c判断合成甲醇的反应机理是
Ⅰ.CO2
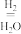 CO
CO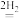 CH3OH II.CO
CH3OH II.CO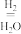 CO2
CO2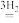 CH3OH+H2O
CH3OH+H2O②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO2和液态水时放出56kJ热量,则该条件下反应的热化学反应方程式为_______ 。
(2)将等物质的量的A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后测得D的浓度为0.5mol/L,c(A):c(B)=3∶5,C的平均反应速率是0.1mol·L-1·min-1。
①反应开始前充入容器中的B的物质的量为_______ 。
②B的平均反应速率为_______ 。
③A的转化率是_______
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:

①电解质溶液中OH-离子向_______ 移动(填“电极a”或 “电极b”)。
②电极a的电极反应式_______ 。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO2和液态水时放出56kJ热量,则该条件下反应的热化学反应方程式为
(2)将等物质的量的A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后测得D的浓度为0.5mol/L,c(A):c(B)=3∶5,C的平均反应速率是0.1mol·L-1·min-1。
①反应开始前充入容器中的B的物质的量为
②B的平均反应速率为
③A的转化率是
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图所示:

①电解质溶液中OH-离子向
②电极a的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】丙烯是工业上合成精细化学品的原料,随着天然气和页岩气的可用性不断提高,制取丙烯的技术受到人们越来越多的关注。
(1)主反应I :C3H8(g) C3 H6(g)+H2(g) △H1
C3 H6(g)+H2(g) △H1
副反应Ⅱ :C3H8(g) C2H4(g)+CH4(g) △H2
C2H4(g)+CH4(g) △H2
已知H2、丙烷(C3H8 )和丙烯(C3 H6)的燃烧热(△H)分别是-285.8 kJ·mol-1、-2220 kJ·mol-1和-2051 kJ·mol-1,则△H1=_______ kJ·mol-1。主反应I在_______ (填“高温”、“低温”或“任意温度”)时能自发进行。
(2)一定温度下,向总压恒定为p kPa的容器中充入一定量C3H8气体,在催化作用下,发生上述反应制备C3H6。
①下列情况表明反应达到平衡状态的是_______ (填标号)。
A.气体密度不再改变
B.体系压强不再改变
C.混合气体的平均摩尔质量不再改变
D.单位时间内消耗C3H8的物质的量与生成C3 H6的物质的量相等
②从平衡移动的角度判断,达到平衡后通入N2的作用是_______ 。
(3)在温度为T时,向起始压强为120 kPa的恒压容器中通入4 mol C3H8和6 mol N2发生反应,经10 min反应达到平衡,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图所示。该条件下,C3H8的选择性为80%,则0~ 10 min内生成C3 H6的平均速率为_______ kPa·min-1;反应I的平衡常数 Kp=_______ kPa(以分压表示,分压=总压X物质的量分数,保留一位小数)。

(1)主反应I :C3H8(g)
 C3 H6(g)+H2(g) △H1
C3 H6(g)+H2(g) △H1副反应Ⅱ :C3H8(g)
 C2H4(g)+CH4(g) △H2
C2H4(g)+CH4(g) △H2已知H2、丙烷(C3H8 )和丙烯(C3 H6)的燃烧热(△H)分别是-285.8 kJ·mol-1、-2220 kJ·mol-1和-2051 kJ·mol-1,则△H1=
(2)一定温度下,向总压恒定为p kPa的容器中充入一定量C3H8气体,在催化作用下,发生上述反应制备C3H6。
①下列情况表明反应达到平衡状态的是
A.气体密度不再改变
B.体系压强不再改变
C.混合气体的平均摩尔质量不再改变
D.单位时间内消耗C3H8的物质的量与生成C3 H6的物质的量相等
②从平衡移动的角度判断,达到平衡后通入N2的作用是
(3)在温度为T时,向起始压强为120 kPa的恒压容器中通入4 mol C3H8和6 mol N2发生反应,经10 min反应达到平衡,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图所示。该条件下,C3H8的选择性为80%,则0~ 10 min内生成C3 H6的平均速率为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】T℃时,在容积为2L密闭容器中,A气体与B气体反应生成C气体,反应过程中A、B、C的变化如图1所示。
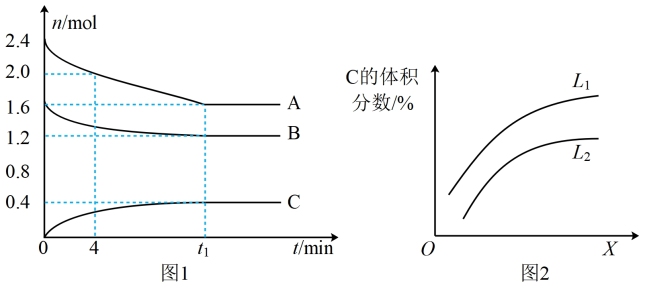
(1)写出反应的化学方程式___________ 。
(2)0﹣4min时,A的平均反应速率为___________ 。
(3)已知K(300℃)>K(350℃),该反应是___________ (填“吸热”或“放热”)反应。
(4)T℃时,反应的平衡常数为___________ (用分数表示)。
(5)达平衡时B的转化率为___________ 。
(6)如图2是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度和压强,其中X代表的是___________ (填“温度”或“压强”)。判断(L1___________ L2)(填“>”或“<”),理由是___________ 。

(1)写出反应的化学方程式
(2)0﹣4min时,A的平均反应速率为
(3)已知K(300℃)>K(350℃),该反应是
(4)T℃时,反应的平衡常数为
(5)达平衡时B的转化率为
(6)如图2是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度和压强,其中X代表的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】环境监测显示,某城市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______ ;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______ (填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时间内NO排放最越大,原因是______________ 。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
①电极A的电极反应式为________________ ;电极B的电极反应式为_____________ 。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________ 。
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g)
 2NO(g) △H>0
2NO(g) △H>0①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=
②汽车启动后,汽缸内温度越高,单位时间内NO排放最越大,原因是
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】以CO和CO2为原料合成有机物,是当前化学领域研究的热点。回答下列问题:
(1)CO和H2在催化剂作用下发生反应制备甲醇:CO(g)+2H2(g) CH3OH(g),某温度下在一恒压容器中分别充入1.2molCO和1molH2,达平衡时容器体积为2L,且含有0.4molCH3OH(g),反应的平衡常数K=
CH3OH(g),某温度下在一恒压容器中分别充入1.2molCO和1molH2,达平衡时容器体积为2L,且含有0.4molCH3OH(g),反应的平衡常数K=_____ ;此时若向容器中再通入0.35mol甲醇气体容器体积变为_____ L,平衡将_____ (填“正向”“不”“逆向”)移动。
(2)将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H<0。实验测得:v正=k正•c(CO2)•c(H2),v逆=k逆•c(HCOOH),k正、k逆为速率常数(只与温度有关),则该反应的化学平衡常数K=
HCOOH(g) △H<0。实验测得:v正=k正•c(CO2)•c(H2),v逆=k逆•c(HCOOH),k正、k逆为速率常数(只与温度有关),则该反应的化学平衡常数K=_____ (用k正、k逆表示)。温度为T1℃时,k正=2k逆,温度为T2℃时,k正=1.6k逆,则T1____ (填“>”“<”或“=”下同)T2;T2℃时平衡压强_____ T1℃时平衡压强,理由是:____ 。
(3)用如图装置电催化还原CO2制乙烯(X、Y均为新型惰性电极材料,可减少CO2和碱发生副反应),装置中b电极为____ (填“正”“负”“阴”“阳”)极,X极上的电极反应式为_____ 。

(1)CO和H2在催化剂作用下发生反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g),某温度下在一恒压容器中分别充入1.2molCO和1molH2,达平衡时容器体积为2L,且含有0.4molCH3OH(g),反应的平衡常数K=
CH3OH(g),某温度下在一恒压容器中分别充入1.2molCO和1molH2,达平衡时容器体积为2L,且含有0.4molCH3OH(g),反应的平衡常数K=(2)将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H<0。实验测得:v正=k正•c(CO2)•c(H2),v逆=k逆•c(HCOOH),k正、k逆为速率常数(只与温度有关),则该反应的化学平衡常数K=
HCOOH(g) △H<0。实验测得:v正=k正•c(CO2)•c(H2),v逆=k逆•c(HCOOH),k正、k逆为速率常数(只与温度有关),则该反应的化学平衡常数K=(3)用如图装置电催化还原CO2制乙烯(X、Y均为新型惰性电极材料,可减少CO2和碱发生副反应),装置中b电极为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】完成硫、氮化合物的相关问题
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的热化学方程式。_______ 。
已知:H2(g)+ O2(g)
O2(g) H2O(g) ∆H=-241.8 kJ∙mol-1
H2O(g) ∆H=-241.8 kJ∙mol-1
C(s)+ O2(g)
O2(g) CO(g) ∆H=-110.5 kJ∙mol-1
CO(g) ∆H=-110.5 kJ∙mol-1
②洗涤含SO2的烟气。以下物质可作洗涤剂的是_______ 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知:室温时,氢硫酸(H2S):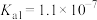 ,
,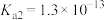 ;
;
亚硫酸(H2SO3):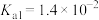 ,
,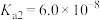 。
。
①H2S是有毒气体,可用Na2CO3溶液吸收,生成两种酸式盐。写出反应的离子方程式_______ 。
②向饱和H2S溶液中通入过量的SO2气体。下列关系图正确的是_______ 。
a.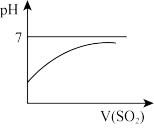 b.
b. 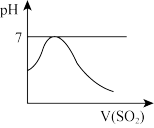
c.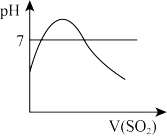 d.
d. 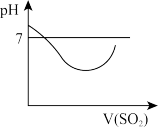
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是:
2NO(g) △H>0。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是:_______ 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的△H>0,简述该设想能否实现的依据:_______ 。
③在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______ 。
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的热化学方程式。
已知:H2(g)+
 O2(g)
O2(g) H2O(g) ∆H=-241.8 kJ∙mol-1
H2O(g) ∆H=-241.8 kJ∙mol-1C(s)+
 O2(g)
O2(g) CO(g) ∆H=-110.5 kJ∙mol-1
CO(g) ∆H=-110.5 kJ∙mol-1②洗涤含SO2的烟气。以下物质可作洗涤剂的是
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知:室温时,氢硫酸(H2S):
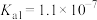 ,
,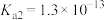 ;
;亚硫酸(H2SO3):
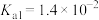 ,
,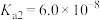 。
。①H2S是有毒气体,可用Na2CO3溶液吸收,生成两种酸式盐。写出反应的离子方程式
②向饱和H2S溶液中通入过量的SO2气体。下列关系图正确的是
a.
 b.
b. 
c.
 d.
d. 
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g) △H>0。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是:
2NO(g) △H>0。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是:②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的△H>0,简述该设想能否实现的依据:
③在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)利用水煤气合成二甲醚的反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol
CH3OH(g) ΔH=-90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.3kJ/mol
CO2(g)+H2(g) ΔH=-41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=____ kJ/mol;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____ (多选)。
a.升温加压 b.加入催化剂 c.增加H2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:
①比较此时正逆反应速率的大小:v正___ v逆(填“>”“<”或“=”)。
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=____ mol/L;该时间内反应速率v(CH3OH)=____ mol(L·min)。
(3)汽车尾气中NOx和CO的生成及转化为:已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0。
2NO(g) ΔH>0。
①若1mol空气含有0.8molN2和0.2molO2,1300°C时在密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K=____ ;汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是____ 。
②汽车燃油不完全燃烧时产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的ΔH>0,判断该设想能否实现并说明依据:____ 。
(1)利用水煤气合成二甲醚的反应如下:
①2H2(g)+CO(g)
 CH3OH(g) ΔH=-90.8kJ/mol
CH3OH(g) ΔH=-90.8kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.3kJ/mol
CO2(g)+H2(g) ΔH=-41.3kJ/mol总反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=a.升温加压 b.加入催化剂 c.增加H2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表:| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=
(3)汽车尾气中NOx和CO的生成及转化为:已知汽缸中生成NO的反应为N2(g)+O2(g)
 2NO(g) ΔH>0。
2NO(g) ΔH>0。①若1mol空气含有0.8molN2和0.2molO2,1300°C时在密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K=
②汽车燃油不完全燃烧时产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的ΔH>0,判断该设想能否实现并说明依据:
您最近一年使用:0次
【推荐2】苯是一种重要的工业原料,可利用环己烷脱氢制取。环己烷脱氢制苯的反成过程如下:
①
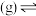

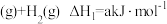
②
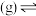

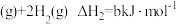
③
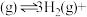

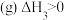
回答下列问题:
(1)反应③的
_______  (用a、b表示)。
(用a、b表示)。
(2)不同压强和温度下反应③的平衡转化率如图1所示。

图1
①在相同压强下升高温度,未达到新平衡前,
_______  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
②研究表明,既升高温度又增大压强, 的平衡转化率也升高,理由可能是
的平衡转化率也升高,理由可能是_______ 。
(3)t℃向2L的密闭反应器中充入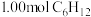 进行催化脱氢,测得
进行催化脱氢,测得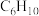 和
和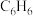 的产率
的产率 和
和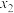 (以物质的量分数计)随时间的变化关系如图2所示。
(以物质的量分数计)随时间的变化关系如图2所示。

图2
①在8min时,反应体系内氢气的物质的量为_______ mol(忽略其他副反应):反应③的平衡常数K=_______ (只代入数据即可,不需要计算结果)。
② 显著低于
显著低于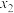 的原因是
的原因是_______ 。
①

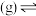

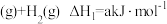
②

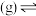

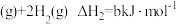
③

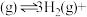

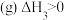
回答下列问题:
(1)反应③的

 (用a、b表示)。
(用a、b表示)。(2)不同压强和温度下反应③的平衡转化率如图1所示。

图1
①在相同压强下升高温度,未达到新平衡前,

 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。②研究表明,既升高温度又增大压强,
 的平衡转化率也升高,理由可能是
的平衡转化率也升高,理由可能是(3)t℃向2L的密闭反应器中充入
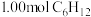 进行催化脱氢,测得
进行催化脱氢,测得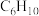 和
和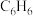 的产率
的产率 和
和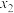 (以物质的量分数计)随时间的变化关系如图2所示。
(以物质的量分数计)随时间的变化关系如图2所示。
图2
①在8min时,反应体系内氢气的物质的量为
②
 显著低于
显著低于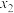 的原因是
的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是_______ (填“Ⅰ”或“Ⅱ”)。
②表中所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1_______ 0(填“>”“=”或“<”)。
③在250℃时,将1 mol CO、2 mol H2和5 mol CH3OH充入容积为1 L的密闭容器中,此时反应Ⅰ将_______ 。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断
④某温度下,将2 mol CO和6mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为_______ ,此时的温度为_______ (从所给表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g)ΔH=-566.0 kJ·mol-1;
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1。
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是
②表中所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度/℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1
③在250℃时,将1 mol CO、2 mol H2和5 mol CH3OH充入容积为1 L的密闭容器中,此时反应Ⅰ将
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断
④某温度下,将2 mol CO和6mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g)ΔH=-566.0 kJ·mol-1;
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1。
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
您最近一年使用:0次



