水溶液中的离子反应与平衡在生产和生活中有广泛的用途、回答下列问题:
(1)相同条件下, 的氨水和
的氨水和 的氢氧化钠溶液,水的电离程度
的氢氧化钠溶液,水的电离程度___________ (填“相同”或“不同”),向氨水中滴加同浓度的 溶液,滴加过程中
溶液,滴加过程中
___________ (填“增大”“减小”或“不变”)。
(2)某同学在两个相同的特制容器中分别加入 溶液和
溶液和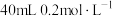
 溶液,再分别用
溶液,再分别用 的盐酸滴定。利用
的盐酸滴定。利用 计和压强传感器检测,得到如图变化曲线。
计和压强传感器检测,得到如图变化曲线。
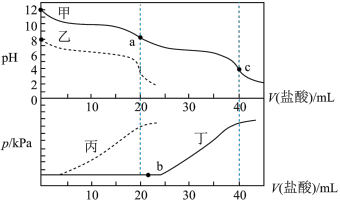
下列说法正确的是___________(填字母)。
(3)在25℃下。将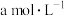 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液。中
的盐酸等体积混合,反应平衡时溶液。中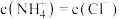 ,则溶液显
,则溶液显___________ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离常数
的电离常数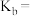
___________
(4)在一定温度下,用 溶液将
溶液将 转化为
转化为 溶液,实验测得
溶液,实验测得 溶液中
溶液中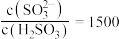 ,则该溶液的
,则该溶液的 为
为___________ (已知:该温度下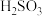 的
的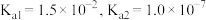 )。
)。
(5)关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
①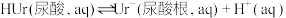 ;
;
② 。
。
37℃时某人尿液试样中: ,其中
,其中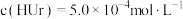 (37℃时,
(37℃时,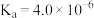 ),则该尿液试样中
),则该尿液试样中 为
为___________ (结果保留两位有效数字)。
(1)相同条件下,
 的氨水和
的氨水和 的氢氧化钠溶液,水的电离程度
的氢氧化钠溶液,水的电离程度 溶液,滴加过程中
溶液,滴加过程中
(2)某同学在两个相同的特制容器中分别加入
 溶液和
溶液和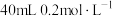
 溶液,再分别用
溶液,再分别用 的盐酸滴定。利用
的盐酸滴定。利用 计和压强传感器检测,得到如图变化曲线。
计和压强传感器检测,得到如图变化曲线。
下列说法正确的是___________(填字母)。
A. 溶液和 溶液和 溶液中微粒种类相同 溶液中微粒种类相同 |
B.图中曲线甲和丁表示向 溶液中滴加盐酸 溶液中滴加盐酸 |
C.在b点发生反应的离子方程式为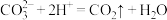 |
| D.滴定分析时,a点可用酚酞、c点可用甲基橙作指示剂指示滴定终点 |
(3)在25℃下。将
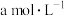 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液。中
的盐酸等体积混合,反应平衡时溶液。中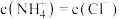 ,则溶液显
,则溶液显 的电离常数
的电离常数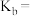
(4)在一定温度下,用
 溶液将
溶液将 转化为
转化为 溶液,实验测得
溶液,实验测得 溶液中
溶液中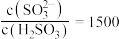 ,则该溶液的
,则该溶液的 为
为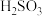 的
的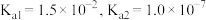 )。
)。(5)关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
①
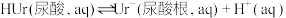 ;
;②
 。
。37℃时某人尿液试样中:
 ,其中
,其中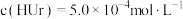 (37℃时,
(37℃时,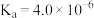 ),则该尿液试样中
),则该尿液试样中 为
为
更新时间:2023-11-29 01:31:02
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
(2)磷的一种化合物叫亚磷酸(H3PO3)。已知:
Ⅰ.0.1mol/LH3PO3溶液的pH=1.7;
Ⅱ.H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ.H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
①关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是___________ 。
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
②写出H3PO3与过量NaOH溶液反应的离子方程式___________ 。
(3)H3PO2(次磷酸)是一元中强酸,H3PO2及NaH2PO2均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。
①NaH2PO2属于___________ (填“正盐”“酸式盐”或“碱式盐”)。
②利用H3PO2化学镀银,反应中氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为___________ (写化学式)。
(1)下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
| A | B | C | D |
| 配制FeCl3溶液制备 | Fe(OH)3胶体 | 观察胶体的丁达尔效应 | 分离Fe(OH)3胶体与溶液 |
 |  |  | 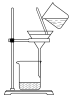 |
| A.A | B.B | C.C | D.D |
Ⅰ.0.1mol/LH3PO3溶液的pH=1.7;
Ⅱ.H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ.H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
①关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
②写出H3PO3与过量NaOH溶液反应的离子方程式
(3)H3PO2(次磷酸)是一元中强酸,H3PO2及NaH2PO2均可将溶液中的
 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。①NaH2PO2属于
②利用H3PO2化学镀银,反应中氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:________ 。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1NaOH溶液混合而成,则溶液M的pH______ (填“>”“<”或“=”)7,溶液中离子浓度由大到小的顺序为_______ ;
(3)若有三种溶液:①0.01 mol·L-1的H2A溶液、②0.01 mol·L-1的NaHA溶液、③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种溶液中c(H2A)最大的是______ ;pH由大到小的顺序为_______ 。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中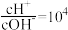 ,V1与V2的大小关系为
,V1与V2的大小关系为______ (填“V1>V2”“V1=V2”“V1<V2”或“均有可能”)。
(1)写出酸H2A的电离方程式:
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1NaOH溶液混合而成,则溶液M的pH
(3)若有三种溶液:①0.01 mol·L-1的H2A溶液、②0.01 mol·L-1的NaHA溶液、③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种溶液中c(H2A)最大的是
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中
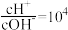 ,V1与V2的大小关系为
,V1与V2的大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系。若25 ℃时有HA  H++A-,则K=
H++A-,则K= ,式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。
,式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________ (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,且K值越大酸性越_________ ;某酸的K=6.4×10-6,则0.1 mol/L的上述各酸的H+离子浓度比该酸大的有________ (填名称)。
(3)若把CH3COOH、H2CO3、 、H2S、HS-、H3PO4、
、H2S、HS-、H3PO4、 、
、 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是_________ ,最弱的是_________ 。
 H++A-,则K=
H++A-,则K= ,式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。
,式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3 H++HCO H++HCOHCO   H++CO H++CO | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4 H++H2PO H++H2PO H2PO   H++HPO H++HPO HPO   H++PO H++PO | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值
(2)在温度相同时,各弱酸的K值不同,且K值越大酸性越
(3)若把CH3COOH、H2CO3、
 、H2S、HS-、H3PO4、
、H2S、HS-、H3PO4、 、
、 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列问题。
(1)NH4Cl溶液呈________ (填“酸”、“中”、“碱”)性,其原因是(用离子方程式表示) ________ 。
(2)在25℃下,向浓度均为0.1mol•L﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______ 沉淀(填化学式)。{已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11,Ksp[Cu(OH)2]=2.2×10﹣20}
(3)在25℃下,将amol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl﹣),则溶液显_____ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=______ 。
(1)NH4Cl溶液呈
(2)在25℃下,向浓度均为0.1mol•L﹣1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(3)在25℃下,将amol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl﹣),则溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】利用所学化学反应原理,解决以下问题:
(1)一定温度下,将一定质量 的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,请回答下列问题:

①写出冰醋酸电离方程式____________
②加水过程中,其水溶液导电能力变化的原因是:_______________________________________
③a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:__________ (填“相同”、“a点大”、“b点大”、“c点大”)
(2)常温下,将0.2 mol·L-1的CH3COOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH=5(溶液体积变化忽略不计),则该溶液中:
c(CH3COO−) + c(CH3COOH)=_______ mol/L
c(H+) - c(CH3COO−)+ c(Na+) =_______ mol/L
(3)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________ (用离子方程式表示)
(4)在0.10 mol·L-1 Na2SO3溶液中,离子浓度由大到小的顺序为___________________________________ 。
(1)一定温度下,将

①写出冰醋酸电离方程式
②加水过程中,其水溶液导电能力变化的原因是:
③a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
(2)常温下,将0.2 mol·L-1的CH3COOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH=5(溶液体积变化忽略不计),则该溶液中:
c(CH3COO−) + c(CH3COOH)=
c(H+) - c(CH3COO−)+ c(Na+) =
(3)KAl(SO4)2·12H2O可做净水剂,其原理是
(4)在0.10 mol·L-1 Na2SO3溶液中,离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】类别万千的酸碱溶液共同构筑了化学世界的丰富多彩。
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/L NH3∙H2O (丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是_____ (填字母)。
A. B.
B. C.
C.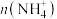 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙_____ 甲(填“>”“<”或“=”)。
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度_____ 25℃。(填“>”“<”或“=”)
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为_____ 。
③某温度下,测得0.001mol/L的HCl溶液中水电离出的c(H+)=1×10-9mol∙L-1,将VaLpH=4HCl溶液和VbLpH=9的Ba(OH)2溶液混合均匀,测得溶液的pH=7,则Va:Vb=_____ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①将SO2通入氨水中,当c(OH-)降至1.0×10-7mol∙L-1时,溶液中的 =
=_____ 。
②下列微粒在溶液中不能大量共存的是_____ 。
A. 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/L NH3∙H2O (丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是
A.
 B.
B. C.
C.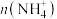 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为
 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为③某温度下,测得0.001mol/L的HCl溶液中水电离出的c(H+)=1×10-9mol∙L-1,将VaLpH=4HCl溶液和VbLpH=9的Ba(OH)2溶液混合均匀,测得溶液的pH=7,则Va:Vb=
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | H2SO3 | H2CO3 | HClO | NH3∙H2O |
| 电离平衡常数 | 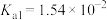  |   | 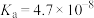 |  |
 =
=②下列微粒在溶液中不能大量共存的是
A.
 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题:
(1)已知室温时,0.1 mol∙L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=_______ mol∙L-1
②HA的电离平衡常数K=_______ 。
③由HA电离出的c(H+)约为水电离出的c(H+)的_______ 倍。
(2)部分弱酸的电离平衡常数如表:用“>”“<”或“=”填空。
①在相同浓度的HCOOH和HClO的溶液中,溶液导电能力:HCOOH_______ HClO。
② 的电离平衡常数表达式为
的电离平衡常数表达式为_______
③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式_______ 。
(1)已知室温时,0.1 mol∙L-1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=
②HA的电离平衡常数K=
③由HA电离出的c(H+)约为水电离出的c(H+)的
(2)部分弱酸的电离平衡常数如表:用“>”“<”或“=”填空。
| 弱酸 | HCOOH | H2CO3 | HClO |
| 电离平衡常数/25 ℃ | K=1.77×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
②
 的电离平衡常数表达式为
的电离平衡常数表达式为③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】我国硒含量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸(H2SeO3)和硒酸(H2SeO4),进而制备单质硒。
(1)硒酸(H2SeO4)在水溶液中的电离方程式如下:
H2SeO4=H++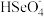 ,
,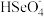
 H++
H++ 。
。
①写出NaHSeO4在水溶液中的电离方程式:_____________ 。
②常温下,H2SeO4溶液与少量Na2CO3(H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)溶液反应的离子方程式:________________ 。
(2)采用氧化还原法测定未知浓度的亚硒酸钠溶液的含量,量取10.00mL试样置于碘量瓶中,加入适量的稀硫酸溶液和过量的c1mol/L的KI溶液和适量二硫化碳,摇匀后再静置5min。加入淀粉作为指示剂,再用c2mol/L的标准Na2S2O3进行滴定,边滴定边振荡,到达滴定终点,三次实验平均消耗了VmLNa2S2O3,涉及以下两个反应: +6H++4I-=Se+2I2+3H2O;2
+6H++4I-=Se+2I2+3H2O;2 +I2=2I-+
+I2=2I-+ 。已知:硒为红色粉末,且易溶于二硫化碳,碘也溶于二硫化碳,水和二硫化碳互不相溶,且密度CS2>H2O。请回答:
。已知:硒为红色粉末,且易溶于二硫化碳,碘也溶于二硫化碳,水和二硫化碳互不相溶,且密度CS2>H2O。请回答:
①滴定终点的现象为___________ 。
②加入适量的二硫化碳的原因是____________ 。
③下列关于滴定操作使滴定结果偏高的是__________ (填字母)。
A.装标准液的滴定管水洗后未用标准液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定时,滴定管尖嘴部分有气泡,滴定后消失
D.装标准Na2S2O3的滴定管观察读数时,滴定前仰视,滴定后俯视
E.用滴定管量取亚硒酸钠时先仰视后俯视
④亚硒酸钠浓度为__________ mol/L(列出表达式)。
(1)硒酸(H2SeO4)在水溶液中的电离方程式如下:
H2SeO4=H++
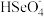 ,
,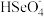
 H++
H++ 。
。①写出NaHSeO4在水溶液中的电离方程式:
②常温下,H2SeO4溶液与少量Na2CO3(H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)溶液反应的离子方程式:
(2)采用氧化还原法测定未知浓度的亚硒酸钠溶液的含量,量取10.00mL试样置于碘量瓶中,加入适量的稀硫酸溶液和过量的c1mol/L的KI溶液和适量二硫化碳,摇匀后再静置5min。加入淀粉作为指示剂,再用c2mol/L的标准Na2S2O3进行滴定,边滴定边振荡,到达滴定终点,三次实验平均消耗了VmLNa2S2O3,涉及以下两个反应:
 +6H++4I-=Se+2I2+3H2O;2
+6H++4I-=Se+2I2+3H2O;2 +I2=2I-+
+I2=2I-+ 。已知:硒为红色粉末,且易溶于二硫化碳,碘也溶于二硫化碳,水和二硫化碳互不相溶,且密度CS2>H2O。请回答:
。已知:硒为红色粉末,且易溶于二硫化碳,碘也溶于二硫化碳,水和二硫化碳互不相溶,且密度CS2>H2O。请回答:①滴定终点的现象为
②加入适量的二硫化碳的原因是
③下列关于滴定操作使滴定结果偏高的是
A.装标准液的滴定管水洗后未用标准液润洗
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定时,滴定管尖嘴部分有气泡,滴定后消失
D.装标准Na2S2O3的滴定管观察读数时,滴定前仰视,滴定后俯视
E.用滴定管量取亚硒酸钠时先仰视后俯视
④亚硒酸钠浓度为
您最近一年使用:0次

 =
=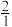 ,即n(Na+)=2c(CO
,即n(Na+)=2c(CO ),CO
),CO 、H2CO3,共三种含碳元素的存在形式。
、H2CO3,共三种含碳元素的存在形式。

