烟道气中含 、
、 、
、 等多种有害气体,合理治理烟道气中具有重要意义。
等多种有害气体,合理治理烟道气中具有重要意义。
Ⅰ.烟道气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:


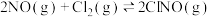

(1)则反应: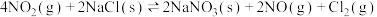

___________ (用含 、
、 的式子表示)。
的式子表示)。
Ⅱ.利用 可将
可将 转化为无害的
转化为无害的 ,其反应为:
,其反应为: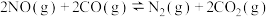 。在容积均为
。在容积均为 的甲、乙两个恒温(反应温度分别为℃、
的甲、乙两个恒温(反应温度分别为℃、 ℃)恒容密闭容器中,分别加入物质的量之比为
℃)恒容密闭容器中,分别加入物质的量之比为 的
的 和
和 ,测得各容器中
,测得各容器中 随反应时间
随反应时间 的变化情况如下表所示:
的变化情况如下表所示:
(2)
___________  ,该反应的
,该反应的
___________ 0。(填“>”或“<”)
(3) 时,该反应的平衡常数为
时,该反应的平衡常数为___________ ;若再加入 和
和 ,平衡向
,平衡向___________ (填“正反应方向”、“逆反应方向”或“不”)移动。
Ⅲ.对烟道气中的进行回收再利用具有较高的社会价值和经济价值,涉及到的主要反应是: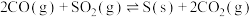
 。
。
(4)向三个体积相同的恒容密闭容器中通入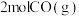 和
和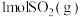 发生反应,反应体系的总压强随时间的变化如图所示。
发生反应,反应体系的总压强随时间的变化如图所示。
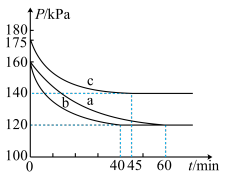
①实验 中,
中,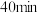 内
内 的平均反应速率为
的平均反应速率为___________ 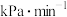 。
。
②与实验 相比,实验
相比,实验 改变的条件可能是
改变的条件可能是___________ 。
③实验 中
中 的平衡转化率为
的平衡转化率为___________ 。
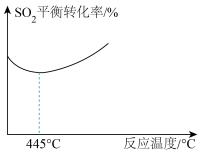
(5)其他条件不变时,随着温度的升高, 的平衡转化率随温度的变化曲线如图所示,温度高于445℃后
的平衡转化率随温度的变化曲线如图所示,温度高于445℃后 平衡转化率升高可能的原因
平衡转化率升高可能的原因___________ 。(已知硫的沸点约是445℃)
 、
、 、
、 等多种有害气体,合理治理烟道气中具有重要意义。
等多种有害气体,合理治理烟道气中具有重要意义。Ⅰ.烟道气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:


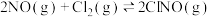

(1)则反应:
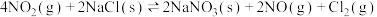

 、
、 的式子表示)。
的式子表示)。Ⅱ.利用
 可将
可将 转化为无害的
转化为无害的 ,其反应为:
,其反应为: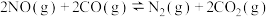 。在容积均为
。在容积均为 的甲、乙两个恒温(反应温度分别为℃、
的甲、乙两个恒温(反应温度分别为℃、 ℃)恒容密闭容器中,分别加入物质的量之比为
℃)恒容密闭容器中,分别加入物质的量之比为 的
的 和
和 ,测得各容器中
,测得各容器中 随反应时间
随反应时间 的变化情况如下表所示:
的变化情况如下表所示: 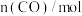 | 0 | 10 | 20 | 30 | 40 |
甲( ℃) ℃) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙( ℃) ℃) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
(2)

 ,该反应的
,该反应的
(3)
 时,该反应的平衡常数为
时,该反应的平衡常数为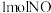 和
和 ,平衡向
,平衡向Ⅲ.对烟道气中的进行回收再利用具有较高的社会价值和经济价值,涉及到的主要反应是:
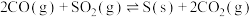
 。
。(4)向三个体积相同的恒容密闭容器中通入
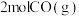 和
和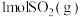 发生反应,反应体系的总压强随时间的变化如图所示。
发生反应,反应体系的总压强随时间的变化如图所示。
①实验
 中,
中,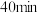 内
内 的平均反应速率为
的平均反应速率为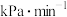 。
。②与实验
 相比,实验
相比,实验 改变的条件可能是
改变的条件可能是③实验
 中
中 的平衡转化率为
的平衡转化率为(5)其他条件不变时,随着温度的升高,
 的平衡转化率随温度的变化曲线如图所示,温度高于445℃后
的平衡转化率随温度的变化曲线如图所示,温度高于445℃后 平衡转化率升高可能的原因
平衡转化率升高可能的原因
更新时间:2023-12-27 15:13:56
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】环境是人类赖以生存的基础,当前人类使用的能源石油产品中含有多种硫化物,如H2 S、H2S、COS、CH3SH等,为了保护环境,石油加工的脱硫技术研究意义重大。
请回答下列问题:

(1)科学研究一种复合组分催化剂,能实现CH4把SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为 和
和 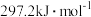 ,则CH4和SO2反应的热化学方程式为
,则CH4和SO2反应的热化学方程式为____________ 。
(2)一定条件下,焦炭可以还原SO2,其化学方程式为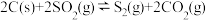 ,在恒容密闭容器中,
,在恒容密闭容器中,  与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
____________ 0(选填“>”或“<”);该反应自发进行的依据是 ____________ 。
(3)真空克劳斯法脱硫,可以用过量K2CO3溶液吸收少量H2S,其化学方程式为____________ ,该反应的平衡常数为 ____________ 。(已知H2CO3的 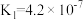 ,
,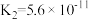 ;H2S的
;H2S的 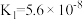 ,
,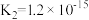 )
)
(4)COS的水解反应为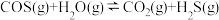
 。某温度时,用活性
。某温度时,用活性 作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比
作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比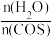 的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。
的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。
①起始向容器中投入一定量反应物,在一定条件下,可以判断反应到达平衡状态的是___________ (填字母)。
A.容器中气体密度不变时
B.压强保持不变时
C.容器中气体的平均相对分子质量保持不变时
D.
②若减小投料比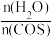 ,H2O的转化率
,H2O的转化率 ___________ (选填“增大”“减小”或“不变”)。
③请你分析该反应进行的温度不宜过高的可能原因是____________ 。
请回答下列问题:

(1)科学研究一种复合组分催化剂,能实现CH4把SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为
 和
和 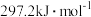 ,则CH4和SO2反应的热化学方程式为
,则CH4和SO2反应的热化学方程式为(2)一定条件下,焦炭可以还原SO2,其化学方程式为
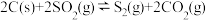 ,在恒容密闭容器中,
,在恒容密闭容器中,  与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
与足量的焦炭反应,SO2的转化率随温度变化曲线如图甲所示。则该反应的
(3)真空克劳斯法脱硫,可以用过量K2CO3溶液吸收少量H2S,其化学方程式为
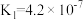 ,
,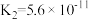 ;H2S的
;H2S的 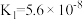 ,
,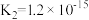 )
)(4)COS的水解反应为
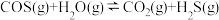
 。某温度时,用活性
。某温度时,用活性 作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比
作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比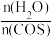 的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。
的转化关系如图乙所示。其他条件相同时,改变反应温度,测得一定时间内COS的转化率如图丙所示。①起始向容器中投入一定量反应物,在一定条件下,可以判断反应到达平衡状态的是
A.容器中气体密度不变时
B.压强保持不变时
C.容器中气体的平均相对分子质量保持不变时
D.

②若减小投料比
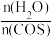 ,H2O的转化率
,H2O的转化率 ③请你分析该反应进行的温度不宜过高的可能原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g) 2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
①下列情况能说明该反应一定达到中平衡状态的是_____ (填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__ c2(填“>”“<”或“=”)。
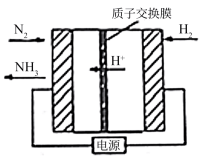
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________ 。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H=
2NO(g) △H=_____ kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择___ 填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________ 。520℃时,反应I的平衡常数K=____ (只列算式不计算)。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g)
 2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
| 平衡时c(NH3) | c1 | c2 |
| 平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是

(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol反应II:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol①该条件下,N2(g)+O2(g)
 2NO(g) △H=
2NO(g) △H=②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】回收利用含硫烟气有利于节约资源、保护环境。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1: ;
;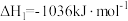
反应2: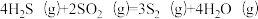 ;
;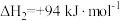
反应3: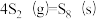 ;
;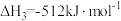
①反应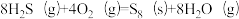 的△H=
的△H=_______ kJ∙mol-1。
②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是_______ 。
Ⅱ.含SO2的烟气回收
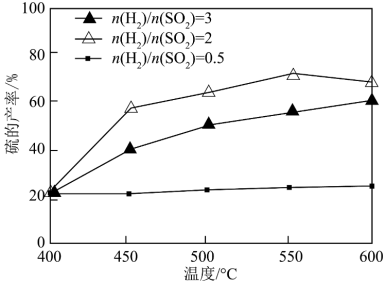
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是_______ 。
(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应: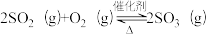 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是_______ (填字母序号)。
a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ: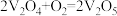 (慢反应)
(慢反应)
请补充上述反应的化学方程式_______ ,决定总反应速率快慢的是反应_______ (填“I”或“Ⅱ”)。
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液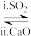 Na2SO3溶液
Na2SO3溶液
①写出过程i的离子方程式:_______ 。
②CaO在水中存在如下转化: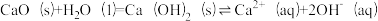
从平衡移动的角度,简述过程i中NaOH再生的原理:_______ 。
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的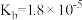 ,H2SO3的
,H2SO3的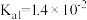 ,
,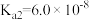 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=_______ mol∙L-1。将SO2通入该氨水中,当c(OH-)降至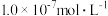 时,溶液中的
时,溶液中的
_______ 。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1:
 ;
;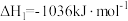
反应2:
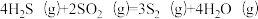 ;
;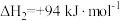
反应3:
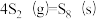 ;
;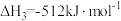
①反应
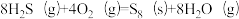 的△H=
的△H=②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是
Ⅱ.含SO2的烟气回收
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是

(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应:
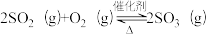 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ:
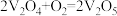 (慢反应)
(慢反应)请补充上述反应的化学方程式
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液
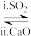 Na2SO3溶液
Na2SO3溶液①写出过程i的离子方程式:
②CaO在水中存在如下转化:
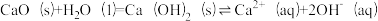
从平衡移动的角度,简述过程i中NaOH再生的原理:
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的
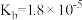 ,H2SO3的
,H2SO3的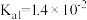 ,
,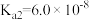 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=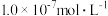 时,溶液中的
时,溶液中的
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】研究氮氧化物 (NOₓ)的还原处理方法是环保领域的主要方向之一。回答下列问题:
 .用H2还原NO的反应为
.用H2还原NO的反应为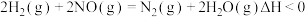

(1)该反应的正反应速率方程可表示为 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。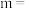
___________ ,
___________ 。
(2)研究表明上述反应历程分两步基元反应:
i. ;
;
ii.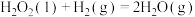 。
。
根据 (1)所给信息判断,H 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应___________ (填“ i”或“ii” ) 决定。
(3)将一定量的H 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是___________ 。
a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:
反应i. ;
;
反应ii. 。
。
反应过程中各物质相对能量如图 2 (TS表示过渡态): 的热化学方程式为
的热化学方程式为___________ 。
将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。___________ (填“高温”或者“低温”)。
(6)实验过程中,高于340℃后N O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是___________ 。
(7)450℃时, 该时间段内NO的脱除率=___________ (保留2位有效数字, NO的脱除率
 .用H2还原NO的反应为
.用H2还原NO的反应为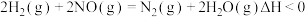

(1)该反应的正反应速率方程可表示为
 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。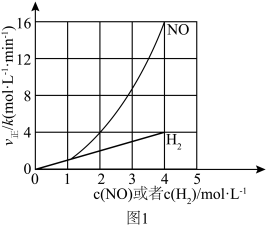
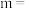

(2)研究表明上述反应历程分两步基元反应:
i.
 ;
;ii.
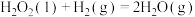 。
。根据 (1)所给信息判断,H
 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应(3)将一定量的H
 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:反应i.
 ;
;反应ii.
 。
。反应过程中各物质相对能量如图 2 (TS表示过渡态):
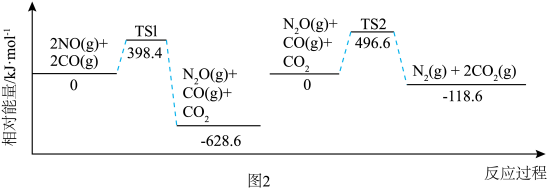
 的热化学方程式为
的热化学方程式为将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。
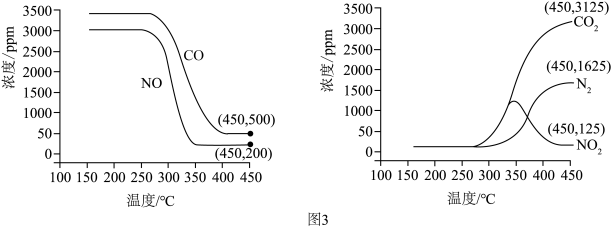
(6)实验过程中,高于340℃后N
 O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是(7)450℃时, 该时间段内NO的脱除率=

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】丙烯( )是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。另外,丙烯可制备1,2-二氯丙烷、丙烯醛等。回答下列问题:
)是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。另外,丙烯可制备1,2-二氯丙烷、丙烯醛等。回答下列问题:
Ⅰ.工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①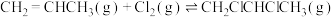
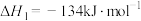
②
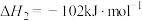
(1)一定温度下,向恒容密闭容器中充入等物质的量的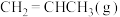 和
和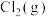 ,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
用单位时间内气体分压的变化来表示反应速率,即 ,则反应①在0~180min内平均反应速率
,则反应①在0~180min内平均反应速率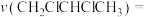
___________ 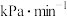 (精确至0.01)。
(精确至0.01)。
Ⅱ.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯:
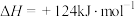 。
。
(2)①某温度下,在刚性容器中充入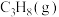 ,起始压强为10kPa,平衡时总压强为14kPa,
,起始压强为10kPa,平衡时总压强为14kPa,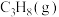 的平衡转化率为
的平衡转化率为___________ 。该反应的平衡常数
___________ kPa(精确至0.01)。
②总压分别为100kPa和10kPa时发生该反应,平衡体系中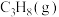 和
和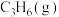 的物质的量分数随温度变化关系如图所示。
的物质的量分数随温度变化关系如图所示。

10kPa时,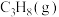 和
和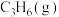 的物质的量分数随温度变化关系的曲线分别是
的物质的量分数随温度变化关系的曲线分别是___________ 、___________ 。
③高温下,丙烷生成丙烯的反应在初期阶段的速率方程为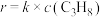 ,其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是
,其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是___________ (填字母)。
A.增加丙烷浓度,r增大 B.增加 浓度,r增大
浓度,r增大
C.丙烯的生成速率逐渐增大 D.降低反应温度,k减小
方法二:丙烷氧化脱氢法制备丙烯还生成CO、 等副产物,制备丙烯的反应:
等副产物,制备丙烯的反应:
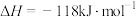 ,在催化剂的作用下的转化率和
,在催化剂的作用下的转化率和 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。

(3)①图中 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是___________ 。
②575℃时, 的选择性为
的选择性为___________ 。( 的选择性
的选择性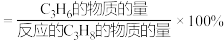 )
)
③基于上述研究结果,能提高 选择性的措施是
选择性的措施是___________ (写一条)。
 )是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。另外,丙烯可制备1,2-二氯丙烷、丙烯醛等。回答下列问题:
)是三大合成材料的基本原料之一,其用量最大的是生产聚丙烯。另外,丙烯可制备1,2-二氯丙烷、丙烯醛等。回答下列问题:Ⅰ.工业上用丙烯加成法制备1,2-二氯丙烷,主要副产物为3-氯丙烯,反应原理为:
①
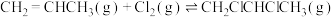
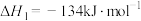
②

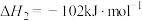
(1)一定温度下,向恒容密闭容器中充入等物质的量的
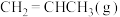 和
和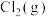 ,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
 ,则反应①在0~180min内平均反应速率
,则反应①在0~180min内平均反应速率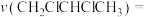
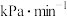 (精确至0.01)。
(精确至0.01)。Ⅱ.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯:

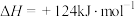 。
。(2)①某温度下,在刚性容器中充入
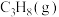 ,起始压强为10kPa,平衡时总压强为14kPa,
,起始压强为10kPa,平衡时总压强为14kPa,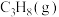 的平衡转化率为
的平衡转化率为
②总压分别为100kPa和10kPa时发生该反应,平衡体系中
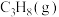 和
和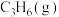 的物质的量分数随温度变化关系如图所示。
的物质的量分数随温度变化关系如图所示。
10kPa时,
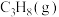 和
和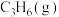 的物质的量分数随温度变化关系的曲线分别是
的物质的量分数随温度变化关系的曲线分别是③高温下,丙烷生成丙烯的反应在初期阶段的速率方程为
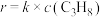 ,其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是
,其中k为反应速率常数。对于处于初期阶段的该反应,下列说法正确的是A.增加丙烷浓度,r增大 B.增加
 浓度,r增大
浓度,r增大C.丙烯的生成速率逐渐增大 D.降低反应温度,k减小
方法二:丙烷氧化脱氢法制备丙烯还生成CO、
 等副产物,制备丙烯的反应:
等副产物,制备丙烯的反应:
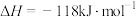 ,在催化剂的作用下的转化率和
,在催化剂的作用下的转化率和 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。
(3)①图中
 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是②575℃时,
 的选择性为
的选择性为 的选择性
的选择性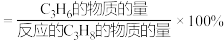 )
)③基于上述研究结果,能提高
 选择性的措施是
选择性的措施是
您最近一年使用:0次
【推荐3】碳的氧化物对环境的影响较大,研究和开发碳的氧化物的应用对发展低碳经济,构建生态文明社会具有重要的意义。
(1)已知:①甲醇的燃烧热ΔH=-726.4 kJ·mol-1;
②H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为_____________ 。
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与 的关系如图所示:
的关系如图所示:

①当起始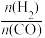 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______ 。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________ (填“增大”“减小”或“不变”)。
②当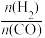 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的________ (填“D”“E”或“F”)点。
(3)已知由CO2生成CO的化学方程式为CO2(g)+O(g)⇌CO(g)+O2(g),其正反应速率为v正=k正·c(CO2)·c(O),逆反应速率为v逆=k逆·c(CO)·c(O2),k为速率常数。2500 K时,k逆=1.21×105L·s-1·mol-1,k正=3.02×105L·s-1·mol-1,则该温度下该反应的平衡常数K为________ 。(保留小数点后一位小数)
(4)CH3OH—O2在新型聚合物催化下可发生原电池反应,其装置如图:
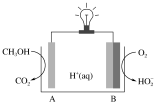
①外电路中每转移3mol电子,溶液中生成_______ molH+
②写出电极B的电极反应式:__________ 。
(1)已知:①甲醇的燃烧热ΔH=-726.4 kJ·mol-1;
②H2(g)+
 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与
 的关系如图所示:
的关系如图所示:
①当起始
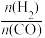 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=②当
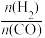 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的(3)已知由CO2生成CO的化学方程式为CO2(g)+O(g)⇌CO(g)+O2(g),其正反应速率为v正=k正·c(CO2)·c(O),逆反应速率为v逆=k逆·c(CO)·c(O2),k为速率常数。2500 K时,k逆=1.21×105L·s-1·mol-1,k正=3.02×105L·s-1·mol-1,则该温度下该反应的平衡常数K为
(4)CH3OH—O2在新型聚合物催化下可发生原电池反应,其装置如图:

①外电路中每转移3mol电子,溶液中生成
②写出电极B的电极反应式:
您最近一年使用:0次
【推荐1】(l)天然气和CO2通入聚焦太阳能反应器,发生反应CH4(g)+ CO2(g) 2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=
2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=_______________ (用含a、b、c的代数式表示)kJ/mol。
(2)CO2和H2可以合成二甲醚(CH3OCH3)。二甲醚是一种绿色环保型能源,以稀硫酸为电解质溶液,若某二甲醚空气燃料电池每消耗l mol CH3OCH3,电路中通过9 mol电子,则该电池效率η为___________ 。(提示:电池效率等于电路中通过的电子数与电池反应中转移电子总数之比)
(3)325K时,在恒容密闭容器中充入一定量NO2 ,发生反应:2NO2(g) N2 O4(g)。
N2 O4(g)。
①NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为:____________ ;
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
② 能够说明上述反应已经达到平衡状态的有__________________ ;
a.NO2和N2 O4的物质的量相等 b.体系颜色不再变化
c.容器内混合气体的密度不再改变 d.容器内气体压强不发生变化
③若达到平衡后容器内混合气体的平均相对分子质量为57.5。平衡时NO2的转化率为_____ 。
(4)实验中多余的SO2可以用氢氧化钠溶液吸收。常温下H2SO3的Ka1=1.3×10-2、Ka2=6.6×10-8。
①室温下pH=3的亚硫酸溶液,下列判断正确的是_______________ 。
a.溶液中c(H2SO3)>c(SO32—) b.溶液中c(SO32—):c(HSO3—)=6.6×10-5
c.溶液中氢离子数目为6.02×1020个 d.加入等体积pH=3的硫酸溶液,亚硫酸的电离平衡不移动
②常温下,用含1mol氢氧化钠的稀溶液吸收足量SO2气体,放出热量为QkJ,该反应的热化学方程式为_______
③若吸收液中c(HSO3—)=c(SO32—),则溶液中c(H+)=________________ 。
 2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=
2CO(g)+2H2(g) ΔH。已知:CH4、H2、CO的燃烧热ΔH分别为-akJ/mol、-bkJ/mol、-ckJ/mol。则上述反应中,ΔH=(2)CO2和H2可以合成二甲醚(CH3OCH3)。二甲醚是一种绿色环保型能源,以稀硫酸为电解质溶液,若某二甲醚空气燃料电池每消耗l mol CH3OCH3,电路中通过9 mol电子,则该电池效率η为
(3)325K时,在恒容密闭容器中充入一定量NO2 ,发生反应:2NO2(g)
 N2 O4(g)。
N2 O4(g)。①NO2与N2O4的消耗速率与其浓度的关系如图所示,图中交点A表示该反应所处的状态为:
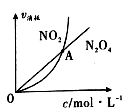
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
② 能够说明上述反应已经达到平衡状态的有
a.NO2和N2 O4的物质的量相等 b.体系颜色不再变化
c.容器内混合气体的密度不再改变 d.容器内气体压强不发生变化
③若达到平衡后容器内混合气体的平均相对分子质量为57.5。平衡时NO2的转化率为
(4)实验中多余的SO2可以用氢氧化钠溶液吸收。常温下H2SO3的Ka1=1.3×10-2、Ka2=6.6×10-8。
①室温下pH=3的亚硫酸溶液,下列判断正确的是
a.溶液中c(H2SO3)>c(SO32—) b.溶液中c(SO32—):c(HSO3—)=6.6×10-5
c.溶液中氢离子数目为6.02×1020个 d.加入等体积pH=3的硫酸溶液,亚硫酸的电离平衡不移动
②常温下,用含1mol氢氧化钠的稀溶液吸收足量SO2气体,放出热量为QkJ,该反应的热化学方程式为
③若吸收液中c(HSO3—)=c(SO32—),则溶液中c(H+)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氮的氧化物是主要的空气污染物,目前消除氯氧化物污染的方法有多种。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:________
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=___ mol,NO2的转化率a1=_________ .其它条件不变,反应在恒压条件下进行,平衡时NO2的转化率a2____ a1(填“大于” 小于”或“ 等于” )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据 是_________
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为_______ (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是________ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g) N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
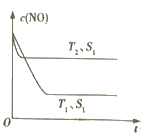
①该反应的ΔH____ 0(填“>”或“<”)。
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。____
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下| 时间 浓度(mol/L) 物质 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据 是
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的ΔH
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+ O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+ O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+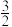 O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g) CH3OH(g)ΔH=
CH3OH(g)ΔH=___ 。
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____ 。
②X轴上b点的数值比a点___ (填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是___ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=___ ;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq) PbCl2(s)+2I-(aq)的平衡常数K=
PbCl2(s)+2I-(aq)的平衡常数K=___ 。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) 2HI(g)的ΔH
2HI(g)的ΔH__ (填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是___ 、___ (填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___ 。
 CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+
 O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol②H2(g)+
 O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol③CH3OH(g)+
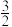 O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/molCO(g)+2H2(g)
 CH3OH(g)ΔH=
CH3OH(g)ΔH=(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上b点的数值比a点
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=
 PbCl2(s)+2I-(aq)的平衡常数K=
PbCl2(s)+2I-(aq)的平衡常数K=(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)
 2HI(g)的ΔH
2HI(g)的ΔH②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O
 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】用CO还原N2O,实现无害化处理是环境治理的一个重要方法:N2O(g)+CO(g) N2(g)+CO2(g)ΔH。回答下列问题:
N2(g)+CO2(g)ΔH。回答下列问题:
(1)已知:i.2CO(g)+O2(g) 2CO2(g)ΔH1
2CO2(g)ΔH1
ii.2N2O(g) 2N2(g)+O2(g)ΔH2
2N2(g)+O2(g)ΔH2
ΔH=_____ (用含ΔH1、ΔH2的式子表示)。
(2)N2O和CO在Fe+作用下的反应分两步进行:
反应I:Fe++N2O→FeO++N2
反应Ⅱ:FeO++CO→Fe++CO2
反应过程的能量变化如图所示:
①决定总反应速率的是_____ (填“反应I”或“反应Ⅱ”)。
②对于反应N2O(g)+CO(g) N2(g)+CO2(g),下列说法正确的是
N2(g)+CO2(g),下列说法正确的是_____ (填字母)。
A.Fe+是催化剂,能降低反应的焓变
B.升高温度,N2O的平衡转化率减小
C.降低反应温度,反应平衡常数不变
D.上述反应过程中断裂离子键和极性键
(3)N2O(g)+CO(g) N2(g)+CO2(g)的速率方程为v正=k正c(CO)•c(N2O),v逆=k逆c(O2)•c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
N2(g)+CO2(g)的速率方程为v正=k正c(CO)•c(N2O),v逆=k逆c(O2)•c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
①反应速率Δv等于正、逆反应速率之差。平衡时,Δv(500K)_____ Δv(550K)(填“>”或“=”)。
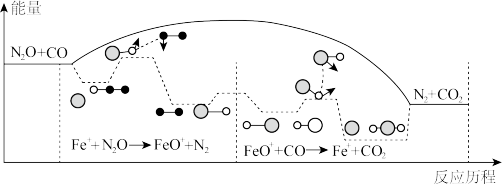
②该反应的平衡常数为K,在图中画出pK(pK=-lgK)随温度的倒数( )的变化曲线
)的变化曲线_____ 。
(4)在473K时,向恒容密闭容器中充入amolCO和amolN2O,发生上述反应,平衡时N2O的体积分数为25%,该温度下的平衡常数的数值为_____ 。
(5)已知500℃时,CaC2O4(s) CaCO3(s)+CO(g)的平衡常数Kp=ekPa。向一恒容密闭容器加入足量的CaC2O4固体,再充入一定量N2O气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应CO(g)+N2O(g)
CaCO3(s)+CO(g)的平衡常数Kp=ekPa。向一恒容密闭容器加入足量的CaC2O4固体,再充入一定量N2O气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应CO(g)+N2O(g) N2(g)+CO2(g)的平衡常数Kp=
N2(g)+CO2(g)的平衡常数Kp=_____ (用含e、b、c的式子表示)。
 N2(g)+CO2(g)ΔH。回答下列问题:
N2(g)+CO2(g)ΔH。回答下列问题:(1)已知:i.2CO(g)+O2(g)
 2CO2(g)ΔH1
2CO2(g)ΔH1ii.2N2O(g)
 2N2(g)+O2(g)ΔH2
2N2(g)+O2(g)ΔH2ΔH=
(2)N2O和CO在Fe+作用下的反应分两步进行:
反应I:Fe++N2O→FeO++N2
反应Ⅱ:FeO++CO→Fe++CO2
反应过程的能量变化如图所示:

①决定总反应速率的是
②对于反应N2O(g)+CO(g)
 N2(g)+CO2(g),下列说法正确的是
N2(g)+CO2(g),下列说法正确的是A.Fe+是催化剂,能降低反应的焓变
B.升高温度,N2O的平衡转化率减小
C.降低反应温度,反应平衡常数不变
D.上述反应过程中断裂离子键和极性键
(3)N2O(g)+CO(g)
 N2(g)+CO2(g)的速率方程为v正=k正c(CO)•c(N2O),v逆=k逆c(O2)•c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。
N2(g)+CO2(g)的速率方程为v正=k正c(CO)•c(N2O),v逆=k逆c(O2)•c(N2)(k正、k逆为速率常数,与温度、催化剂、接触面积有关,与浓度无关)。①反应速率Δv等于正、逆反应速率之差。平衡时,Δv(500K)
②该反应的平衡常数为K,在图中画出pK(pK=-lgK)随温度的倒数(
 )的变化曲线
)的变化曲线
(4)在473K时,向恒容密闭容器中充入amolCO和amolN2O,发生上述反应,平衡时N2O的体积分数为25%,该温度下的平衡常数的数值为
(5)已知500℃时,CaC2O4(s)
 CaCO3(s)+CO(g)的平衡常数Kp=ekPa。向一恒容密闭容器加入足量的CaC2O4固体,再充入一定量N2O气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应CO(g)+N2O(g)
CaCO3(s)+CO(g)的平衡常数Kp=ekPa。向一恒容密闭容器加入足量的CaC2O4固体,再充入一定量N2O气体,起始压强为bkPa,达到平衡时总压强为ckPa。500℃时,反应CO(g)+N2O(g) N2(g)+CO2(g)的平衡常数Kp=
N2(g)+CO2(g)的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:CO(g)+2H2(g)  CH3OH(g)△H=-128.1kJ·mol-1
CH3OH(g)△H=-128.1kJ·mol-1
回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有_____ 。
A、升高温度 B、增大压强 C、充入氢气 D、分离出甲醇
(2)恒温恒容条件能说明该可逆反应达平衡的是_________ ;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
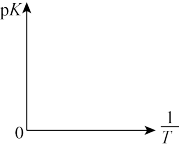
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中充入1molCO(g)和2molH2(g)。实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示。
①该反应的△S____ 0,图中的T1___ T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为______ ,若达到平衡状态B时,则容器的体积V(B)=______ L。
(4) CO燃烧的热化学方程式:CO(g)+ 1/2 O2(g)═CO2(g)△H= —283.0kJ•mol-1
H2(g)+1/2 O2(g)═H2O(l)△H= —285.8 kJ•mol-1
CO(g)+2H2(g)═CH3OH(l)△H= —128.1KJ•mol-1
则CH3OH(g)燃烧热的热化学方程式是为___________ 。
 CH3OH(g)△H=-128.1kJ·mol-1
CH3OH(g)△H=-128.1kJ·mol-1回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有
A、升高温度 B、增大压强 C、充入氢气 D、分离出甲醇
(2)恒温恒容条件能说明该可逆反应达平衡的是
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中充入1molCO(g)和2molH2(g)。实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示。

①该反应的△S
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为
(4) CO燃烧的热化学方程式:CO(g)+ 1/2 O2(g)═CO2(g)△H= —283.0kJ•mol-1
H2(g)+1/2 O2(g)═H2O(l)△H= —285.8 kJ•mol-1
CO(g)+2H2(g)═CH3OH(l)△H= —128.1KJ•mol-1
则CH3OH(g)燃烧热的热化学方程式是为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】丙烯腈(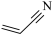 )是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯(
)是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯( )为原料合成丙烯腈,主要反应过程如下:
)为原料合成丙烯腈,主要反应过程如下:
反应I:



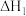 >0
>0
反应II: +NH3(g)
+NH3(g) 
 (g)+H2O(g)+
(g)+H2O(g)+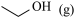
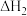 >0
>0
(1)已知部分化学键键能如下表所示:
据此计算ΔH1=___________ ;此反应自发进行的条件是___________ (填“高温易自发”“低温易自发”或“任何温度都能自发”)。
(2)在盛有催化剂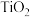 、压强为200kPa的恒压密闭容器中按体积比2∶15充入
、压强为200kPa的恒压密闭容器中按体积比2∶15充入 和
和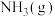 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
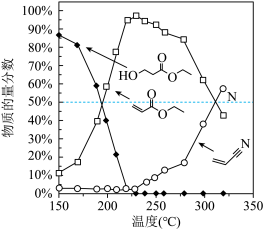
①随着温度的升高, (g)的平衡物质的量分数先增大后减小的原因为
(g)的平衡物质的量分数先增大后减小的原因为___________ 。
②N点对应反应II的平衡常数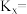
___________ (x代表物质的量分数)。
③科学家通过DFT计算得出反应II的反应历程有两步,其中第一步反应的化学方程式为: +NH3(g)
+NH3(g)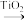
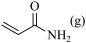 +
+ 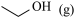 ,则第二步反应的化学方程式为
,则第二步反应的化学方程式为___________ ;实验过程中未检测到 的原因可能
的原因可能___________ 。
④实际生产中若充入一定量N2(不参与反应),可提高丙烯腈的平衡产率,原因为___________ 。
 )是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯(
)是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯( )为原料合成丙烯腈,主要反应过程如下:
)为原料合成丙烯腈,主要反应过程如下: 反应I:




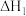 >0
>0反应II:
 +NH3(g)
+NH3(g) 
 (g)+H2O(g)+
(g)+H2O(g)+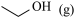
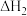 >0
>0(1)已知部分化学键键能如下表所示:
| 化学键 | C﹣O | C﹣C | C=C | C﹣H | O﹣H | C=O |
| 键能(kJ•mol ﹣1) | 351 | 348 | 615 | 413 | 463 | 745 |
据此计算ΔH1=
(2)在盛有催化剂
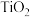 、压强为200kPa的恒压密闭容器中按体积比2∶15充入
、压强为200kPa的恒压密闭容器中按体积比2∶15充入 和
和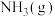 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
①随着温度的升高,
 (g)的平衡物质的量分数先增大后减小的原因为
(g)的平衡物质的量分数先增大后减小的原因为②N点对应反应II的平衡常数
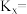
③科学家通过DFT计算得出反应II的反应历程有两步,其中第一步反应的化学方程式为:
 +NH3(g)
+NH3(g)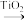
 +
+ 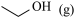 ,则第二步反应的化学方程式为
,则第二步反应的化学方程式为 的原因可能
的原因可能④实际生产中若充入一定量N2(不参与反应),可提高丙烯腈的平衡产率,原因为
您最近一年使用:0次



