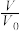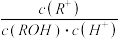25℃时,在25mL0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH与CH3COOH溶液体积关系如图所示。下列有关粒子浓度关系不正确的是
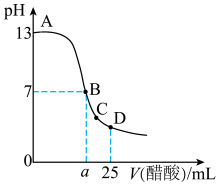

| A.曲线上A、B间的任意一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.B点:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.D点:c(CH3COO-)+ c(CH3COOH)=2c(Na+) |
更新时间:2024-02-01 10:06:15
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】已知部分弱酸的电离常数如下表:
以下说法不正确的是
| 化学式 | HF | H2CO3 | H2S |
| 电离平衡常数K(25℃) | 7.2×10-4 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
A.25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c( )分别为a、b、c(单位为mol/L),由大到小c>a>b )分别为a、b、c(单位为mol/L),由大到小c>a>b |
B.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb= )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=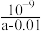 |
| C.常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是NaF |
D.将过量H2S通入Na2CO3溶液,反应的离子方程式是 +H2S= +H2S= + + |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液中滴加NaOH溶液,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是


| A.pH=3.50时,c(H2A)>c(HA-)>c(A2-) |
| B.从a点开始滴入NaOH溶液,溶液中c(H+)/c(H2A)先减小后增大 |
| C.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性 |
| D.pH从3.00到5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列说法正确的是
| A.常温下将等体积pH =3的H2SO4和pH =11的碱BOH溶液混合,所得溶液不可能为酸性 |
| B.两种醋酸溶液的pH分别为a和(a+l),物质的量浓度分别为c1和c2,则c1=10c2 |
| C.常温下将0.1mol/L的HI溶液加水稀释100倍,溶液中所有离子的浓度随之减小 |
D. 浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,各溶液浓度大小顺序:③>②>① 浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,各溶液浓度大小顺序:③>②>① |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
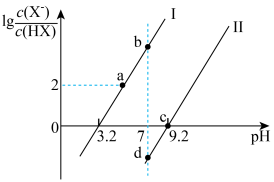
【推荐2】已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
A.直线I对应的是 |
| B.I中a点到b点的过程中水的电离程度逐渐增大 |
C.c点溶液中: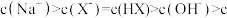  |
| D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】常温下,向某浓度的二元弱酸H2A溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是


| A.pH由2增大到3的过程中,水的电离程度先减小后增大 |
| B.溶液中存在点d满足3[c(H2A)+c(HA-)+c(A2-)] = 2c(Na+),该点位于b、c之间 |
| C.pH=3时,溶液中c(HA-)= c(A2-) > c(H2A) |
| D.常温下,溶液中c(H2A)·c(A2-)与c2(HA-)的比值为104.5 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列叙述正确的是
| A.0.1 mol·L-1氨水中,c(OH-)=c(NH4+) |
| B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11 |
| C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】已知NaHSO3溶液显酸性,表示0.1mol/LNaHSO3溶液中有关微粒浓度大小的关系式,正确的是( )
| A.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) |
| B.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) |
| C.c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)>c(OH-) |
| D.c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
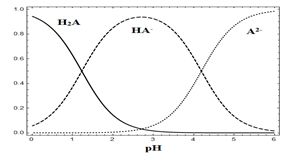

| A.在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大 |
| B.将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-) |
| C.NaHA溶液中,HA-的水解能力大于HA-的电离能力 |
| D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】25℃时,向1L0.01mol·L-1H2B溶液中滴加NaOH溶液,溶液中c(H2B)、c(HB-)、c(B2-)、c(OH-)、c(H+)的对数值(lgc)与pH的关系如图所示(温度保持不变)。
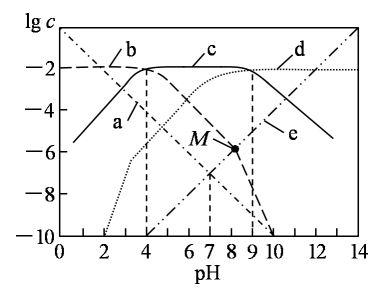
下列说法错误的是
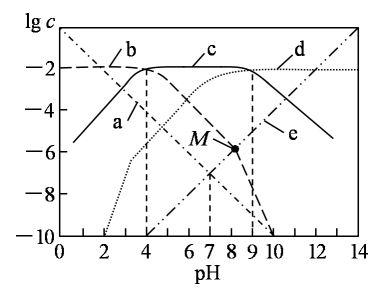
下列说法错误的是
| A.曲线c表示lgc(HB-)与pH的关系 |
| B.随pH增加,c(H2B)·c(OH-)先增大后减小 |
| C.0.01mol·L-1NaHB溶液中,c(Na+)>c(HB-)>c(B2-)>c(H+)>c(H2B) |
| D.M点溶液中n(Na+)+n(H+)-n(B2-)=0.01mol |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】向1L 0.3mol/L的NaOH溶液中通入标况下CO2 4.48L,下列关系不正确的是
A.C(Na+)>C(CO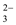 )>C(HCO )>C(HCO )>C(OH-)>C(H+) )>C(OH-)>C(H+) |
B.2C(Na+)=3[C(CO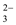 )+C(HCO )+C(HCO )+C(H2CO3)] )+C(H2CO3)] |
C.2C(OH-)+C(CO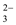 )=C(HCO )=C(HCO )+3C(H2CO3)+2C(H+) )+3C(H2CO3)+2C(H+) |
D.C(Na+)+C(H+)=C(OH-)+C(HCO )+2C(CO )+2C(CO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】已知25°C时有关弱酸的电离平衡常数如下表:
下列有关说法正确的是
| 弱酸化学式 | HF | H2SO3 |
| 电离平衡常数(25°C) | Ka=6.8×10-4 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
| A.等物质的量浓度的各溶液pH关系:pH(Na2SO3)<pH(NaF)<pH(NaHSO3) |
| B.将0.lmo/L的HF与0.1mol/L的NaF等体积混合,混合液pH>7 |
C.Na2SO3溶液中加入足量HF发生反应的离子方程式为SO +HF=F-+HSO +HF=F-+HSO |
D.NaHSO3溶液中部分微粒浓度的大小:c(Na+)>c(HSO )>c(H2SO3)>c(SO )>c(H2SO3)>c(SO ) ) |
您最近一年使用:0次