Ⅰ.生产、生活废水必须要做及时处理,否则会影响人类的生活环境。废水的常见化学处理法有:中和法、氧化还原法、萃取法、吸附法、混凝法、沉淀法等。
(1)下列物质常被用于污水处理,其中属于纯净物的是___________
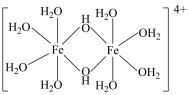
(2)三价铁的强酸盐溶液因会发生水解,可被用作净水剂,其水解时会产生黄色的[Fe(OH)(H2O)5]2+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。则二聚体中Fe的配位数为___________ 。
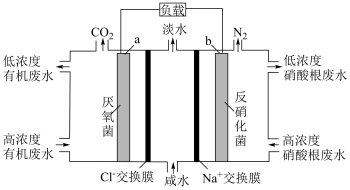
(3)某工厂的酸性 废水中同时含有高浓度有机物(化学式为C6H10O5)和NO 离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
Ⅱ.大量含氮污水任意排放将造成藻类疯长,出现水体富营养化等问题。某小组尝试用NaClO溶液处理含氨氮废水。
(4)室温下,部分酸的电离平衡常数如表所示,
下列关于次氯酸钠溶液的说法中,错误的是___________;
(5)下列物质中不能与NaClO反应的是___________
(6)NaClO将废水中的NH3氧化为无污染气体,反应的化学方程式为___________ ;实际实验中NaClO溶液的投入量要大于理论计算量,可能的原因是___________ 。
Ⅲ.含铜(Cu2+)废水是冶金、电子等行业产生的废水,直接排放会导致严重污染。工业上常用NaHS作为沉淀剂处理Cu2+离子。
(7)已知0.1 mol·L−1NaHS溶液呈碱性;
①若将该溶液中的离子按浓度由大到小进行排序,排位第三的离子是___________
A.Na+ B.HS− C.S2− D.OH−
②通过计算,说明溶液呈碱性的原因:___________
(8)沉淀铜离子时,发生反应Cu2+(aq) + 2HS− (aq) CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =
CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =___________ (用该反应的K,H2S的Ka1和Ka2表示)。
(1)下列物质常被用于污水处理,其中属于纯净物的是___________
| A.漂粉精 | B.聚丙烯酸钠 | C.明矾 | D.石灰乳 |
(2)三价铁的强酸盐溶液因会发生水解,可被用作净水剂,其水解时会产生黄色的[Fe(OH)(H2O)5]2+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。则二聚体中Fe的配位数为

(3)某工厂的
 离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
| A.图中的a极为阳极,发生氧化反应 |
| B.该装置工作时,电子经导线由a极流向b极 |
| C.Na+向b极流动,故b极为负极 |
| D.该装置亦可用于咸水淡化 |
Ⅱ.大量含氮污水任意排放将造成藻类疯长,出现水体富营养化等问题。某小组尝试用NaClO溶液处理含氨氮废水。
(4)室温下,部分酸的电离平衡常数如表所示,
| 化学式 | 常温下的电离平衡常数 |
| HClO | Ka = 3×10−8 |
| H2CO3 | Ka1 = 4.2×10−7 Ka2 = 4.8×10−11 |
| H2S | Ka1 = 1.3×10−7 Ka2 = 7.1×10−15 |
| A.依据物料守恒关系,[Na+] =[ClO−] + [HClO] |
| B.依据强酸制弱酸原理,通入少量SO2有利于HClO生成,可增强漂白作用 |
| C.由于NaClO水解呈碱性,则[Na+]>[ClO−] |
| D.根据“有弱才水解”规律,所以NaClO是弱电解质 |
(5)下列物质中不能与NaClO反应的是___________
| A.CO2 | B.NaHCO3 | C.H2S | D.NaHS |
(6)NaClO将废水中的NH3氧化为无污染气体,反应的化学方程式为
Ⅲ.含铜(Cu2+)废水是冶金、电子等行业产生的废水,直接排放会导致严重污染。工业上常用NaHS作为沉淀剂处理Cu2+离子。
(7)已知0.1 mol·L−1NaHS溶液呈碱性;
①若将该溶液中的离子按浓度由大到小进行排序,排位第三的离子是
A.Na+ B.HS− C.S2− D.OH−
②通过计算,说明溶液呈碱性的原因:
(8)沉淀铜离子时,发生反应Cu2+(aq) + 2HS− (aq)
 CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =
CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =
更新时间:2024-04-03 17:29:25
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】 在实验研究和化学工业中应用广泛,有多种制备方法。
在实验研究和化学工业中应用广泛,有多种制备方法。
Ⅰ.利用 溶液吸收
溶液吸收 制备
制备 溶液
溶液
(1)写出该制备方法的离子方程式___________ 。
(2) 时,
时, 与
与 反应后的溶液中,
反应后的溶液中, 价含
价含 微粒(
微粒( 和
和 )物质的量分数随
)物质的量分数随 变化如图1所示:
变化如图1所示:
Ⅱ.利用工业废碱渣(主要成分 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水 的成本低,优势明显。其流程如下:
的成本低,优势明显。其流程如下: )显碱性的原因
)显碱性的原因___________ 。
(4)图2为吸收塔中 溶液与
溶液与 反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是
反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是___________ 。___________ 。
(6)为了降低由中和器所得溶液中 的溶解度,从而提高结晶产率,中和器中加入的
的溶解度,从而提高结晶产率,中和器中加入的 是过量的。
是过量的。
①请结合化学反应原理解释 过量的原因
过量的原因___________ 。
②结晶时应选择的最佳操作是___________ (选填字母)。
a.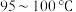 加热蒸发,直至蒸干
加热蒸发,直至蒸干
b.维持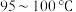 蒸发浓缩至有大量晶体析出,趁热过滤
蒸发浓缩至有大量晶体析出,趁热过滤
c.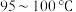 加热浓缩,冷却至室温结晶,过滤
加热浓缩,冷却至室温结晶,过滤
(7)为检验 成品中是否含少量
成品中是否含少量 ,需选用的试剂是
,需选用的试剂是___________ 。
 在实验研究和化学工业中应用广泛,有多种制备方法。
在实验研究和化学工业中应用广泛,有多种制备方法。Ⅰ.利用
 溶液吸收
溶液吸收 制备
制备 溶液
溶液(1)写出该制备方法的离子方程式
(2)
 时,
时, 与
与 反应后的溶液中,
反应后的溶液中, 价含
价含 微粒(
微粒( 和
和 )物质的量分数随
)物质的量分数随 变化如图1所示:
变化如图1所示: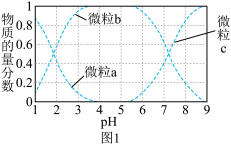
A.曲线 表示 表示 物质的量分数随溶液 物质的量分数随溶液 变化的曲线 变化的曲线 |
B. 的溶液中: 的溶液中: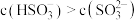 |
C. 的溶液中: 的溶液中: |
D. 的 的 溶液中存在: 溶液中存在: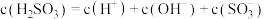 |
Ⅱ.利用工业废碱渣(主要成分
 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水 的成本低,优势明显。其流程如下:
的成本低,优势明显。其流程如下: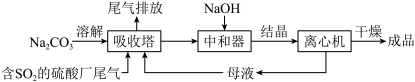
 )显碱性的原因
)显碱性的原因(4)图2为吸收塔中
 溶液与
溶液与 反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是
反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是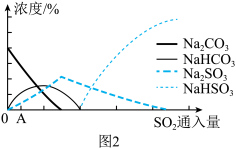
| 资料显示: Ⅰ.  在 在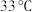 时溶解度最大,将其饱和溶液加热至 时溶解度最大,将其饱和溶液加热至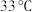 以上时,由于溶解度降低会析出无水 以上时,由于溶解度降低会析出无水 ,冷却至 ,冷却至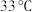 以下时析出 以下时析出 ; ;Ⅱ.无水  在空气中不易被氧化, 在空气中不易被氧化, 在空气中易被氧化。 在空气中易被氧化。 |
(6)为了降低由中和器所得溶液中
 的溶解度,从而提高结晶产率,中和器中加入的
的溶解度,从而提高结晶产率,中和器中加入的 是过量的。
是过量的。①请结合化学反应原理解释
 过量的原因
过量的原因②结晶时应选择的最佳操作是
a.
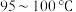 加热蒸发,直至蒸干
加热蒸发,直至蒸干b.维持
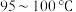 蒸发浓缩至有大量晶体析出,趁热过滤
蒸发浓缩至有大量晶体析出,趁热过滤c.
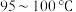 加热浓缩,冷却至室温结晶,过滤
加热浓缩,冷却至室温结晶,过滤(7)为检验
 成品中是否含少量
成品中是否含少量 ,需选用的试剂是
,需选用的试剂是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】在无水无氧条件下制备二氟草酸硼酸锂LiBF2C2O4,其过程可表示如下:
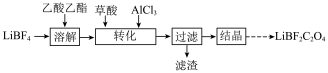
(1)LiBF2C2O4可替代目前常用的锂离子电池电解质LiPF6。
已知:LiBF2C2O4的分解温度为240 ℃,LiPF6的分解温度约200 ℃;在25 ℃、潮湿环境中,两种样品的XRD图谱(可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)如图所示。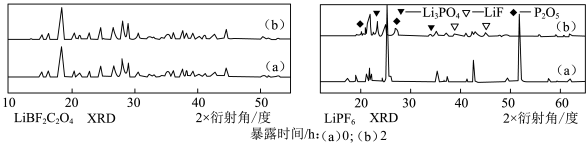
①LiPF6暴露在环境中迅速产生气体X,形成白雾。X由两种元素组成,其化学式为______ 。
②LiBF2C2O4替代LiPF6作电池电解质的优势有_______ 。
(2)“溶解”和“转化”操作在如图所示装置中进行。

①“溶解”时的操作依次为称取一定质量LiBF4置于三颈瓶中→____ (填字母)→搅拌直至完全溶解。
A.注入乙酸乙酯→充入N2→抽真空 B.抽真空→注入乙酸乙酯→充入N2
C.抽真空→充入N2→注入乙酸乙酯
②“转化”时,将草酸、催化剂AlCl3与溶剂乙酸乙酯混合,再将混合液注入三颈瓶中。保持搅拌速率不变,为防止反应过于剧烈,可采取的操作或实验条件为______ 。(写出一种)
(3)已知AlCl3在178 ℃时升华,极易水解;SOCl2熔点-105 ℃,沸点76 ℃,遇水剧烈反应生成SO2和HCl气体;AlCl3微溶于SOCl2。为获得少量无水AlCl3,请补充实验方案:向三颈瓶中加入一定质量AlCl3·6H2O晶体,常压下加入SOCl2,_____________ ,得到无水AlCl3。(实验须使用的试剂和仪器:NaOH溶液、冷凝管)

(1)LiBF2C2O4可替代目前常用的锂离子电池电解质LiPF6。
已知:LiBF2C2O4的分解温度为240 ℃,LiPF6的分解温度约200 ℃;在25 ℃、潮湿环境中,两种样品的XRD图谱(可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)如图所示。

①LiPF6暴露在环境中迅速产生气体X,形成白雾。X由两种元素组成,其化学式为
②LiBF2C2O4替代LiPF6作电池电解质的优势有
(2)“溶解”和“转化”操作在如图所示装置中进行。

①“溶解”时的操作依次为称取一定质量LiBF4置于三颈瓶中→
A.注入乙酸乙酯→充入N2→抽真空 B.抽真空→注入乙酸乙酯→充入N2
C.抽真空→充入N2→注入乙酸乙酯
②“转化”时,将草酸、催化剂AlCl3与溶剂乙酸乙酯混合,再将混合液注入三颈瓶中。保持搅拌速率不变,为防止反应过于剧烈,可采取的操作或实验条件为
(3)已知AlCl3在178 ℃时升华,极易水解;SOCl2熔点-105 ℃,沸点76 ℃,遇水剧烈反应生成SO2和HCl气体;AlCl3微溶于SOCl2。为获得少量无水AlCl3,请补充实验方案:向三颈瓶中加入一定质量AlCl3·6H2O晶体,常压下加入SOCl2,
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】铵盐是比较重要的盐类物质,请回答下列问题。
(1)草酸是二元弱酸,能形成两种铵盐。
①(NH4)2C2O4溶液呈酸性,溶液中各离子浓度由大到小的顺序为_______ 。
②NH4HC2O4溶液中,c(H2C2O4)-c(C2O )=
)=_______ 。
(2)NH4SCN溶液与AgNO3溶液反应会生成AgSCN沉淀。已知:常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)=2.0×10-12,则AgCl转化为AgSCN的平衡常数K=_______ 。
(3)氯化铵是最常见的铵盐,在工业生产中用途广泛。
①热的浓氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:_______ 。
②常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH 和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
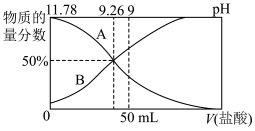
a.表示NH3·H2O物质的量分数变化的曲线是_______ (填“A”或“B”)。
b.NH3·H2O的电离常数为_______ 。
③常温下,在20 mL a mol·L-1氨水中滴加20 mL b mol·L-1盐酸恰好使溶液呈中性。常温下,NH 的水解常数Kh=
的水解常数Kh=_______ (用含a、b的代数式表示)。
(1)草酸是二元弱酸,能形成两种铵盐。
①(NH4)2C2O4溶液呈酸性,溶液中各离子浓度由大到小的顺序为
②NH4HC2O4溶液中,c(H2C2O4)-c(C2O
 )=
)=(2)NH4SCN溶液与AgNO3溶液反应会生成AgSCN沉淀。已知:常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)=2.0×10-12,则AgCl转化为AgSCN的平衡常数K=
(3)氯化铵是最常见的铵盐,在工业生产中用途广泛。
①热的浓氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:
②常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH
 和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
a.表示NH3·H2O物质的量分数变化的曲线是
b.NH3·H2O的电离常数为
③常温下,在20 mL a mol·L-1氨水中滴加20 mL b mol·L-1盐酸恰好使溶液呈中性。常温下,NH
 的水解常数Kh=
的水解常数Kh=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:
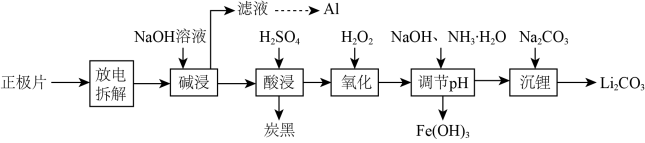
已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______ 次过滤操作。
(2)“氧化”发生反应的离子方程式为__________ ;若用HNO3代替H2O2不足之处是_____ 。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________ mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
则最佳的沉淀pH=________ 。
(4)“沉锂" 时的温度应选(填标号)______ 为宜,并用___ 洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________ 。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过
(2)“氧化”发生反应的离子方程式为
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
| pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
| ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
| ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
(4)“沉锂" 时的温度应选(填标号)
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
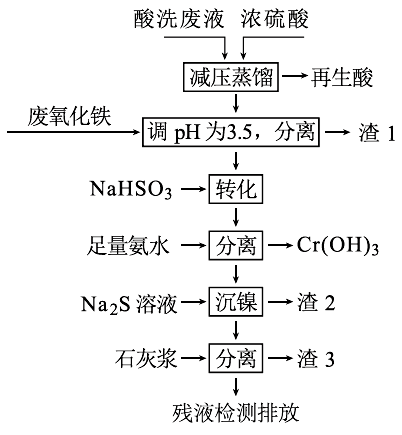
【推荐2】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下图是综合利用该酸洗废液的工艺流程:
已知:
金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3 [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为____________ ,
(2)滤渣1的主要成份为:____________ 。
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:________ 。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:____________ 。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和_____ 。
(6)经检测,最后的残液中c(Ca2+)=0.001 mol•L-1,则残液中F-浓度为____ mg•L-1,______ (填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mg•L-1]。
已知:
金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3
 [Ni(NH3)6]2+
[Ni(NH3)6]2+(1)再生酸中含有HNO3,采取减压蒸馏的目的为
(2)滤渣1的主要成份为:
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和
(6)经检测,最后的残液中c(Ca2+)=0.001 mol•L-1,则残液中F-浓度为
您最近一年使用:0次
【推荐3】碳酸铈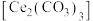 是一种稀土材料,工业上常以氟碳铈矿(主要成分为
是一种稀土材料,工业上常以氟碳铈矿(主要成分为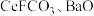 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以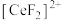 存在
存在
② 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀
,两者均能形成氢氧化物沉淀
(1)“焙烧”时,从焙烧室的底部通入空气目的是___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)“还原”时,加入硫脲(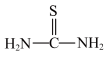 )的目的是将
)的目的是将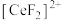 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为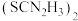 。
。
①该反应的离子方程式为___________ 。
②硫脲属于分子___________ (填“极性”或“非极性”),该分子中键角
___________ 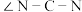 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③ 中含有
中含有 键的数目为
键的数目为___________ (设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为___________ 。
(5)“沉淀”时的离子方程式为___________ 。若“沉淀”后,溶液的 为6,
为6, ,此时
,此时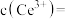
___________  。已知常温下:
。已知常温下:
(6)某研究小组利用硫化锌锂电池电解含 (Ⅱ)的溶液,可将
(Ⅱ)的溶液,可将 (Ⅱ)转化为
(Ⅱ)转化为 (Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示。
(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示。 中,X=
中,X=___________ 。
② 晶胞中,
晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为
之间的核间距为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度为
为阿伏加德罗常数的值,则晶胞的密度为___________  (列出计算式,
(列出计算式, 的摩尔质量为
的摩尔质量为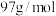 ,)。
,)。
 是一种稀土材料,工业上常以氟碳铈矿(主要成分为
是一种稀土材料,工业上常以氟碳铈矿(主要成分为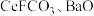 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示: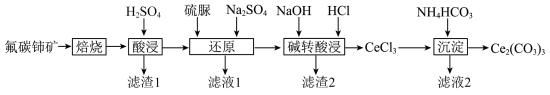
①“酸浸”后铈元素主要以
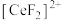 存在
存在②
 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀
,两者均能形成氢氧化物沉淀(1)“焙烧”时,从焙烧室的底部通入空气目的是
(2)“滤渣1”的主要成分为
(3)“还原”时,加入硫脲(
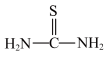 )的目的是将
)的目的是将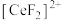 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为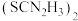 。
。①该反应的离子方程式为
②硫脲属于分子

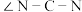 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③
 中含有
中含有 键的数目为
键的数目为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)“沉淀”时的离子方程式为
 为6,
为6, ,此时
,此时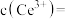
 。已知常温下:
。已知常温下: |  | |
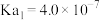 | 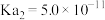 | 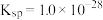 |
 (Ⅱ)的溶液,可将
(Ⅱ)的溶液,可将 (Ⅱ)转化为
(Ⅱ)转化为 (Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示。
(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示。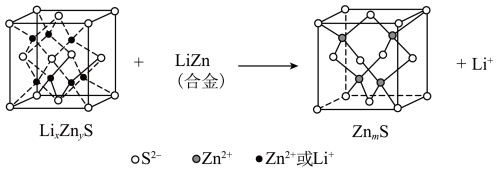
 中,X=
中,X=②
 晶胞中,
晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为
之间的核间距为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度为
为阿伏加德罗常数的值,则晶胞的密度为 (列出计算式,
(列出计算式, 的摩尔质量为
的摩尔质量为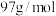 ,)。
,)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】铜的配合物广泛存在,对含铜配合物的研究一直是关注的热点。
I.同学甲设计如下制备铜的配合物的实验I:

已知:铜离子的配位数通常为4, 呈深蓝色,
呈深蓝色, 呈深蓝色
呈深蓝色
(1) 溶液呈蓝色的原因是溶液中存在配离子
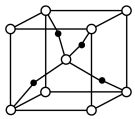
溶液呈蓝色的原因是溶液中存在配离子_______ (填化学式);利用 可制备
可制备 (晶胞如图),1个晶胞中含Cu原子的数目为
(晶胞如图),1个晶胞中含Cu原子的数目为_______ 。
(2)写出浑浊液中加入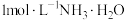 溶液发生的离子方程式:
溶液发生的离子方程式:_______ ,结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因_______ 。
(3)由实验I可得出以下结论:
结论1:配合物的形成与_______ 、_______ 有关;
结论2:结合上述实验,b、c中配体的配位能力强弱顺序为:_______ (填化学式)。
II.同学乙查阅资料发现 与
与 在溶液中可以发生配位反应,生成配合物
在溶液中可以发生配位反应,生成配合物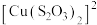 ;同学丙认为
;同学丙认为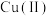 有氧化性,
有氧化性, 与
与 在溶液中可以发生氧化还原反应。
在溶液中可以发生氧化还原反应。
【资料】i.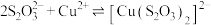 (绿色);
(绿色);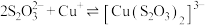 (无色);
(无色);
ii. (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);
iii. 易被氧化为
易被氧化为 或
或 。
。
实验II:探究 与
与 溶液的反应。
溶液的反应。
(4)①丙同学认为实验II可证明发生了氧化还原反应,他的理由是_______
②丙同学利用已知资料进一步确证了无色溶液中存在 ,他的实验方案是:取少量无色溶液,
,他的实验方案是:取少量无色溶液,_______ 。
(5)经检验氧化产物以 形式存在,写出
形式存在,写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:_______ 。
(6)由实验II可得出以下结论: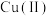 盐与
盐与 在溶液中的反应与多种因素有关,随
在溶液中的反应与多种因素有关,随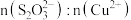 的增大,
的增大,_______ 。
I.同学甲设计如下制备铜的配合物的实验I:

已知:铜离子的配位数通常为4,
 呈深蓝色,
呈深蓝色, 呈深蓝色
呈深蓝色(1)
 溶液呈蓝色的原因是溶液中存在配离子
溶液呈蓝色的原因是溶液中存在配离子 可制备
可制备 (晶胞如图),1个晶胞中含Cu原子的数目为
(晶胞如图),1个晶胞中含Cu原子的数目为
(2)写出浑浊液中加入
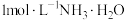 溶液发生的离子方程式:
溶液发生的离子方程式:(3)由实验I可得出以下结论:
结论1:配合物的形成与
结论2:结合上述实验,b、c中配体的配位能力强弱顺序为:
II.同学乙查阅资料发现
 与
与 在溶液中可以发生配位反应,生成配合物
在溶液中可以发生配位反应,生成配合物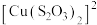 ;同学丙认为
;同学丙认为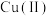 有氧化性,
有氧化性, 与
与 在溶液中可以发生氧化还原反应。
在溶液中可以发生氧化还原反应。【资料】i.
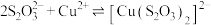 (绿色);
(绿色);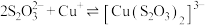 (无色);
(无色);ii.
 (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);iii.
 易被氧化为
易被氧化为 或
或 。
。实验II:探究
 与
与 溶液的反应。
溶液的反应。| 实验操作 | 实验序号 |  |  | 逐滴加入 溶液时的实验现象 溶液时的实验现象 |
 | a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
②丙同学利用已知资料进一步确证了无色溶液中存在
 ,他的实验方案是:取少量无色溶液,
,他的实验方案是:取少量无色溶液,(5)经检验氧化产物以
 形式存在,写出
形式存在,写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:(6)由实验II可得出以下结论:
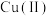 盐与
盐与 在溶液中的反应与多种因素有关,随
在溶液中的反应与多种因素有关,随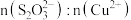 的增大,
的增大,
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】钛是一种银白色过渡金属,在高科技社会中得到了广泛的应用。可以从钛铁矿( )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。
(1)基态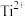 的价电子排布式为
的价电子排布式为___________ ,其核外能量最高的电子所在的能层符号为___________ ,其核外共有___________ 种运动状态不同的电子。
(2)Ti的配合物有多种。在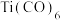 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是___________ (填写元素名称), 中
中
___________ (填“大于”、“小于”或“等于”)单个水分子中 ,原因是
,原因是___________ 。
(3) 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是___________ ,N原子的杂化方式为___________ ,与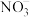 互为等电子体的分子为
互为等电子体的分子为___________ (写分子式)。 和
和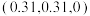 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为___________ ;若阿伏加德罗常数的值为 ,金红石的密度为
,金红石的密度为___________  (列出计算表达式)。
(列出计算表达式)。
 )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。(1)基态
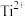 的价电子排布式为
的价电子排布式为(2)Ti的配合物有多种。在
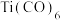 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是 中
中
 ,原因是
,原因是(3)
 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是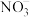 互为等电子体的分子为
互为等电子体的分子为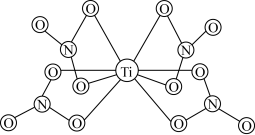
 和
和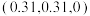 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为 ,金红石的密度为
,金红石的密度为 (列出计算表达式)。
(列出计算表达式)。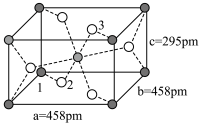
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】(1)写出Cr3+的核外电子排布式_____ 。我国科学家合成某种铬的化合物M(如图甲)对乙烯聚合表现出较好的催化活性,甲中化学键1、2、3、4属于配位键的是_____ ;聚乙烯链中碳原子采取的杂化方式为_____ 。
(2)1mol(SCN)2中含有π键的数目为_____ 。HSCN的结构有两种,其中硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S),原因是_____ 。
(3)研究表明水能凝结成13种类型结晶体,其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如乙,则该晶体中H2O的配位数为_____ ;若该晶胞边长为apm,重冰的密度为_____ g•cm﹣3(写出数学表达式,NA为阿伏加 德罗常数)。
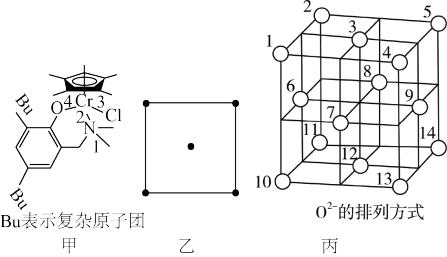
(4)图丙为Fe3O4晶体中O2﹣的排列方式,其中O2﹣围成正四面体空隙(1、3、6、7)和正八面体空隙(3、6、7、8、9、12);Fe3O4晶体中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,则晶体中正四面体空隙数与正八面体空隙数之比为_____ ;有_____ %的正八面体空隙没有填充阳离子。
(2)1mol(SCN)2中含有π键的数目为
(3)研究表明水能凝结成13种类型结晶体,其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如乙,则该晶体中H2O的配位数为

(4)图丙为Fe3O4晶体中O2﹣的排列方式,其中O2﹣围成正四面体空隙(1、3、6、7)和正八面体空隙(3、6、7、8、9、12);Fe3O4晶体中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,则晶体中正四面体空隙数与正八面体空隙数之比为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】研究海洋中珊瑚礁(主要成分CaCO3)的形成机制及其影响具有重要意义,相关主要反应有:
反应Ⅰ:CO2(aq)+H2O(l)
 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7
反应Ⅱ: (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11
反应Ⅲ:CaCO3(s) Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9
请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是_______ (填“温暖海域”或“冰冷海域”),该反应的平衡常数K=_______ (用K1、K2、K3表示)。
(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势_______ 。_______ 0(填“>”“<”或“=”);随温度的升高,容器中CO2的浓度在T3温度下出现最低值的原因是_______ 。
反应Ⅰ:CO2(aq)+H2O(l)

 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7反应Ⅱ:
 (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11反应Ⅲ:CaCO3(s)
 Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2
 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
A.海水中最主要的含碳微粒为 |
B.海水中的c(Ca2+)>c( )+c( )+c( ) ) |
C. 、 、 的水解反应是海水呈弱碱性的主要原因 的水解反应是海水呈弱碱性的主要原因 |
D.珊瑚礁形成的反应阻碍了 的电离 的电离 |
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与
 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】I.连二次硝酸(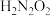 )是一种二元酸。可用于制NO气体。
)是一种二元酸。可用于制NO气体。
(1)连二次硝酸中氮元素的化合价为_______ 。
(2)常温下,用0.01 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的
的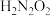 溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
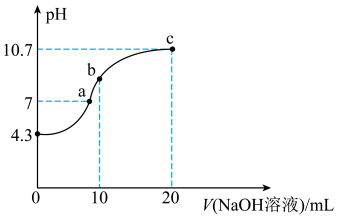
①写出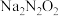 在水溶液中的第一步水解方程式:
在水溶液中的第一步水解方程式:_______ 。
②常温下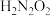 的
的 ≈
≈_______ 。
③a、b、c三点,水的电离程度最小的是_______ 。
II.25℃时,有浓度均为0.10 的下列4种溶液:①NaCN溶液;②NaOH溶液;
的下列4种溶液:①NaCN溶液;②NaOH溶液;
③ 溶液;④
溶液;④ 溶液。相关电离常数如表所示。
溶液。相关电离常数如表所示。
(3)这4种溶液pH由小到大的顺序是_______ (填序号)。
(4)①中各离子浓度由小到大的顺序是_______ 。向NaCN溶液中通入少量 ,发生反应的化学方程式为
,发生反应的化学方程式为_______ 。
(5)测得HCN和NaCN的混合溶液的pH=11,则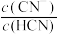 约为
约为_______ 。
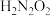 )是一种二元酸。可用于制NO气体。
)是一种二元酸。可用于制NO气体。(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01
 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的
的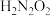 溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
①写出
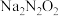 在水溶液中的第一步水解方程式:
在水溶液中的第一步水解方程式:②常温下
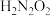 的
的 ≈
≈③a、b、c三点,水的电离程度最小的是
II.25℃时,有浓度均为0.10
 的下列4种溶液:①NaCN溶液;②NaOH溶液;
的下列4种溶液:①NaCN溶液;②NaOH溶液;③
 溶液;④
溶液;④ 溶液。相关电离常数如表所示。
溶液。相关电离常数如表所示。| HCN |  |  |
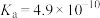 | 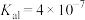  | 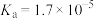 |
(3)这4种溶液pH由小到大的顺序是
(4)①中各离子浓度由小到大的顺序是
 ,发生反应的化学方程式为
,发生反应的化学方程式为(5)测得HCN和NaCN的混合溶液的pH=11,则
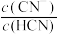 约为
约为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】某小组设计了如下实验探究某未知浓度的酸HA相关性质。
(1)25℃时,配制不同浓度HA溶液,并测其pH值,所得相关数据如下:
据此小组同学得出HA为弱电解质的结论,理由是___________ 。
(2)25℃,将pH=2的HA溶液与pH=12的NaOH溶液等体积混合,下列说法正确的是________ (填序号)。
a.混合后离子浓度满足等式: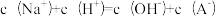
b.混合后会生成强碱弱酸盐NaA,因其水解而使混合后的溶液显碱性
c.pH=2的HA溶液中,由水电离出的H+浓度为10-2mo1/L
d.pH=12的NaOH溶液中,由水电离出的H+浓度为10-12mol/L
(3)25℃时,向HA溶液中加入NaOH,配制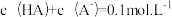 的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数
的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数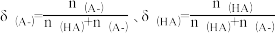 与所加NaOH物质的量的关系如图所示。
与所加NaOH物质的量的关系如图所示。
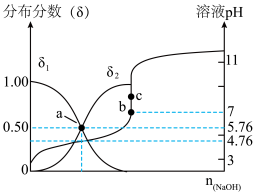
①δ1表示___________ (填微粒符号)的分布分数曲线。
②25℃时,HA的电离平衡常数Ka=___________ (已知100.24=1.75)。
③pH=5时,溶液中A-的浓度和HA的浓度之比为c(A-):c(HA)=___________ 。
④若c处c(Na+)=0.1mol/L,则a、b、c三处水的电离程度由大到小排序为___________ 。
(4)查阅资料可知,若往某溶液中加入少量强酸或强碱时,外来的H+或OH-中绝大多数被溶液中某些微粒消耗掉从而导致pH几乎不变的为缓冲溶液。据此小组同学推断(3)中a点对应溶液为缓冲溶液。原因是向a点溶液加入少量酸,外来的H+被A-消耗;加少量碱,外来的OH-被___________ 消耗,导致溶液中游离的H+浓度几乎不变,溶液的pH也几乎不变。
(5)下列浓度比均为1:1的混合溶液中与a点溶液相似,也属于缓冲溶液的是________ (填序号)
a.Na2CO3-NaHCO3 b.H2SO4-Na2SO4 c.NaOH-NaCl d.NH3∙H2O-NH4Cl
(1)25℃时,配制不同浓度HA溶液,并测其pH值,所得相关数据如下:
| 序号 | 原HA溶液体积/mL | 水的体积/mL | pH |
| I | 40.00 | / | 2.88 |
| II | 4.00 | 36.0 | 3.38 |
(2)25℃,将pH=2的HA溶液与pH=12的NaOH溶液等体积混合,下列说法正确的是
a.混合后离子浓度满足等式:
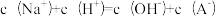
b.混合后会生成强碱弱酸盐NaA,因其水解而使混合后的溶液显碱性
c.pH=2的HA溶液中,由水电离出的H+浓度为10-2mo1/L
d.pH=12的NaOH溶液中,由水电离出的H+浓度为10-12mol/L
(3)25℃时,向HA溶液中加入NaOH,配制
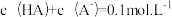 的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数
的混合溶液,溶液的pH、HA和A-分布分数δ(分布分数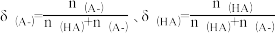 与所加NaOH物质的量的关系如图所示。
与所加NaOH物质的量的关系如图所示。
①δ1表示
②25℃时,HA的电离平衡常数Ka=
③pH=5时,溶液中A-的浓度和HA的浓度之比为c(A-):c(HA)=
④若c处c(Na+)=0.1mol/L,则a、b、c三处水的电离程度由大到小排序为
(4)查阅资料可知,若往某溶液中加入少量强酸或强碱时,外来的H+或OH-中绝大多数被溶液中某些微粒消耗掉从而导致pH几乎不变的为缓冲溶液。据此小组同学推断(3)中a点对应溶液为缓冲溶液。原因是向a点溶液加入少量酸,外来的H+被A-消耗;加少量碱,外来的OH-被
(5)下列浓度比均为1:1的混合溶液中与a点溶液相似,也属于缓冲溶液的是
a.Na2CO3-NaHCO3 b.H2SO4-Na2SO4 c.NaOH-NaCl d.NH3∙H2O-NH4Cl
您最近一年使用:0次



