按要求回答以下问题:
(1)常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为________ 。
(2)实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是______________________ ;AgCl在水中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol•L-1AgNO3溶液;③100mL 0.1mol•L-1氯化镁溶液;④100mL 0.1mol•L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol•L-1AgNO3溶液;③100mL 0.1mol•L-1氯化镁溶液;④100mL 0.1mol•L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是___________________ (填写序号)。
(3)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______ n (填“>”“<”或“=”)。
物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______
25℃时,将0.2mol/L CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液PH<7,写出溶液中所有离子浓度的大小顺序__________________________________ ,此时混合溶液___________ (填“促进”或“抑制”)水的电离,溶液中c(CH3COOH)+c(CH3COO—)_______ 0.1mol/L(填“>”“<”或“=”);若保持温度不变,向体积相同、PH=2的盐酸和醋酸溶液分别加等浓度的氢氧化钠溶液至PH=7,盐酸所需氢氧化钠溶液的体积______ 醋酸所需氢氧化钠溶液的体积(填“>”“<”或“=”)。
(1)常温下0.01mol/L HCl溶液由水电离产生的c(H+)与PH=11的CH3COONa溶液中由水电离产生的c(OH-)之比为
(2)实验室中配制AgNO3溶液时通常需要向其中加入硝酸目的是
 Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol•L-1AgNO3溶液;③100mL 0.1mol•L-1氯化镁溶液;④100mL 0.1mol•L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是
Ag+(aq)+Cl-(aq)。25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol•L-1AgNO3溶液;③100mL 0.1mol•L-1氯化镁溶液;④100mL 0.1mol•L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是(3)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m
物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)
25℃时,将0.2mol/L CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液PH<7,写出溶液中所有离子浓度的大小顺序
更新时间:2017-05-11 21:30:29
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为________________________ 。
(2)同浓度的CH3COO−、HCO3-、CO32-、ClO−结合H+的能力由强到弱的顺序为________________ 。
(3)常温下0.1 mol⋅L−1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH−)
D.c(OH−)/c(H+) E.[c(CH3COO−).c(H+)]/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是_____________ 。
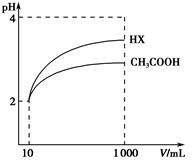
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数________ (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________ ,稀释后,HX溶液中由水电离出来的c(H+)________ (填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是_______________________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10−5 | K1=4.3×10−7 K2=5.6×10−11 | 3.0×10−8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
(2)同浓度的CH3COO−、HCO3-、CO32-、ClO−结合H+的能力由强到弱的顺序为
(3)常温下0.1 mol⋅L−1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH−)
D.c(OH−)/c(H+) E.[c(CH3COO−).c(H+)]/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则相同条件下HX的电离平衡常数

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5;
H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因:_______________________________ 。
②常温下,物质的量浓度相同的下列四种溶液:
a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液
其pH由大到小的顺序是_______________________________ (填序号)。
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是_____________________________ ;该醋酸溶液稀释过程中,下列各量一定变小的是_____________ 。

a.c(H+) b.c(OH-) c.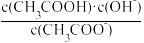 d.
d.
(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=__________________________ 。
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH=__________________________ 。
已知室温下:Ka(CH3COOH)=1.7×10-5;
H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因:
②常温下,物质的量浓度相同的下列四种溶液:
a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液
其pH由大到小的顺序是
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是

a.c(H+) b.c(OH-) c.
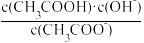 d.
d.
(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】根据具体情境,回答下列问题。
(1)25℃有pH=2的醋酸(编号为甲)和pH=2的盐酸(编号为乙):
①取10mL甲溶液,加入少量无水醋酸钠固体,待固体溶解后溶液中 的值将
的值将______ (填“增大”“减小”或“无法确定”)
②相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲)______ pH(乙)(填“大于”“小于”或“等于”)
③各取25mL甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)______ V(乙)(填“大于”“小于”或“等于”)
④取25mL甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中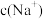 、
、 的大小关系为:
的大小关系为: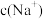
______  (填“大于”“小于”或“等于”)
(填“大于”“小于”或“等于”)
(2)已知亚磷酸( )是二元中强酸,某温度下,0.l
)是二元中强酸,某温度下,0.l 的
的 溶液的pH为2。
溶液的pH为2。
①该温度下 的电离平衡常数
的电离平衡常数 约
约______ 为( 的二级电离和水的电离忽略不计),若将
的二级电离和水的电离忽略不计),若将 固体溶于水,其溶液的pH
固体溶于水,其溶液的pH______ 7(填“>”“<”或“=”,下同)
②若向 溶液中滴加NaOH溶液,当溶液呈中性时,所得溶液中
溶液中滴加NaOH溶液,当溶液呈中性时,所得溶液中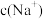
______ 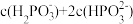 ;若用甲基橙做指示剂达到滴定终点时,所得溶液中
;若用甲基橙做指示剂达到滴定终点时,所得溶液中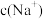
______ 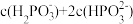
(1)25℃有pH=2的醋酸(编号为甲)和pH=2的盐酸(编号为乙):
①取10mL甲溶液,加入少量无水醋酸钠固体,待固体溶解后溶液中
 的值将
的值将②相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲)
③各取25mL甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)
④取25mL甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中
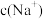 、
、 的大小关系为:
的大小关系为: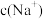
 (填“大于”“小于”或“等于”)
(填“大于”“小于”或“等于”)(2)已知亚磷酸(
 )是二元中强酸,某温度下,0.l
)是二元中强酸,某温度下,0.l 的
的 溶液的pH为2。
溶液的pH为2。①该温度下
 的电离平衡常数
的电离平衡常数 约
约 的二级电离和水的电离忽略不计),若将
的二级电离和水的电离忽略不计),若将 固体溶于水,其溶液的pH
固体溶于水,其溶液的pH②若向
 溶液中滴加NaOH溶液,当溶液呈中性时,所得溶液中
溶液中滴加NaOH溶液,当溶液呈中性时,所得溶液中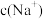
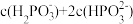 ;若用甲基橙做指示剂达到滴定终点时,所得溶液中
;若用甲基橙做指示剂达到滴定终点时,所得溶液中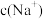
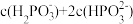
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。
① 若氨水的浓度为2.0 mol·L-1,溶液中的c(OH−)=_________________ mol·L−1。
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的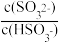 =
=______ ;(NH4)2SO3溶液中的质子守恒____________ 。
(2)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:

①试分析图中a、b、c、d四个点,水的电离程度最大的是_________ ;
②在b点,溶液中各离子浓度由大到小的排列顺序是___________ ;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH4+)=____________ ,c(H+)- c(NH3·H2O)=____________ ;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是______ 。
(1)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。
① 若氨水的浓度为2.0 mol·L-1,溶液中的c(OH−)=
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的
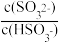 =
=(2)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:

①试分析图中a、b、c、d四个点,水的电离程度最大的是
②在b点,溶液中各离子浓度由大到小的排列顺序是
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH4+)=
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】现有等体积、等浓度的① 、②
、② 、③
、③ 三种溶液,回答下列问题。
三种溶液,回答下列问题。
(1)三种溶液中铵根离子浓度由大到小的顺序为___________ (用序号表示,用>连接)。
(2)写出溶液①显酸性的原因___________ (用离子方程式表示)。
(3)写出溶液①的电荷守恒___________ (用离子浓度表示);该溶液中离子浓度由大到小的顺序为___________ (用离子浓度表示,用>连接)
(4)写出溶液③的物料守恒___________ (用离子浓度表示)。
 、②
、② 、③
、③ 三种溶液,回答下列问题。
三种溶液,回答下列问题。(1)三种溶液中铵根离子浓度由大到小的顺序为
(2)写出溶液①显酸性的原因
(3)写出溶液①的电荷守恒
(4)写出溶液③的物料守恒
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________ NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为________ ;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积________ 氨水的体积(填“>”“=”或“<”);
(4)等体积的NH4HSO4溶液与NaOH溶液混合呈中性,则原c(NH4HSO4 )________ 原c(NaOH)(填“>”“=”或“<”),混合后溶液中c(SO42-)_________ c(NH4+) (填“>”“=”或“<”)。
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积
(4)等体积的NH4HSO4溶液与NaOH溶液混合呈中性,则原c(NH4HSO4 )
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】根据以下信息回答下列问题。
Ⅰ.盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
Ⅱ.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用盐酸除去。
(1)请用离子方程式表示盐碱地产生碱性的原因:_______________________ ;
(2)请用化学方程式表示加入石膏降低土壤碱性的反应原理_______________ ;
(3)请写出水垢悬浊液中CaSO4溶解平衡的离子方程式____________________ ;
(4)请分析水垢中的CaSO4转化为CaCO3的原理__________________________ ;
(5)请写出CaCO3溶于过量盐酸的离子方程式___________________________ 。
Ⅰ.盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
Ⅱ.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用盐酸除去。
(1)请用离子方程式表示盐碱地产生碱性的原因:
(2)请用化学方程式表示加入石膏降低土壤碱性的反应原理
(3)请写出水垢悬浊液中CaSO4溶解平衡的离子方程式
(4)请分析水垢中的CaSO4转化为CaCO3的原理
(5)请写出CaCO3溶于过量盐酸的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】I.SO2是造成空气污染的主要原因之一,可以Na2SO3溶液为吸收液除SO2。
(1)该反应的离子方程式是_____________________________________________________ 。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_______________________________________________________________________ 。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________________ 。
(4)往Na2SO3稀溶液加入少量KOH固体,完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+) : c(SO32-) 的比值____________ (填“变大”、“变小”或“保持不变”)。
II.工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
(5)写出该反应的化学方程式为_______________________ 。
(6)上述反应中,每减少2.24L气体(标准状况下),转移电子数为_____ 。
(7)上述反应所涉及的3种元素中,原子半径从大到小的排列顺序为_________ ;三种元素非金属性由强到弱的顺序为____________ ;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_____________ 。
(1)该反应的离子方程式是
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是
(4)往Na2SO3稀溶液加入少量KOH固体,完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+) : c(SO32-) 的比值
II.工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
(5)写出该反应的化学方程式为
(6)上述反应中,每减少2.24L气体(标准状况下),转移电子数为
(7)上述反应所涉及的3种元素中,原子半径从大到小的排列顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】有人认为,向 溶液中加入少量冰醋酸,冰醋酸会与
溶液中加入少量冰醋酸,冰醋酸会与 溶液水解产生的
溶液水解产生的 反应,使平衡向水解方向移动,这种说法对吗?为什么
反应,使平衡向水解方向移动,这种说法对吗?为什么_______ 。
 溶液中加入少量冰醋酸,冰醋酸会与
溶液中加入少量冰醋酸,冰醋酸会与 溶液水解产生的
溶液水解产生的 反应,使平衡向水解方向移动,这种说法对吗?为什么
反应,使平衡向水解方向移动,这种说法对吗?为什么
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0.5L混合溶液。
(1)该溶液中存在的平衡体系有____________ ;____________ ;____________ 。
(2)溶液中共有_________ 种微粒。
(3)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是__________________ 。
(4)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________ mol。
(1)该溶液中存在的平衡体系有
(2)溶液中共有
(3)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是
(4)溶液中n(CH3COO-)+n(OH-)-n(H+)=
您最近一年使用:0次


 在工业中有着广泛用途,实验室可利用
在工业中有着广泛用途,实验室可利用 的水解反应制取
的水解反应制取 等)时,其总反应可表示为
等)时,其总反应可表示为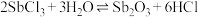 ,为了促进水解反应趋于完全,可采取的措施:
,为了促进水解反应趋于完全,可采取的措施:

