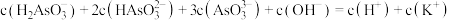下列说法正确的是
| A.将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a |
| B.常温下0.1 mol•L-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A) |
C.室温时 M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b mol•L-1 时,溶液的pH为14 + M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b mol•L-1 时,溶液的pH为14 + 1g 1g |
| D.0.1 mol•L-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
更新时间:2017-05-15 14:06:02
|
相似题推荐
单选题
|
较难
(0.4)
名校
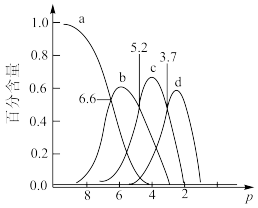
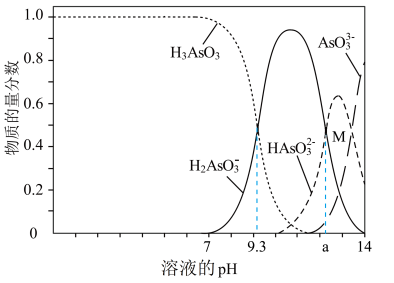
【推荐1】常温下,H3AsO4溶液中各含砷粒子分布分数(平衡时该粒子的浓度与各含砷粒子浓度之和的比)与pH的关系如右图所示。下列说法正确的是
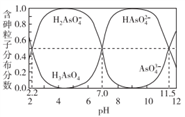

| A.H3AsO4的第一步电离常数Ka1>0.01 |
| B.pH=7.0时.溶液中c(AsO43-)=c(H3AsO4)=0 |
| C.0.1mol·L-1H3AsO4溶液的pH<2 |
| D.pH=12时,c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】 与
与 具有很强的亲和性,当
具有很强的亲和性,当 的浓度过大时,还会形成
的浓度过大时,还会形成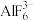 。
。 在一定溶剂中也存在分步电离(溶液中存在
在一定溶剂中也存在分步电离(溶液中存在 、
、 、
、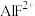 、
、 等含铝的粒子),常温下,实验测定某浓度的
等含铝的粒子),常温下,实验测定某浓度的 中各种含铝的粒子百分含量随
中各种含铝的粒子百分含量随 的变化如图所示,下列说法不正确的是
的变化如图所示,下列说法不正确的是
 与
与 具有很强的亲和性,当
具有很强的亲和性,当 的浓度过大时,还会形成
的浓度过大时,还会形成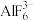 。
。 在一定溶剂中也存在分步电离(溶液中存在
在一定溶剂中也存在分步电离(溶液中存在 、
、 、
、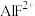 、
、 等含铝的粒子),常温下,实验测定某浓度的
等含铝的粒子),常温下,实验测定某浓度的 中各种含铝的粒子百分含量随
中各种含铝的粒子百分含量随 的变化如图所示,下列说法不正确的是
的变化如图所示,下列说法不正确的是
A.常温下,电离方程式: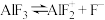 的 的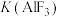 的数量级为 的数量级为 |
B.曲线c表示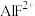 |
C. 时,溶液中 时,溶液中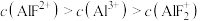 |
D.常温下,向 溶液中加入氟化钠固体, 溶液中加入氟化钠固体,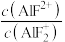 变小 变小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】室温下,在1 mol·L-1的某二元酸H2A溶液中,存在HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法错误的是
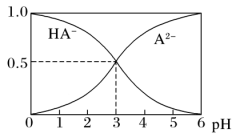

| A.0.1 mol·L-1 NaHA溶液中:c(OH- )>c(H+) |
B.室温下,HA- A2-+ H+的电离平衡常数Ka= 10-3 A2-+ H+的电离平衡常数Ka= 10-3 |
| C.在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA- ) |
D.H2A的电离方程式为H2A=H+ +HA-,HA- A2-+H+ A2-+H+ |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】室温下, 溶液中存在
溶液中存在 、
、 、
、 、
、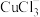 、
、 几种含铜微粒,向
几种含铜微粒,向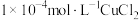 溶液中通入HCl气体,含Cu微粒的分布系数[例如:
溶液中通入HCl气体,含Cu微粒的分布系数[例如: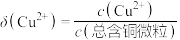 ]随
]随 浓度变化的关系如图所示。
浓度变化的关系如图所示。
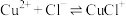




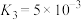
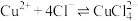
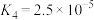
下列说法错误的是
 溶液中存在
溶液中存在 、
、 、
、 、
、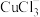 、
、 几种含铜微粒,向
几种含铜微粒,向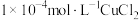 溶液中通入HCl气体,含Cu微粒的分布系数[例如:
溶液中通入HCl气体,含Cu微粒的分布系数[例如: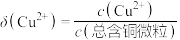 ]随
]随 浓度变化的关系如图所示。
浓度变化的关系如图所示。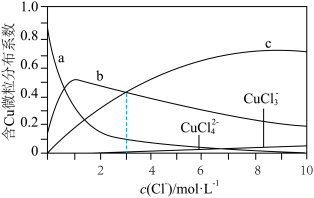
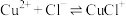




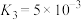
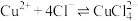
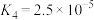
下列说法错误的是
A.曲线a表示 的分布系数随 的分布系数随 浓度的变化 浓度的变化 |
B.室温下反应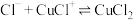 的平衡常数 的平衡常数 |
C.当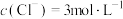 时, 时,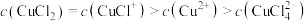 |
D.图像中任意一点均存在 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,下列有关叙述正确的是
A.  溶液与 溶液与  溶液等体积混合,已知混合溶液中 溶液等体积混合,已知混合溶液中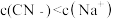 ,则 ,则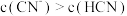 |
B. 的 的 溶液与 溶液与 的 的 溶液等体积混合: 溶液等体积混合: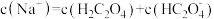 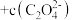 |
C.  的氢氧化钠溶液中加入 的氢氧化钠溶液中加入 的HA溶液至pH刚好等于7,所得溶液体积 的HA溶液至pH刚好等于7,所得溶液体积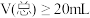 |
D.  溶液和 溶液和  溶液等体积混合: 溶液等体积混合: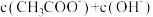 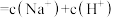 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】298K时,向20mL浓度均为0.1mol/L的MOH和NH3·H2O混合液中滴加0.1mol的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知CH3COOH的Ka=1.8×10-5,NH3·H2O的Kb=1.8×10-5。下列说法错误的是( )
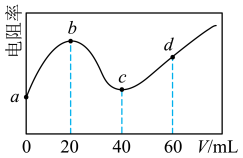

| A.MOH是强碱 |
| B.c点溶液中浓度:c(CH3COOH)<c(NH3·H2O) |
| C.d点溶液呈酸性 |
| D.a→d过程中水的电离程度先增大后减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】证据推理与模型认知是学习化学学科必备的核心素养之一,下列推理不正确的是
A.由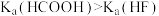 得出相同浓度的HCOONa和NaF两溶液,前者的pH较大 得出相同浓度的HCOONa和NaF两溶液,前者的pH较大 |
B.由常温下相同浓度的 和 和 两溶液等体积混合后pH约为4.7,推出溶液中 两溶液等体积混合后pH约为4.7,推出溶液中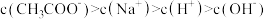 |
C.由FeS溶于稀硫酸,而CuS不溶于稀硫酸,推出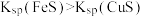 |
D.由粒子原子守恒可知1  溶液中, 溶液中,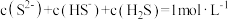 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
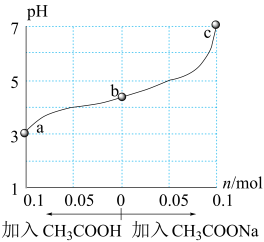

| A.b点混合液中c(Na+)>c(CH3COO-) |
B.加入CH3COOH过程中,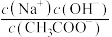 增大 增大 |
| C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w |
| D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b |
您最近一年使用:0次
【推荐1】已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3)。某温度下,饱和溶液中-lg[c( )]、-lg[c(
)]、-lg[c( )]与-lg[c(Ba2+)]的关系如图所示。
)]与-lg[c(Ba2+)]的关系如图所示。
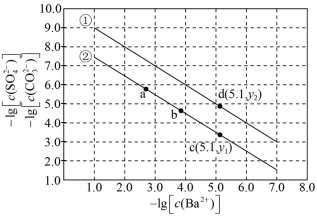
下列说法正确的是
 )]、-lg[c(
)]、-lg[c( )]与-lg[c(Ba2+)]的关系如图所示。
)]与-lg[c(Ba2+)]的关系如图所示。
下列说法正确的是
| A.曲线①代表BaCO3的沉淀溶解曲线 |
| B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10 |
| C.加适量BaCl2固体可使溶液由a点变到b点 |
D.c(Ba2+)=10-5.1 mol/L时,两溶液中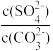 =10 =10 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,某水溶液中二元弱酸 的物质的量浓度为
的物质的量浓度为 ,该溶液中存在
,该溶液中存在 ,通过调节溶液
,通过调节溶液 可使
可使 转化为
转化为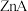 沉淀,体系中
沉淀,体系中 与
与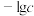 关系如图所示(
关系如图所示( 为
为 、
、 和
和 的浓度,单位为
的浓度,单位为 ),下列说法错误的是
),下列说法错误的是

 的物质的量浓度为
的物质的量浓度为 ,该溶液中存在
,该溶液中存在 ,通过调节溶液
,通过调节溶液 可使
可使 转化为
转化为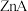 沉淀,体系中
沉淀,体系中 与
与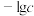 关系如图所示(
关系如图所示( 为
为 、
、 和
和 的浓度,单位为
的浓度,单位为 ),下列说法错误的是
),下列说法错误的是
A.线①表示 |
B.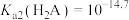 |
C. 的溶液中 的溶液中 |
D. 的溶液中 的溶液中 |
您最近一年使用:0次
单选题
|
较难
(0.4)
真题
名校
【推荐3】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
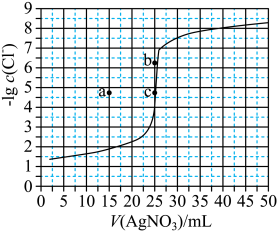
| A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 |
| B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) |
| C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a |
| D.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动 |
您最近一年使用:0次

 时,溶液中:
时,溶液中: