室温时,将浓度和体积分别为c1、Vl的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的的
| A.若V1= V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
| B.在任何情况下都是 c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1 = V2,一定是c2>c1 |
| D.若pH>7,则一定是c1V1= c2V2 |
更新时间:2017-12-14 14:49:14
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
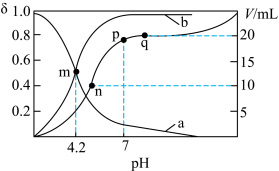
【推荐1】 为二元弱酸,常温下将
为二元弱酸,常温下将 的
的 溶液滴入
溶液滴入 的
的 溶液中,溶液中
溶液中,溶液中 (或
(或 )的分布系数
)的分布系数 、
、 溶液体积V与pH的关系如图所示。[已知:
溶液体积V与pH的关系如图所示。[已知: ]。下列叙述错误的是
]。下列叙述错误的是
 为二元弱酸,常温下将
为二元弱酸,常温下将 的
的 溶液滴入
溶液滴入 的
的 溶液中,溶液中
溶液中,溶液中 (或
(或 )的分布系数
)的分布系数 、
、 溶液体积V与pH的关系如图所示。[已知:
溶液体积V与pH的关系如图所示。[已知: ]。下列叙述错误的是
]。下列叙述错误的是
A.曲线b表示的是 的分布系数变化曲线 的分布系数变化曲线 |
B. 的第二步电离平衡常数 的第二步电离平衡常数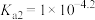 |
C.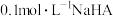 溶液中 溶液中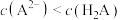 |
D.n点时, |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,下列有关电解质溶液说法正确的是( )
| A.1.0mol/L NH4HCO3溶液pH=8.0,由此可知Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3) |
B.向氨水中加入NH4C1固体,溶液中 增大 增大 |
| C.向CH3COONa溶液中滴加硫酸至中性时,c(SO42ˉ)<c(CH3COOH) |
D.下图中曲线可以表示100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH变化情况(溶液体积变化忽略不计)。 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
| A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3) |
| B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-) |
| C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-) |
| D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25 °C时,向一定浓度的正盐Na2X溶液中逐滴加入盐酸,溶液的pH与pY (pY= -lgY,Y表示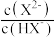 或
或 关系如图所示。
关系如图所示。
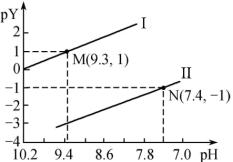
下列说法错误的是
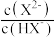 或
或 关系如图所示。
关系如图所示。
下列说法错误的是
A.曲线I表示pH与p 的变化关系 的变化关系 |
| B.NaHX溶液中c(H+)> c(OH- ) |
| C.Ka1(H2X)= 1.0 × 10-6.4 |
| D.当溶液呈中性时,c(Na+) = c(HX- )+2c(X2- )+c(Cl -) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】室温下,用相同浓度的KOH溶液,分别滴定浓度均为0.1 mol·L−1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断正确的是


| A.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(H+)+c(OH−) |
| B.滴定至P点时,溶液中:c(K+)> c(A−)> c(HA)> c(H+)> c(OH−) |
| C.同浓度的KA、KB、KD三种盐溶液的pH大小关系:pH(KD)< pH(KB)< pH(KA) |
| D.当三种酸都中和至中性时,消耗KOH溶液的体积的大小关系为:V(HA) > V(HB) > V(HD) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】电位滴定是利用溶液电位突变指示终点的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。常温下,用 盐酸标准溶液测定xmL某纯碱样品溶液中
盐酸标准溶液测定xmL某纯碱样品溶液中 的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是
的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是

 盐酸标准溶液测定xmL某纯碱样品溶液中
盐酸标准溶液测定xmL某纯碱样品溶液中 的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是
的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说法错误的是
A.水的电离程度: |
B.a点溶液中: ,c点溶液中滴入2滴甲基橙溶液一定变黄色 ,c点溶液中滴入2滴甲基橙溶液一定变黄色 |
C.xmL该纯碱样品溶液中含有 的质量为0.084cg 的质量为0.084cg |
D.b到c过程中存在 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】工业生产中,向Na2CO3溶液中通入SO2气体制备无水Na2SO3,水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布、Na2SO3的溶解度曲线如图所示:
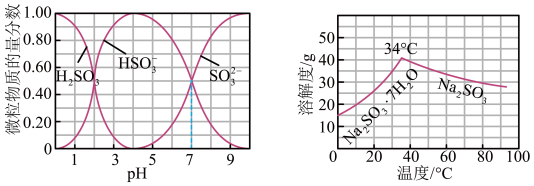
下列说法不正确 的是:

下列说法
| A.溶液pH=4时,溶质为NaHSO3 |
B.溶液pH=10时,c (Na+)+ c(H+)= c(OH–)+ c(SO32–)+ c(HSO3–) (Na+)+ c(H+)= c(OH–)+ c(SO32–)+ c(HSO3–) |
| C.溶液pH=7时, c(SO32–)= c(HSO3–) |
| D.溶液pH=10时,停止通入SO2,将溶液加热浓缩至有大量晶体析出,在高于34℃趁热过滤、洗涤、干燥得到无水Na2SO3 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】用亚硫酸盐(X)吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数(δ)与溶液pH的变化关系如下图所示。下列说法中不正确 的是


| A.若X为Na2SO3,当吸收液pH=1.85时:c(Na+)=c(HSO3-)+c(H2SO3) |
| B.若X为Na2SO3,当吸收液呈中性时:2c(SO32-)+c(HSO3-)=c(Na+) |
| C.若X为 (NH4)2SO3,(NH4)2SO3溶液呈碱性,说明水解程度:SO32-> NH4+ |
| D.若X为 (NH4)2SO3,图中b点溶液中n(HSO3-)∶n(NH4+)= 1∶3 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种仪器分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生突跃,进而确定滴定终点。现利用盐酸滴定某溶液中碳酸钠含量,其电位滴定曲线如图所示。下列说法错误的是


| A.该滴定过程中不需任何指示剂 | B.b点溶液呈酸性 |
C.a到b之间存在: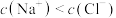 | D.a点溶液中的主要成分为两种盐 |
您最近一年使用:0次

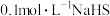 溶液中滴加几滴酚酞试剂,溶液变红
溶液中滴加几滴酚酞试剂,溶液变红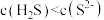
 溶液中加水稀释,溶液的
溶液中加水稀释,溶液的 升高
升高 的电离
的电离 溶液中通入少量氯气,有乳白色浑浊产生
溶液中通入少量氯气,有乳白色浑浊产生
 溶液,再滴加
溶液,再滴加 溶液,溶液变红
溶液,溶液变红 与
与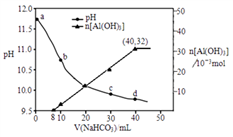
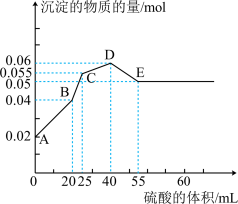
 三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加
三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加 的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是
的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是