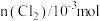氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
则该反应的△H=______________ 。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
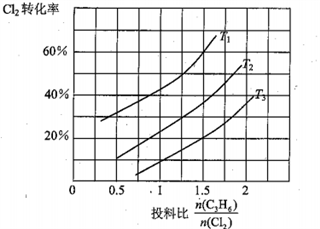
①该反应的△H______________ 0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________ mol·〔L·min)-1,平衡常数K为______________ ,保持温度不变,减小投料比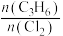 ,K值将
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________ 。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________ 。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
| 化学键 | H-Cl | O=O | Cl – Cl | H-O |
| E(kJ·mol-1 | a | b | c | d |
则该反应的△H=
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g)
 CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
①该反应的△H
②下列措施能增大丙烯的平衡转化率的是
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为
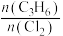 ,K值将
,K值将④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是
更新时间:2018-03-29 20:47:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
І.二氧化碳利用
途径一:与氢气反应制甲醇CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
(1)该反应的∆H =_______
(2)总反应在起始物n(H2):n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下x(CH3OH)~t的如图所示。

图中对应等压过程的曲线是_______ ,判断的理由是_______ ;
途径二:与甲烷重整制氢
主反应: ①CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1=+ 247kJ/mol
2CO(g)+2H2(g) ∆H1=+ 247kJ/mol
副反应:②CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
③CH4(g) C(s)+2H2(g) ∆H3= +75kJ/mol
C(s)+2H2(g) ∆H3= +75kJ/mol
④2CO(g) CO2(g)+C(s) ∆H4 = -172kJ/mol
CO2(g)+C(s) ∆H4 = -172kJ/mol
⑤CO(g)+H2(g) H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
(4)目前商业化的CH4/H2O重整Ni基催化剂适合在高水碳比(3.0~5.0)条件下进行,在低水碳比条件下极易积炭,主要积炭反应为上述反应③(CH4裂解)、④(CO歧化)对积炭反应进行计算,得到温度和压强对积炭反应中平衡炭量的影响图(图a和图b),其中表示温度和压强对CH4的裂解反应中平衡炭量影响的是_______ (“图a”或“图b”),选择在高水碳比条件下进行的理由是_______ 。

Ⅱ.二氧化碳来源
汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。
在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) 。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g) 。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
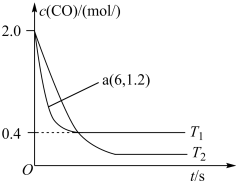
(5)反应速率 v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),k正、k逆 分别为正、逆反应速率常数,计算a处v正:v逆=_______ 。
І.二氧化碳利用
途径一:与氢气反应制甲醇CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
| H—H | C—H | C—O | C=O | O—H | |
| 键能kJ/mol | 436 | 415 | 326 | 803 | 464 |
(2)总反应在起始物n(H2):n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下x(CH3OH)~t的如图所示。

图中对应等压过程的曲线是
途径二:与甲烷重整制氢
主反应: ①CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1=+ 247kJ/mol
2CO(g)+2H2(g) ∆H1=+ 247kJ/mol副反应:②CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2③CH4(g)
 C(s)+2H2(g) ∆H3= +75kJ/mol
C(s)+2H2(g) ∆H3= +75kJ/mol④2CO(g)
 CO2(g)+C(s) ∆H4 = -172kJ/mol
CO2(g)+C(s) ∆H4 = -172kJ/mol ⑤CO(g)+H2(g)
 H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。
| A.增大CO2与CH4的浓度,反应①、②、③的正反应速率都增加 |
| B.移去部分C(s),反应③、④、⑤的平衡均向右移动 |
| C.加入反应①的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应①~⑤的正、逆反应速率都减小 |

Ⅱ.二氧化碳来源
汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。
在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g) 。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g) 。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
(5)反应速率 v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),k正、k逆 分别为正、逆反应速率常数,计算a处v正:v逆=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】现代社会活动需要利用化学反应中的物质和能量变化。
Ⅰ.化学能与热能
下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题:
(1)以上物质中最不稳定的是___________ 。
(2)按照反应 ,生成2mol HCl
,生成2mol HCl_________ (填“吸收”或“放出”)的热量为_________ kJ。根据能量守恒定律,反应物的总能量应该___________ 其生成物的总能量(填“大于”或“小于”)。
Ⅱ.化学能与电能
(3)把A、B、C、D四种金属按表中装置进行实验。
根据表中信息判断四种金属活动性由大到小的顺序是________________ 。
(4)“乙醇燃料电池”的工作原理为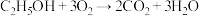 ,装置如图所示。
,装置如图所示。 的移动方向为由
的移动方向为由_______ (填“A到B”或“B到A”)。写出A电极的电极反应式:_____________ 。
②若标况下有11.2L 参与反应,理论上通过质子交换膜的
参与反应,理论上通过质子交换膜的 数目为
数目为_______ 。
Ⅰ.化学能与热能
下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题:
物质 |
|
|
|
| HCl |
键能/kJ | 243 | 193 | 151 | 436 | 432 |
(1)以上物质中最不稳定的是
(2)按照反应
 ,生成2mol HCl
,生成2mol HClⅡ.化学能与电能
(3)把A、B、C、D四种金属按表中装置进行实验。
装置 |
|
|
|
A表面有气泡 | B电极的质量增加 | 电子由A到D |
(4)“乙醇燃料电池”的工作原理为
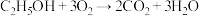 ,装置如图所示。
,装置如图所示。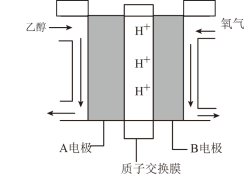
 的移动方向为由
的移动方向为由②若标况下有11.2L
 参与反应,理论上通过质子交换膜的
参与反应,理论上通过质子交换膜的 数目为
数目为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】硫元素的单质及其化合物在科学研究、工农业生产、农药的制备与使用等方面具有广泛用途。请
根据以下应用回答有关问题:
(1)已知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式___________ 。
(2)绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);____________ 。
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式_________________ 。
(3)科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:
根据有关反应原理写出硫化羰气体与水蒸气反应生成CO2和H2S的热化学方程式:______________ .
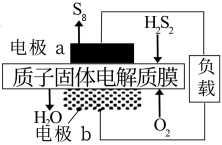
(4)S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。
①H2S2的名称是________ 。
②电极b为________ (选填“正极”、 “负极”)。
③电极a上发生的电极反应为:_______________ 。
(5)一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。
该制备反应的化学方程式为________ ;
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式_____________________ 。
根据以下应用回答有关问题:
(1)已知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式
(2)绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式
(3)科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:
| 共价键 | C=O | C=S | H—O | H—S |
| 键能/kJ.mol-1 | 745 | 536 | 464 | 339 |
(4)S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。
①H2S2的名称是
②电极b为
③电极a上发生的电极反应为:
(5)一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。
该制备反应的化学方程式为
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.现有下列4种重要的有机物:
① ②
② ③
③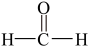 ④
④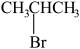
请回答:
(1)能与苯酚缩合成高分子化合物的是__________ 。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________ 。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________ 。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____ 。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______ 。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2O⇌HCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________ 。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH−)=______ mol·L-1。
①
 ②
② ③
③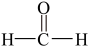 ④
④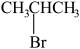
请回答:
(1)能与苯酚缩合成高分子化合物的是
(2)能使酸性高锰酸钾溶液褪色的是
(3)写出④在一定条件下发生消去反应的化学方程式
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是
(3)自来水常用氯气杀菌消毒,Cl2+H2O⇌HCl+HClO,要增大HClO的浓度,可以加入下列物质中的
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH−)=
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示,回答下列问题:
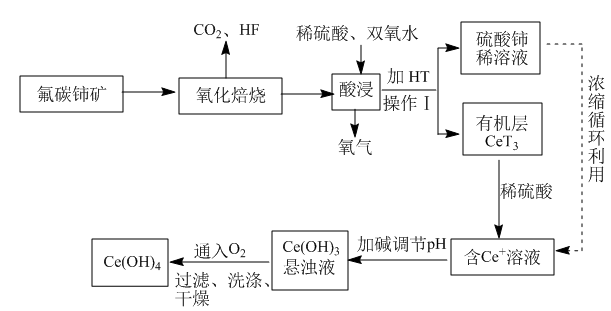
(1)操作Ⅰ的名称为___ 。
(2)氧化焙烧操作不能使用陶瓷容器,原因是_____ (用化学方程式解释)。
(3)焙烧后的产物之一为CeO2,则酸浸时主要反应的离子方程式为__ 。
(4)酸浸时不能用浓盐酸,原因是__ (用化学方程式解释)。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_____ 。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为:Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:
CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:__ 。
(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_____ 。

(1)操作Ⅰ的名称为
(2)氧化焙烧操作不能使用陶瓷容器,原因是
(3)焙烧后的产物之一为CeO2,则酸浸时主要反应的离子方程式为
(4)酸浸时不能用浓盐酸,原因是
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为:Ce3+(水层)+3HT(有机层)
 CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:
CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:
您最近半年使用:0次
【推荐3】某小组从反应速率和产物角度探究Mg与NaHCO3溶液反应。
实验I、25°C, 相同镁条分别与下列试剂反应
(1)已知: Mg(OH)2固体致密,易包裹在金属表面成膜。根据上述现象,推测在实验ii中。
①Mg可以提高 的电离程度,原因是
的电离程度,原因是___________ ;
②浑浊的主要原因是产生了___________ (填化学式) ;
③实验ii中产生气泡的速率快于实验i的原因可能是___________ 。
(2)补充实验II,证实(1)的推测:
①小组设计实验iii 的目的是___________ ; 甲同学结合实验iv的现象认为可以不必进行实验iii,他的理由是___________ ;
②实验ii生成气体的速率快于实验iv,原因可能是___________ ;
③查资料知 +Mg2+
+Mg2+  [Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
[Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因___________ 。
实验I、25°C, 相同镁条分别与下列试剂反应
| 序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
| i | H2O | —— | 7.5 | 7 | 镁条表面有微量气泡附着 |
| ii | NaHCO3溶液 | 1.0 | 7.5 | 8.4 | 镁条表面持续产生大量气泡,溶液略显浑浊,点燃气泡有爆鸣声 |
①Mg可以提高
 的电离程度,原因是
的电离程度,原因是②浑浊的主要原因是产生了
③实验ii中产生气泡的速率快于实验i的原因可能是
(2)补充实验II,证实(1)的推测:
| 序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
| iii | NaNO3溶液 | 1.0 | 7.5 | 7 | 镁条表面有微量气泡附着 |
| iv | Na2CO3溶液 | 0.5 | 7.5 | 11.8 | 持续产生少量气泡,溶液显浑浊 |
②实验ii生成气体的速率快于实验iv,原因可能是
③查资料知
 +Mg2+
+Mg2+  [Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
[Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:________________________ 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=___________ kJ∙mol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=_______ 。
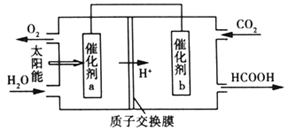
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________ 。
(5)氮氧化物进入水体可转化为 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
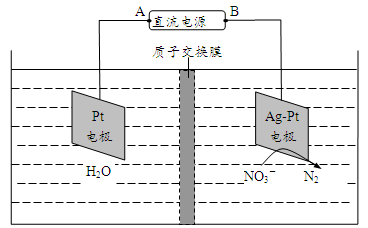
电源正极为_______ (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的 为
为_________ g。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式:
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) ∆H1=-566kJ∙mol-1
②2NO(g)+2CO(g) ⇋N2(g)+ 2CO2(g) ∆H2=-746kJ∙mol-1
则反应N2(g)+ O2(g)= 2NO(g)的∆H=
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K=
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为

(5)氮氧化物进入水体可转化为
 ,电化学降解法可用于治理水中
,电化学降解法可用于治理水中 的污染。原理如图所示。
的污染。原理如图所示。
电源正极为
 为
为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氯氨是常用的饮用水消毒剂,是氯气遇到氨气反应生成的一类化合物,主要包括一氯胺、二氯胺和三氯胺( 、
、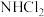 和
和 ),回答下列问题:
),回答下列问题:
(1)①工业上可利用反应 制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的
制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的
_______ 。
②一氯胺是重要的水消毒剂,原因是一氯胺在中性环境中会发生水解,生成具有强烈杀菌消毒作用的物质,该反应的化学方程式_______ 。
(2)用 和
和 反应制备二氯胺的方程式为
反应制备二氯胺的方程式为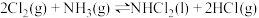 ,向容积均为
,向容积均为 的甲
的甲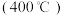 、乙
、乙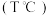 的两个容器中分别加入
的两个容器中分别加入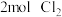 和
和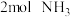 ,测得各容器中
,测得各容器中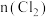 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
①甲容器中, 内用
内用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率
_______ 。
②该反应的
_______ 0(填“>”或“<”)。
③对该反应,下列说法正确的是_______ (填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内 和
和 物质的量之比不变,则表明反应达到平衡状态
物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后其他条件不变,充入一定量氦气, 的转化率增大
的转化率增大
D.反应达到平衡后其他条件不变,加入一定量的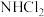 ,平衡向逆反应方向移动
,平衡向逆反应方向移动
(3)恒温条件下,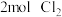 和
和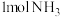 发生反应
发生反应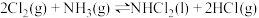 ,测得平衡时
,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
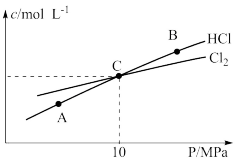
①A、B、C三点中 转化率最高的是
转化率最高的是_______ 点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数
_______ 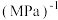 (
( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
 、
、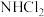 和
和 ),回答下列问题:
),回答下列问题:(1)①工业上可利用反应
 制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的
制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的
| 化学键 |  | 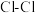 |  |  |
键能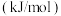 | 391 | 243 | 191 | 431 |
(2)用
 和
和 反应制备二氯胺的方程式为
反应制备二氯胺的方程式为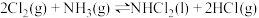 ,向容积均为
,向容积均为 的甲
的甲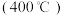 、乙
、乙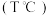 的两个容器中分别加入
的两个容器中分别加入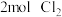 和
和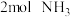 ,测得各容器中
,测得各容器中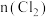 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示: | 0 | 40 | 80 | 120 | 160 |
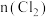 (甲容器)/ (甲容器)/ | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
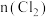 (乙容器)/ (乙容器)/ | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
 内用
内用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率
②该反应的

③对该反应,下列说法正确的是
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内
 和
和 物质的量之比不变,则表明反应达到平衡状态
物质的量之比不变,则表明反应达到平衡状态C.反应达到平衡后其他条件不变,充入一定量氦气,
 的转化率增大
的转化率增大D.反应达到平衡后其他条件不变,加入一定量的
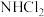 ,平衡向逆反应方向移动
,平衡向逆反应方向移动(3)恒温条件下,
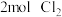 和
和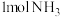 发生反应
发生反应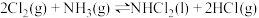 ,测得平衡时
,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中
 转化率最高的是
转化率最高的是②计算C点时该反应的压强平衡常数

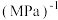 (
( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】近年来,随着聚酯工业的快速发展,Cl2的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化法(称作Deacon反应):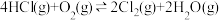 。
。
用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=_______ (用△H1和△H2表示)
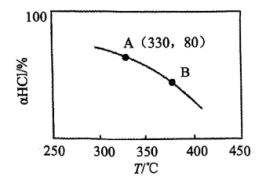
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。
①下列说法能说明Deacon反应在此条件下到达平衡状态的有________ 。
A.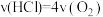 B.H2O的质量分数不变
B.H2O的质量分数不变
C. 不变 D.
不变 D. 不变
不变
②Deacon反应的△H________ 0(填“>”、“=”或“<”,下同),A、B两点的平衡常数K(A)与K(B)的大小关系是K(A)________ K(B)。
③Deacon反应在A点的平衡常数K=________ 。
④保持温度及投料比不变,提高HCl的平衡转化率的方法有________ 。(写出2种)
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图__________ 。
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
2.0~6.0min内以HCl的物质的量变化表示的反应速率为_______ mol·min-1。
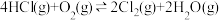 。
。用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。

①下列说法能说明Deacon反应在此条件下到达平衡状态的有
A.
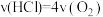 B.H2O的质量分数不变
B.H2O的质量分数不变C.
 不变 D.
不变 D. 不变
不变②Deacon反应的△H
③Deacon反应在A点的平衡常数K=
④保持温度及投料比不变,提高HCl的平衡转化率的方法有
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| 0 | 1.8 | 3.7 | 5.4 | 7.2 |
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.恒温下,在容积为2L的恒容密闭容器A中通入 与
与 的混合气体,发生如下反应:
的混合气体,发生如下反应: ,
, ,一段时间后,达到平衡,若平衡时氨气的物质的量为
,一段时间后,达到平衡,若平衡时氨气的物质的量为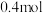 。
。
(1)此温度时该反应的K值为___________ 。
(2)若在此温度下,向另一容积为1L的恒容容器B中按物质的量分别为 、
、 、
、 充入
充入 、
、 、
、 ,此时,该反应是否处于平衡状态
,此时,该反应是否处于平衡状态___________ (填“是”或“否”),此时
___________ 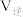 。(填“>”或“<”或“=”)
。(填“>”或“<”或“=”)
Ⅱ.甲醛( )是一种用途非常广泛的化工原料,其制备方法多样。
)是一种用途非常广泛的化工原料,其制备方法多样。
方法:(氧化法)
(脱氢法)
(3)已知: ,则
,则
___________ 。
(4)已知甲醇脱氢制甲醛过程中,副反应的产物主要是 等。
等。 可做该反应的催化剂,有研究指出,催化反应的部分机理如下:
可做该反应的催化剂,有研究指出,催化反应的部分机理如下:
历程i: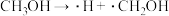
历程ii: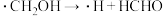
历程iii:
历程iv: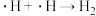
如图表示一定条件下 催化甲醇脱氢制甲醛的反应中,甲醇的转化率、甲醛的选择性(选择性越大,表示生成该物质越多)、甲醇生成甲醛的转化率随温度的变化关系,回答下列问题:
催化甲醇脱氢制甲醛的反应中,甲醇的转化率、甲醛的选择性(选择性越大,表示生成该物质越多)、甲醇生成甲醛的转化率随温度的变化关系,回答下列问题:

①从平衡角度解析550~650℃甲醇生成甲醛的转化率随温度升高的原因___________ 。
②温度高于650℃后,甲醛选择性迅速下降的原因可能是___________ 。
 与
与 的混合气体,发生如下反应:
的混合气体,发生如下反应: ,
, ,一段时间后,达到平衡,若平衡时氨气的物质的量为
,一段时间后,达到平衡,若平衡时氨气的物质的量为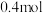 。
。(1)此温度时该反应的K值为
(2)若在此温度下,向另一容积为1L的恒容容器B中按物质的量分别为
 、
、 、
、 充入
充入 、
、 、
、 ,此时,该反应是否处于平衡状态
,此时,该反应是否处于平衡状态
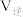 。(填“>”或“<”或“=”)
。(填“>”或“<”或“=”) Ⅱ.甲醛(
 )是一种用途非常广泛的化工原料,其制备方法多样。
)是一种用途非常广泛的化工原料,其制备方法多样。方法:(氧化法)

(脱氢法)

(3)已知:
 ,则
,则
(4)已知甲醇脱氢制甲醛过程中,副反应的产物主要是
 等。
等。 可做该反应的催化剂,有研究指出,催化反应的部分机理如下:
可做该反应的催化剂,有研究指出,催化反应的部分机理如下:历程i:
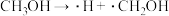
历程ii:
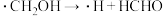
历程iii:

历程iv:
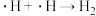
如图表示一定条件下
 催化甲醇脱氢制甲醛的反应中,甲醇的转化率、甲醛的选择性(选择性越大,表示生成该物质越多)、甲醇生成甲醛的转化率随温度的变化关系,回答下列问题:
催化甲醇脱氢制甲醛的反应中,甲醇的转化率、甲醛的选择性(选择性越大,表示生成该物质越多)、甲醇生成甲醛的转化率随温度的变化关系,回答下列问题:
①从平衡角度解析550~650℃甲醇生成甲醛的转化率随温度升高的原因
②温度高于650℃后,甲醛选择性迅速下降的原因可能是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径。
(1)CO2催化加氢能合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为
C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为________ (填化学式)。
(2)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
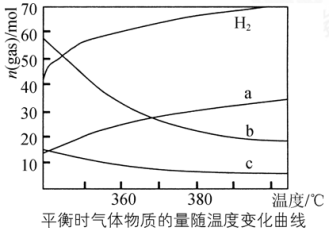
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。
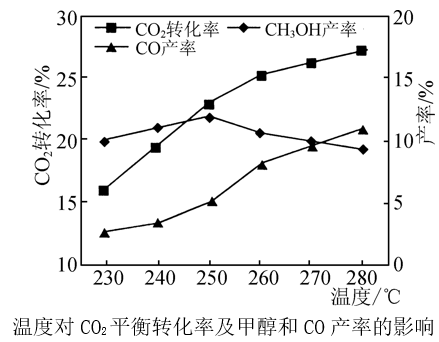
①由图可知温度升高CO的产率上升,其主要原因可能是_____ 。
②由图可知获取CH3OH最适宜的温度是________ ,下列措施有利于提高CO2转化为CH3OH的平衡转化率的有________ (填字母)。
A. 使用催化剂
B. 增大体系压强
C. 增大CO2和H2的初始投料比
D. 投料比和容器体积不变,增加反应物的浓度
(3)在恒温恒容条件下,反应A达到平衡的标志有_____
A. 容器中气体压强不再发生变化
B. 容器中气体密度不再发生变化
C. 容器中气体颜色不再发生变化
D. 容器中气体平均摩尔质量不再发生变化
(4)由CO2制取C的太阳能工艺如图所示。“热分解系统”发生的反应为2Fe3O4 6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为
6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为_____ ;“重整系统”发生反应的化学方程式为___ 。

(1)CO2催化加氢能合成低碳烯烃:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为
C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为
(2)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)反应B:CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。

①由图可知温度升高CO的产率上升,其主要原因可能是
②由图可知获取CH3OH最适宜的温度是
A. 使用催化剂
B. 增大体系压强
C. 增大CO2和H2的初始投料比
D. 投料比和容器体积不变,增加反应物的浓度
(3)在恒温恒容条件下,反应A达到平衡的标志有
A. 容器中气体压强不再发生变化
B. 容器中气体密度不再发生变化
C. 容器中气体颜色不再发生变化
D. 容器中气体平均摩尔质量不再发生变化
(4)由CO2制取C的太阳能工艺如图所示。“热分解系统”发生的反应为2Fe3O4
 6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为
6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】工业上常以水煤气( 和
和 )为原料合成甲醇。
)为原料合成甲醇。
(1)已知: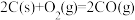


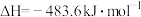
则 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为_______ 。
(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式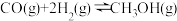
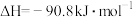 。以下各项能说明该反应达到平衡状态的是
。以下各项能说明该反应达到平衡状态的是_______ 。
A.混合气体的密度保持不变 B.容器内总压强保持不变
C.CO的体积分数保持不变 D.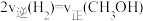
(3)在2L恒容容器中,分别在 、
、 两种温度下模拟工业合成甲醇。两种温度下不同
两种温度下模拟工业合成甲醇。两种温度下不同 和CO起始组成比
和CO起始组成比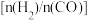 与CO平衡转化率的关系如图所示:
与CO平衡转化率的关系如图所示:
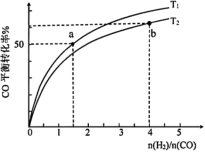
①温度
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 时,往恒容容器中充入
时,往恒容容器中充入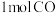 、
、 ,经过
,经过 达到平衡,则
达到平衡,则 内用
内用 表示的反应速率为
表示的反应速率为
_______ ,反应平衡常数
_______ 。
③b点CO平衡转化率比a点高的原因是_______ 。
 和
和 )为原料合成甲醇。
)为原料合成甲醇。(1)已知:
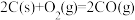


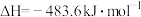
则
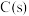 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式
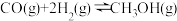
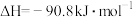 。以下各项能说明该反应达到平衡状态的是
。以下各项能说明该反应达到平衡状态的是A.混合气体的密度保持不变 B.容器内总压强保持不变
C.CO的体积分数保持不变 D.
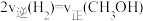
(3)在2L恒容容器中,分别在
 、
、 两种温度下模拟工业合成甲醇。两种温度下不同
两种温度下模拟工业合成甲醇。两种温度下不同 和CO起始组成比
和CO起始组成比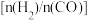 与CO平衡转化率的关系如图所示:
与CO平衡转化率的关系如图所示:
①温度

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 时,往恒容容器中充入
时,往恒容容器中充入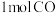 、
、 ,经过
,经过 达到平衡,则
达到平衡,则 内用
内用 表示的反应速率为
表示的反应速率为

③b点CO平衡转化率比a点高的原因是
您最近半年使用:0次