25 ℃时,几种弱酸的电离常数如下:
25 ℃时,下列说法正确的是
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L |
11-12高三上·浙江绍兴·阶段练习 查看更多[15]
安徽省枞阳县浮山中学2019-2020学年高二下学期开学考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——弱电解质的电离及影响因素 (强化练习)安徽省滁州市定远县育才学校2019-2020学年高二上学期期末考试(实验班)化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期期末考试化学试题【校级联考】湖北省宜昌市协作体2018-2019学年高二上学期期末考试化学试题人教版高二化学选修4 第三章离子浓度大小比较重点难点专题2017-2018学年河南省林州市第一中学高二下学期开学考试---化学试题宁夏育才中学学益校区2017-2018学年高二12月月考化学试题四川省邻水实验学校2017-2018学年高二上学期第三次月考化学试题(已下线)2012届浙江省绍兴一中高三上学期回头考试化学试卷2016-2017学年吉林省长春实验中学高二上9月月考化学卷2015届湖南省岳阳市高三教学质量检测化学试卷(已下线)2013-2014江苏省扬州中学高三模拟考试化学试卷(已下线)2014届江苏省如东县高三上学期期末四校联考化学试卷(已下线)2012届湖北省普通高等学校招生5月适应性考试化学试卷
更新时间:2020-01-23 18:59:45
|
相似题推荐
单选题
|
较难
(0.4)
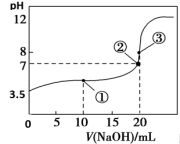
【推荐1】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )
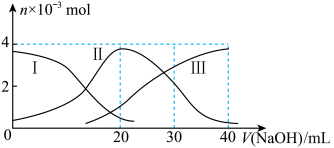

A.H2A在水中的电离方程式是:H2A=H++HA-、HA- H++A2- H++A2- |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性 |
| C.当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-) |
| D.当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,用 溶液滴定同浓度的
溶液滴定同浓度的 溶液,
溶液, 被滴定分数
被滴定分数 、pH及微粒分布分数
、pH及微粒分布分数 [
[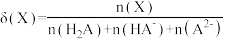 ,X表示
,X表示 、
、 或
或 ]的关系如图所示:
]的关系如图所示:
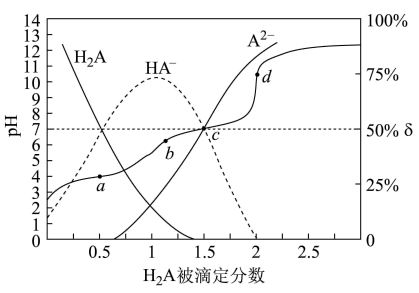
下列说法错误的是
 溶液滴定同浓度的
溶液滴定同浓度的 溶液,
溶液, 被滴定分数
被滴定分数 、pH及微粒分布分数
、pH及微粒分布分数 [
[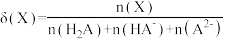 ,X表示
,X表示 、
、 或
或 ]的关系如图所示:
]的关系如图所示:
下列说法错误的是
A.25℃时, 第一步电离平衡常数 第一步电离平衡常数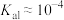 |
B.c点溶液中: |
C.a、b、c、d四点溶液中水的电离程度: |
D.用NaOH溶液滴定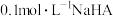 溶液可用甲基橙作指示剂 溶液可用甲基橙作指示剂 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】实验测得浓度均为0.1 mol/L的NaOH溶液,CH3COONa溶液和NH4Cl溶液的pH随温度变化的曲线如图所示。下列说法错误的是
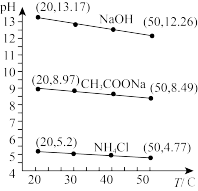

| A.20℃时,纯水的Kw约为10-14.17 |
| B.随温度升高,CH3COONa溶液中的c(OH-)增大 |
| C.随温度升高,NH4Cl溶液的水解平衡正向移动 |
D.50℃时,将CH3COONa和NH4C1配制成pH=7的混合液,溶液中存在:c(CH3COO-)+c(Cl-)=c( )+c(Na+) )+c(Na+) |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,向0.1mol/L弱酸 溶液中逐滴加入过量NaOH溶液,得到溶液中各含磷元素的微粒占总含磷元素微粒的百分数与pH的关系如图所示,下列说法正确的是
溶液中逐滴加入过量NaOH溶液,得到溶液中各含磷元素的微粒占总含磷元素微粒的百分数与pH的关系如图所示,下列说法正确的是
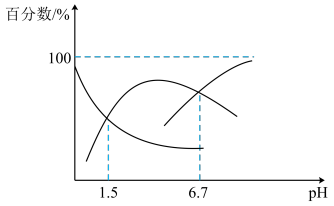
 溶液中逐滴加入过量NaOH溶液,得到溶液中各含磷元素的微粒占总含磷元素微粒的百分数与pH的关系如图所示,下列说法正确的是
溶液中逐滴加入过量NaOH溶液,得到溶液中各含磷元素的微粒占总含磷元素微粒的百分数与pH的关系如图所示,下列说法正确的是
A. 为三元弱酸 为三元弱酸 |
B. 的电离常数 的电离常数 的数量级为 的数量级为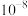 |
C.当 时,横坐标数值为5.2 时,横坐标数值为5.2 |
D. 溶液中, 溶液中, |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】某化工采用稀NaOH 溶液脱除CO2,若碱洗脱除后所得废液的pH 约为13 (已知:相同温度下饱和Na2CO3溶液的pH约为12),则下列说法正确的是
| A.该溶液中:c (OH-) >c (Na+) >c (CO32-)>c(HCO3-)>c (H+) |
| B.该溶液中:c (Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| C.加水稀释该溶液,恢复至原温度,pH增大,Kw不变 |
| D.该溶液pH 约为13 的原因:CO32-+H2O=HCO3-+OH- |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列比较中,正确的是
| A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
B.0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c( )>c(Cl-)>c(Na+)>c(OH-)>c(H+) )>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
D.同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c( )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④ |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐2】25 ℃时,用HCl气体调节0.1 mol·L-1氨水的pH,系统中微粒浓度的对数值(lg c)与pH的关系如图1所示,反应物的物质的量之比[t= ]与pH的关系如图2所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
]与pH的关系如图2所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
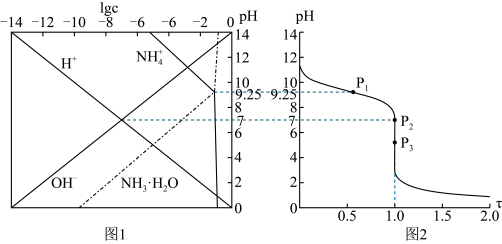
 ]与pH的关系如图2所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是
]与pH的关系如图2所示。若忽略通入气体后溶液体积的变化,下列有关说法正确的是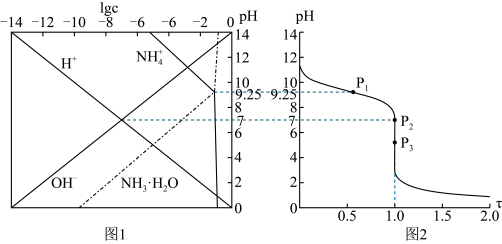
| A.P1所示溶液:c(Cl-)=0.05 mol·L-1 |
| B.P2所示溶液:c(NH3·H2O)<c(OH-)+c(Cl-) |
C.P3所示溶液:c( )+c(NH3·H2O)=c(Cl-)+c(H+) )+c(NH3·H2O)=c(Cl-)+c(H+) |
| D.25 ℃时,NH3·H2O的电离平衡常数为10-9.25 |
您最近半年使用:0次

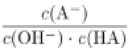 随温度升高不变
随温度升高不变