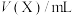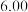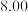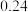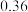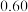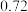解题方法
1 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇: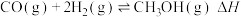
已知:① ;
;
②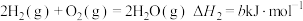 ;
;
③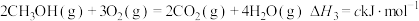
上述反应中的
___________  。
。
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇: ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢: ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。___________ 下(高温、低温、任意温度)自发进行;图示历程包括___________ 个基元反应;其中决速反应是反应___________ (填序号),写出该步反应式:___________ 。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
① (主反应);
(主反应);
② (主反应);
(主反应);
③ (副反应)。
(副反应)。
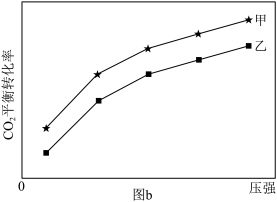
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是___________ ;采用水分子膜分离技术的容器是___________ (填“甲”或“乙”)。 为
为___________  。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
(1)工业上利用合成气合成甲醇:
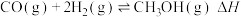
已知:①
 ;
;②
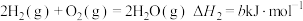 ;
;③
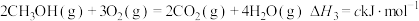
上述反应中的

 。
。(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:
 ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡不移动 |
| C.平衡后再充入0.1molCO和0.1molH2,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:
 ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
①
 (主反应);
(主反应);②
 (主反应);
(主反应);③
 (副反应)。
(副反应)。一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是
 为
为 。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
您最近半年使用:0次
解题方法
2 . 2023年9月23日第19届亚运会在我国杭州正式开幕。开幕式主火炬首次使用了零碳甲醇 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应 ;
;
反应ii: 。
。
(1)反应体系中存在反应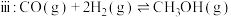 ,则
,则
____________  。
。
(2)将 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为____________ 。(计算结果保留三位有效数字)。
(2) 轴上
轴上 点的数值比
点的数值比 点
点____________ (填“大”或“小”)。
(3)在不同压强下,按照 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和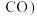 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: 由大到小的顺序为
由大到小的顺序为____________ 。
②曲线____________ (填“ ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。
③在 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
____________ (填含 的表达式)。
的表达式)。
(4)光催化 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
①光催化原理与电解原理类似,写出高能导带的电极反应式:____________ 。
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成____________ (填写微粒名称)参与 的还原再生。
的还原再生。
 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:反应
 ;
;反应ii:
 。
。(1)反应体系中存在反应
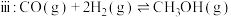 ,则
,则
 。
。(2)将
 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 ,当改变某一外界条件(温度或压强)时,
,当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
变化趋势如图甲所示: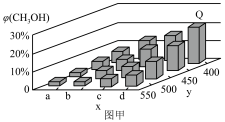
 点
点 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(2)
 轴上
轴上 点的数值比
点的数值比 点
点(3)在不同压强下,按照
 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
的转化率随温度的变化如图乙所示: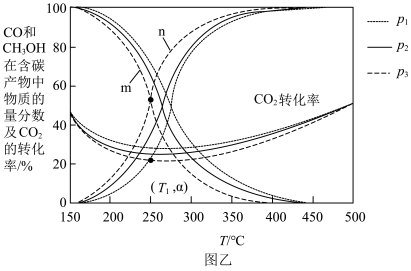
 由大到小的顺序为
由大到小的顺序为②曲线
 ”或“
”或“ ”)代表
”)代表 在含碳产物中的物质的量分数。
在含碳产物中的物质的量分数。③在
 ,压强为
,压强为 时,反应
时,反应 的浓度平衡常数
的浓度平衡常数
 的表达式)。
的表达式)。(4)光催化
 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。①光催化原理与电解原理类似,写出高能导带的电极反应式:
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成
 的还原再生。
的还原再生。
您最近半年使用:0次
2024-04-16更新
|
318次组卷
|
2卷引用:黑龙江省部分学校2024届高三第二次模拟考试化学试题
解题方法
3 . 甲烷的综合利用受到环境和能源领域的关注,是研究的重要课题。
(1)已知下列热化学方程式:
反应i:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1=-164.4kJ/mol
反应ii:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.5kJ/mol
反应iii:CH4(g)+H2O(g)=CO(g)+3H2(g) △H3
则反应iii的△H3=_______ kJ/mol,该反应在_______ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)对于反应iii机理,可认为该反应分两步进行。
第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上;第二步:碳(或碳氢物种)和H2O反应生成CO和H2。反应过程和能量变化图如下:

整个过程中决速的步骤是_______ (填Ⅰ或Ⅱ),其原因是_______ 。
(3)在体积都为2L的多个恒容密闭容器中,分别充入1molCO2和4molH2发生上述反应i(忽略反应ii和iii),在不同温度下反应相同时间,测得lgk(lgk正或lgk逆)、H2转化率与温度关系如图所示。已知该反应的速率方程为v正=k正c(CO2)∙c4(H2),v逆=k逆c(CH4)c2(H2O),其中、k正、k逆为速率常数,只受温度影响。
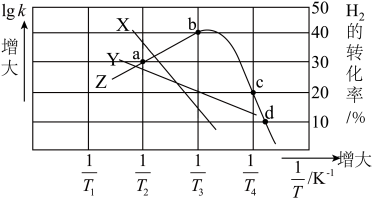
①代表lgk逆曲线的是_______ (填“X”或“Y”)。
②Z曲线上表示一定未达到化学平衡状态的点是_______ 。
③假设T,温度下经过30s反应达到a点状态,H2的平均反应速率为_______ ,该温度下平衡常数计算式为_______ 。
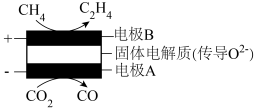
(4)利用某电化学装置可实现CH4和CO2的耦合转化,其原理如图所示。转化过程中阳极反应式为_______ 。
(1)已知下列热化学方程式:
反应i:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H1=-164.4kJ/mol
反应ii:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.5kJ/mol
反应iii:CH4(g)+H2O(g)=CO(g)+3H2(g) △H3
则反应iii的△H3=
(2)对于反应iii机理,可认为该反应分两步进行。
第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上;第二步:碳(或碳氢物种)和H2O反应生成CO和H2。反应过程和能量变化图如下:

整个过程中决速的步骤是
(3)在体积都为2L的多个恒容密闭容器中,分别充入1molCO2和4molH2发生上述反应i(忽略反应ii和iii),在不同温度下反应相同时间,测得lgk(lgk正或lgk逆)、H2转化率与温度关系如图所示。已知该反应的速率方程为v正=k正c(CO2)∙c4(H2),v逆=k逆c(CH4)c2(H2O),其中、k正、k逆为速率常数,只受温度影响。

①代表lgk逆曲线的是
②Z曲线上表示一定未达到化学平衡状态的点是
③假设T,温度下经过30s反应达到a点状态,H2的平均反应速率为
(4)利用某电化学装置可实现CH4和CO2的耦合转化,其原理如图所示。转化过程中阳极反应式为

您最近半年使用:0次
名校
解题方法
4 . 氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用.涉及反应如下:
反应Ⅰ:CO(g)+3H2(g) CH4(g)+H2O(g)
CH4(g)+H2O(g)  =-206.2kJ·mol-1
=-206.2kJ·mol-1
反应Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 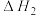
反应Ⅲ:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g) 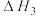 =-165.0kJ·mol-1
=-165.0kJ·mol-1
回答下列问题:
(1)
_____________  。
。
(2)已知反应Ⅱ的速率方程为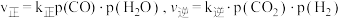 ,其中
,其中 分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数:
分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数: 表示温度的倒数)所示a、b、c、d四条斜线中,能表示
表示温度的倒数)所示a、b、c、d四条斜线中,能表示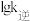 随
随 变化关系的是斜线
变化关系的是斜线__________ (填标号)。 时,在固定容积的容器中充入一定量的
时,在固定容积的容器中充入一定量的 和1molCO,平衡时
和1molCO,平衡时 和CO的转化率(α)及
和CO的转化率(α)及 和
和 的物质的量(n)随
的物质的量(n)随 变化的情况如图所示。
变化的情况如图所示。 变化的曲线分别是
变化的曲线分别是__________ 、__________ (填标号);
_____________ ; 的选择性
的选择性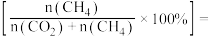
_____________ 。
②已知起始充入1mol的CO和0.5mol的 进行上述反应时,起始压强为
进行上述反应时,起始压强为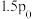 。反应1的
。反应1的
_____________ (用 表示):温度
表示):温度 ,
,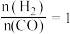 时,
时,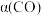 可能对应图中X、Y、Z、W四点中的
可能对应图中X、Y、Z、W四点中的__________ (填标号)。
反应Ⅰ:CO(g)+3H2(g)
 CH4(g)+H2O(g)
CH4(g)+H2O(g)  =-206.2kJ·mol-1
=-206.2kJ·mol-1反应Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g) 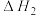
反应Ⅲ:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g) 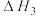 =-165.0kJ·mol-1
=-165.0kJ·mol-1回答下列问题:
(1)

 。
。(2)已知反应Ⅱ的速率方程为
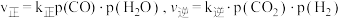 ,其中
,其中 分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数:
分别为正、逆反应的速率常数。如图(lgk表示速率常数的对数: 表示温度的倒数)所示a、b、c、d四条斜线中,能表示
表示温度的倒数)所示a、b、c、d四条斜线中,能表示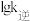 随
随 变化关系的是斜线
变化关系的是斜线
 时,在固定容积的容器中充入一定量的
时,在固定容积的容器中充入一定量的 和1molCO,平衡时
和1molCO,平衡时 和CO的转化率(α)及
和CO的转化率(α)及 和
和 的物质的量(n)随
的物质的量(n)随 变化的情况如图所示。
变化的情况如图所示。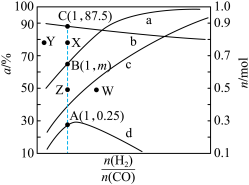
 变化的曲线分别是
变化的曲线分别是
 的选择性
的选择性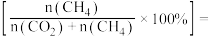
②已知起始充入1mol的CO和0.5mol的
 进行上述反应时,起始压强为
进行上述反应时,起始压强为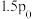 。反应1的
。反应1的
 表示):温度
表示):温度 ,
,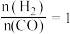 时,
时,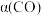 可能对应图中X、Y、Z、W四点中的
可能对应图中X、Y、Z、W四点中的
您最近半年使用:0次
2024-03-15更新
|
356次组卷
|
4卷引用:山东省烟台市2024届高三一模化学试题
山东省烟台市2024届高三一模化学试题2024届山东省高三下学期第一次练兵考试一模化学试题山东省德州市2023-2024学年高三下学期一模考试化学试题(已下线)大题预测卷(辽宁专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
5 . CO2转化为高附加值化学品是科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g) CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1
反应II:CH3CH(CH3)CH3(g) CH2=C(CH3)2(g)+H2(g) ΔH2
CH2=C(CH3)2(g)+H2(g) ΔH2
回答下列问题:
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=___________ 。
(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、k逆为速率常数。
①图中能够代表k逆的曲线为_____ (填“L1”“L2”“L3”或“L4”)。
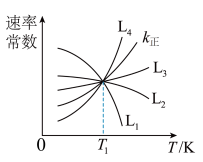
②温度为T1时,该反应的化学平衡常数K=___________ 。
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
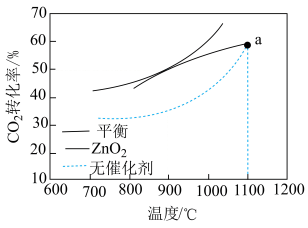
①a点CO2转化率相等的原因是________ 。
②在pMPa、900°C、ZrO2催化条件下,将1molCO2、1molCH4、n molH2O充入密闭容器,CO2的平衡转化率为α,此时压强平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数;写出含α、n、p的计算表达式)。
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:_________ 。
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是________ ,标准状况下,当阳极生成O2的体积为224mL时,测得阴极区内的c(HCOO-)=0.015mol/L,则电解效率_______ 。(忽略电解前后溶液体积的变化)已知:电解效率=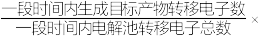 100%。
100%。
反应I:CH3CH(CH3)CH3(g)+CO2(g)
 CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) ΔH1=+165.2kJ·mol-1反应II:CH3CH(CH3)CH3(g)
 CH2=C(CH3)2(g)+H2(g) ΔH2
CH2=C(CH3)2(g)+H2(g) ΔH2回答下列问题:
(1)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1,则ΔH2=(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、k逆为速率常数。
①图中能够代表k逆的曲线为

②温度为T1时,该反应的化学平衡常数K=
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是
②在pMPa、900°C、ZrO2催化条件下,将1molCO2、1molCH4、n molH2O充入密闭容器,CO2的平衡转化率为α,此时压强平衡常数Kp=
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是
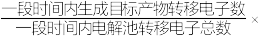 100%。
100%。
您最近半年使用:0次
名校
解题方法
6 . 工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)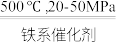 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 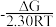 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
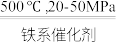 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
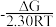 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近半年使用:0次
7 . 当前,实现碳中和已经成为全球的广泛共识,化学科学在此过程中发挥着至关重要的作用。
(1)已知煤的气化过程包含一系列化学反应,热化学方程式如下:
I.

Ⅱ.
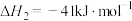
Ⅲ.
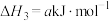
则
___________ 。
(2)一定温度下,若向一恒容密闭容器中通入 和
和 ,发生反应IV:
,发生反应IV:
 。
。
①下列情况表明反应已达到平衡状态的是___________ (填标号)。
A.混合气体的密度保持不变 B.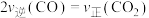
C.混合气体的总压强保持不变 D.混合气体的平均摩尔质量保持不变
②已知 ,
,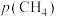 、
、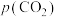 表示各组分的分压(分压=总压×物质的量分数)。反应达到平衡时,
表示各组分的分压(分压=总压×物质的量分数)。反应达到平衡时,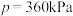 ,此时甲烷的转化率为80%。通过上述信息可知:
,此时甲烷的转化率为80%。通过上述信息可知:
___________  ;
;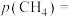
___________ kPa;该温度下的分压平衡常数
___________ (列出计算式即可,用平衡分压代替平衡浓度计算) 。
。
(3)在其他条件相同,不同催化剂(Cat1、Cat2)作用下,使原料 和
和 反应(该条件下发生的反应为反应Ⅳ),相同的时间,
反应(该条件下发生的反应为反应Ⅳ),相同的时间, 的产率随反应温度的变化如图。
的产率随反应温度的变化如图。
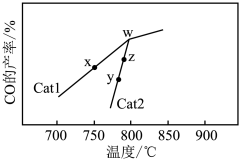
①在催化剂Cat1、Cat2作用下,它们的正、逆反应活化能差值分别用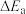 (Cat1)和
(Cat1)和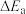 (Cat2)表示,则
(Cat2)表示,则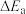 (Cat1)
(Cat1)___________ (填“>”、“<”或“=”)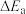 (Cat2)。
(Cat2)。
②y点对应的
___________ (填“>”“<”或“=”)z点对应的 。
。
③在催化剂作用下,有利于提高CO平衡产率的条件是___________ 。(任写一个)
(1)已知煤的气化过程包含一系列化学反应,热化学方程式如下:
I.


Ⅱ.

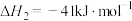
Ⅲ.

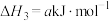
则

(2)一定温度下,若向一恒容密闭容器中通入
 和
和 ,发生反应IV:
,发生反应IV:
 。
。①下列情况表明反应已达到平衡状态的是
A.混合气体的密度保持不变 B.

C.混合气体的总压强保持不变 D.混合气体的平均摩尔质量保持不变
②已知
 ,
,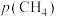 、
、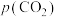 表示各组分的分压(分压=总压×物质的量分数)。反应达到平衡时,
表示各组分的分压(分压=总压×物质的量分数)。反应达到平衡时,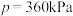 ,此时甲烷的转化率为80%。通过上述信息可知:
,此时甲烷的转化率为80%。通过上述信息可知:
 ;
;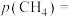

 。
。(3)在其他条件相同,不同催化剂(Cat1、Cat2)作用下,使原料
 和
和 反应(该条件下发生的反应为反应Ⅳ),相同的时间,
反应(该条件下发生的反应为反应Ⅳ),相同的时间, 的产率随反应温度的变化如图。
的产率随反应温度的变化如图。
①在催化剂Cat1、Cat2作用下,它们的正、逆反应活化能差值分别用
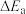 (Cat1)和
(Cat1)和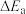 (Cat2)表示,则
(Cat2)表示,则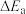 (Cat1)
(Cat1)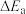 (Cat2)。
(Cat2)。②y点对应的

 。
。③在催化剂作用下,有利于提高CO平衡产率的条件是
您最近半年使用:0次
8 . “氢能源”的开发利用意义重大,乙醇与水催化重整制“氢”发生如下反应。
反应Ⅰ: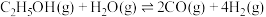

反应Ⅱ:
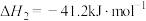
反应Ⅲ:
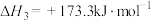
回答下列问题:
(1)反应Ⅰ的
___________ 。
(2)反应Ⅱ的速率 ,其中
,其中 、
、 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时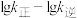
___________ (填“增大”“减小”或“不变”)。
(3)压强为100kPa下, 和
和 发生上述反应,平衡时
发生上述反应,平衡时 和CO的选择性、乙醇的转化率随温度的变化曲线如图。
和CO的选择性、乙醇的转化率随温度的变化曲线如图。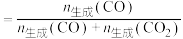 ]
]
①表示CO选择性的曲线是___________ (填标号);
②573K时,生成 的物质的量为
的物质的量为___________ ;
③573K时,反应Ⅱ的标准平衡常数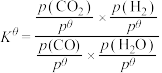 ,其中
,其中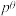 为100kPa,
为100kPa,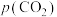 、
、 、
、 和
和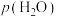 为各组分的平衡分压,则反应Ⅲ的
为各组分的平衡分压,则反应Ⅲ的
___________ (列出计算式即可)。
(4)压强为100kPa, 的平衡产率与温度、起始时
的平衡产率与温度、起始时 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示 相同的平衡产率。
相同的平衡产率。 的平衡产率:Q点
的平衡产率:Q点___________ N点(填“>”、“=”或“<”);
②M、N两点 的平衡产率相等的原因是
的平衡产率相等的原因是___________ 。
反应Ⅰ:
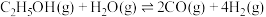

反应Ⅱ:

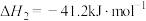
反应Ⅲ:

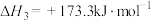
回答下列问题:
(1)反应Ⅰ的

(2)反应Ⅱ的速率
 ,其中
,其中 、
、 分别为正、逆反应速率常数。升高温度时
分别为正、逆反应速率常数。升高温度时
(3)压强为100kPa下,
 和
和 发生上述反应,平衡时
发生上述反应,平衡时 和CO的选择性、乙醇的转化率随温度的变化曲线如图。
和CO的选择性、乙醇的转化率随温度的变化曲线如图。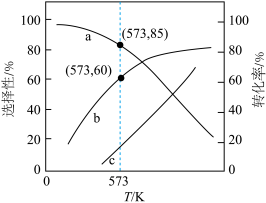
 ]
]①表示CO选择性的曲线是
②573K时,生成
 的物质的量为
的物质的量为③573K时,反应Ⅱ的标准平衡常数
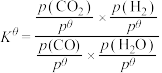 ,其中
,其中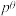 为100kPa,
为100kPa,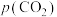 、
、 、
、 和
和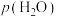 为各组分的平衡分压,则反应Ⅲ的
为各组分的平衡分压,则反应Ⅲ的
(4)压强为100kPa,
 的平衡产率与温度、起始时
的平衡产率与温度、起始时 的关系如图所示,每条曲线表示
的关系如图所示,每条曲线表示 相同的平衡产率。
相同的平衡产率。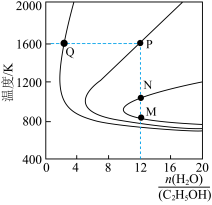
 的平衡产率:Q点
的平衡产率:Q点②M、N两点
 的平衡产率相等的原因是
的平衡产率相等的原因是
您最近半年使用:0次
2024高三下·全国·专题练习
9 . H2S分解反应:H2S(g)⇌H2(g)+ S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
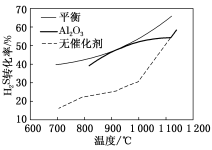
(1)在约1100℃时,无论有无Al2O3催化,H2S转化率几乎相等,这是因为_______ 。
(2)在压强为p、温度为T、Al2O3催化条件下,将H2S(g)、Ar(g)按照物质的量之比为1∶n的比例进行混合,发生热分解反应: ,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实
,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实_______ ,平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
 S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
(1)在约1100℃时,无论有无Al2O3催化,H2S转化率几乎相等,这是因为
(2)在压强为p、温度为T、Al2O3催化条件下,将H2S(g)、Ar(g)按照物质的量之比为1∶n的比例进行混合,发生热分解反应:
 ,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实
,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实
您最近半年使用:0次
名校
解题方法
10 . 铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1) 铁粉与
铁粉与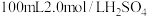 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。 反应平均速率
反应平均速率
_______ 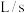 ;
;
② 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:_______ 。
(2)常温下, 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)
(3)反应 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。__________________________________________ ;
②反应过程中由于 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:____________________________________ 。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为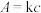 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: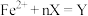 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为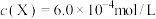 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
根据此数据,可以推断反应计量数 ,并计算
,并计算 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。
已知:1. 为吸光度,无单位;
为吸光度,无单位; 为常数,单位为
为常数,单位为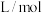 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。
①使用该方法时,需要控制 在2~9之间,其原因为:
在2~9之间,其原因为:____________________ 。
② 中
中 的配位数为
的配位数为_______ 。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下 值为
值为______________ 。
(1)
 铁粉与
铁粉与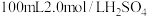 溶液反应,产生
溶液反应,产生 的体积(标准状况下)随时间变化如图。
的体积(标准状况下)随时间变化如图。
 反应平均速率
反应平均速率
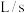 ;
;②
 、
、 、
、 三点反应速率从大到小顺序是:
三点反应速率从大到小顺序是:(2)常温下,
 溶液与
溶液与 溶液反应生成血红色配合物,反应方程式可表示为
溶液反应生成血红色配合物,反应方程式可表示为 ,下列说法正确的是_______。(填标号)
,下列说法正确的是_______。(填标号)A.增大 溶液的浓度,平衡常数增大 溶液的浓度,平衡常数增大 |
B.向上述平衡体系中加入适量 固体,平衡不移动 固体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,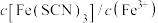 减小 减小 |
(3)反应
 在加入
在加入 催化后,反应进程中的能量变化如下图所示。已知反应机理中有
催化后,反应进程中的能量变化如下图所示。已知反应机理中有 出现。
出现。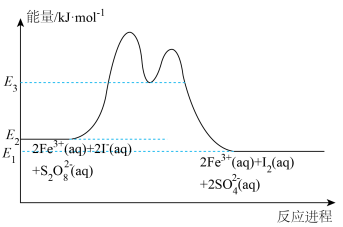
②反应过程中由于
 浓度较低而不容易被检测到,请回答
浓度较低而不容易被检测到,请回答 浓度较低的原因:
浓度较低的原因:(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为
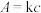 。溶液中
。溶液中 与邻二氮菲(
与邻二氮菲( ,一种双齿配体,其结构见下图)会生成橘黄色的配合物
,一种双齿配体,其结构见下图)会生成橘黄色的配合物 ,反应为:
,反应为: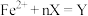 ;取
;取 的溶液,加入不同体积浓度均为
的溶液,加入不同体积浓度均为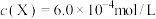 的
的 溶液,充分反应后加水定容至
溶液,充分反应后加水定容至 ,得到系列溶液,测其吸光度,结果如下表:
,得到系列溶液,测其吸光度,结果如下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 ,并计算
,并计算 值,且可利用分光光度法测定未知溶液中
值,且可利用分光光度法测定未知溶液中 的浓度。
的浓度。已知:1.
 为吸光度,无单位;
为吸光度,无单位; 为常数,单位为
为常数,单位为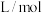 ;
; 为有色物质的物质的量浓度,单位为
为有色物质的物质的量浓度,单位为 (
( 和
和 吸光度近似为0)。
吸光度近似为0)。2.邻二氮菲的结构如图所示: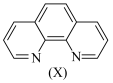
①使用该方法时,需要控制
 在2~9之间,其原因为:
在2~9之间,其原因为:②
 中
中 的配位数为
的配位数为A.2 B.3 C.6 D.8
③该实验条件下
 值为
值为
您最近半年使用:0次