1 . 铁及其化合物在生产、生活中有着广泛的应用。
(1)刻制铜印刷电路板时,要用FeCl3溶液作为“腐蚀液”,发生反应的离子方程式为_______ ,为了将反应后溶液中的Cu2+回收利用,并得到含有一种溶质的溶液,进行的具体操作是_______ 。
(2)高温时16.8g铁与足量水蒸气反应,生成气体的体积是_______ L(标准状况下)。
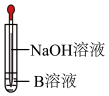
(3)如图,在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,请写出上述现象中白色沉淀转化成红褐色沉淀的化学方程式_______ 。_______ 。
②酸浸时,Fe3O4与硫酸反应的化学方程式为_______ ;通入O2的目的是_______ 。
③滤渣的成分是_______ (填化学式)。
④“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7标准溶液测定Fe2+的量( 被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是_______ 。
(1)刻制铜印刷电路板时,要用FeCl3溶液作为“腐蚀液”,发生反应的离子方程式为
(2)高温时16.8g铁与足量水蒸气反应,生成气体的体积是
(3)如图,在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色,请写出上述现象中白色沉淀转化成红褐色沉淀的化学方程式
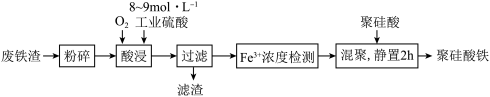
②酸浸时,Fe3O4与硫酸反应的化学方程式为
③滤渣的成分是
④“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7标准溶液测定Fe2+的量(
 被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+中还原性最强的是
您最近一年使用:0次
解题方法
2 . 部分含铁微粒所带的电荷数与其中铁元素化合价的关系如图所示。下列推断不合理的是

| A.含R的合金是用量最大、用途最广的合金 |
B.高温条件下,红热的 与水蒸气反应生成 与水蒸气反应生成 |
C.可用 溶液检验溶液中 溶液检验溶液中 是否被氧化 是否被氧化 |
D.根据 中铁元素的价态,可判断 中铁元素的价态,可判断 具有氧化性 具有氧化性 |
您最近一年使用:0次
3 . 碘是一种紫黑色固体,微溶于水,碘单质及碘的化合物被广泛用于医疗、染料等方面。一种以海水为原料制备碘单质的方法如图所示。
(1)将海水中的 “富集”得到悬浊液,有关反应的离子方程式是
“富集”得到悬浊液,有关反应的离子方程式是________ 。
(2)“转化”时用铁粉而不用铁片的原因是________ 。 进入“氧化”环节,通入
进入“氧化”环节,通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为________ ;若反应物用量比 时,氧化产物为
时,氧化产物为________ ;
(3)欲判断经一系列处理后的水溶液中是否含有 ,应进行的操作是
,应进行的操作是________ 。
(4)成品中 的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取
的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的
溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的 用
用 溶液除去,反应式为
溶液除去,反应式为 。测定时消耗
。测定时消耗 溶液体积VmL样品中
溶液体积VmL样品中 的含量为
的含量为________ (用质量分数表示)。

(1)将海水中的
 “富集”得到悬浊液,有关反应的离子方程式是
“富集”得到悬浊液,有关反应的离子方程式是(2)“转化”时用铁粉而不用铁片的原因是
 进入“氧化”环节,通入
进入“氧化”环节,通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为 时,氧化产物为
时,氧化产物为(3)欲判断经一系列处理后的水溶液中是否含有
 ,应进行的操作是
,应进行的操作是(4)成品中
 的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取
的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的
溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的 用
用 溶液除去,反应式为
溶液除去,反应式为 。测定时消耗
。测定时消耗 溶液体积VmL样品中
溶液体积VmL样品中 的含量为
的含量为
您最近一年使用:0次
名校
4 . 下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究浓硫酸的吸水性 | 向表面皿中加入少量 ,再加入约3mL浓硫酸,搅拌,观察实验现象 ,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 比较浓硝酸和浓盐酸的氧化性强弱 | 室温下,在浓硝酸和浓盐酸中分别投入光亮的铁钉 |
C | 探究浓硫酸与木炭反应的气体产物中是否含有 | 将浓硫酸与木炭混合加热生成的气体通入足量澄清石灰水中,观察是否有白色沉淀产生 |
D | 检验 | 将 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-11更新
|
501次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一下学期第一次月考化学试题
解题方法
5 . 下列各组微粒在溶液中既可以大量共存,且加入试剂M后发生反应的离子方程式书写也正确的是
| 选项 | 微粒组 | 试剂M | 发生反应的离子方程式 |
| A | Fe3+、H+、 、 、 | 通入少量SO2 | 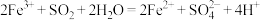 |
| B |  、Fe2+、 、Fe2+、 、Na+ 、Na+ | 少量硫酸 | 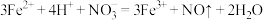 |
| C | Cl-、Na+、 、K+ 、K+ | 过量醋酸溶液 | 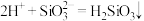 |
| D | K+、 、 、 、 、 | 适量HNO3溶液 | 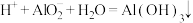 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 中华文化,博大精深,其中蕴含丰富的化学知识。下述之物见其还原性者为
| A.石灰(CaCO3):“凡石灰经火焚炼为用” |
B.青矾 :“吹令火炽,其矾即沸流出,色赤如融金汁者是真也” :“吹令火炽,其矾即沸流出,色赤如融金汁者是真也” |
| C.硵水(HNO3):“有硵水者,剪银塊投之,则旋而为水” |
| D.硫磺(S):“凡火药以硝石、硫磺为主,草木灰为辅…而后火药成声” |
您最近一年使用:0次
名校
解题方法
7 . 根据要求,回答下列问题:
I.A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:_______ 。
(2)反应④的化学方程式为_______ 。
(3)反应⑤的化学方程式为_______ 。
II.电子工业常用30%的 溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(4) 溶液与金属铜反应的离子方程式为
溶液与金属铜反应的离子方程式为_______ 。
(5)采取如图所示步骤,可从使用过的腐蚀废液中回收金属铜,并重新获得 溶液。通入气体⑥后发生反应的离子方程式为
溶液。通入气体⑥后发生反应的离子方程式为_______ 。 溶液时,为防止
溶液时,为防止 被氧化,常在溶液中加入铁钉或铁粉,其原理是
被氧化,常在溶液中加入铁钉或铁粉,其原理是_______ (写离子方程式)。
I.A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(2)反应④的化学方程式为
(3)反应⑤的化学方程式为
II.电子工业常用30%的
 溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。(4)
 溶液与金属铜反应的离子方程式为
溶液与金属铜反应的离子方程式为(5)采取如图所示步骤,可从使用过的腐蚀废液中回收金属铜,并重新获得
 溶液。通入气体⑥后发生反应的离子方程式为
溶液。通入气体⑥后发生反应的离子方程式为
 溶液时,为防止
溶液时,为防止 被氧化,常在溶液中加入铁钉或铁粉,其原理是
被氧化,常在溶液中加入铁钉或铁粉,其原理是
您最近一年使用:0次
2023-10-10更新
|
188次组卷
|
2卷引用:陕西省宝鸡教育联盟2024届高三上学期阶段性检测(二)化学试题
名校
8 . 下列各组物质,不会因反应条件(温度或者反应物用量)改变而引起产物改变的是
A. 溶液和 溶液和 | B.Fe和 |
C.Na和 | D.NaOH溶液和 |
您最近一年使用:0次
2023-06-08更新
|
336次组卷
|
7卷引用:陕西省汉中市汉台区2023-2024学年高一上学期1月期末化学试题
9 . 现有某种仅由Fe3O4和Fe2O3组成的含铁氧化物样品,为测定此样品中Fe3O4的质量分数,实验采用下列步骤进行:
①准确称量m1g样品,将样品加入过量稀盐酸中,微热,使固体样品完全溶解;
②向步骤①所得溶液中加入过量的双氧水,把溶液中的Fe2+氧化为Fe3+;
③向步骤②所得溶液中加入NaOH溶液至过量,小火加热煮沸;
④冷却后过滤,将沉淀洗涤后移至坩埚中,灼烧、冷却、托盘天平称重,并重复操作至恒重。
(1)在Fe3O4中Fe有+2价和+3价两种价态,则在Fe3O4中+2价铁和+3价铁的原子个数之比为___________ ;请写出Fe2O3与盐酸反应的离子方程式:___________ 。
(2)步骤②中加入双氧水发生反应的离子方程式为___________ ,该反应中氧化剂为___________ (填化学式)。
(3)步骤④中判断沉淀完全分解的依据是___________ 。
(4)若坩埚质量为m2g,坩埚及灼烧后的固体总质量为m3g,则样品中Fe3O4的质量分数为___________ (用含m1、m2、m3的代数式表示)。若步骤④中沉淀未完全分解,则测得的Fe3O4的质量分数___________ (填“偏大”、“偏小”或“不变”)。
①准确称量m1g样品,将样品加入过量稀盐酸中,微热,使固体样品完全溶解;
②向步骤①所得溶液中加入过量的双氧水,把溶液中的Fe2+氧化为Fe3+;
③向步骤②所得溶液中加入NaOH溶液至过量,小火加热煮沸;
④冷却后过滤,将沉淀洗涤后移至坩埚中,灼烧、冷却、托盘天平称重,并重复操作至恒重。
(1)在Fe3O4中Fe有+2价和+3价两种价态,则在Fe3O4中+2价铁和+3价铁的原子个数之比为
(2)步骤②中加入双氧水发生反应的离子方程式为
(3)步骤④中判断沉淀完全分解的依据是
(4)若坩埚质量为m2g,坩埚及灼烧后的固体总质量为m3g,则样品中Fe3O4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
189次组卷
|
3卷引用:陕西省渭南市富平县蓝光中学2023-2024学年高一上学期1月期末化学试题
10 . 根据有关操作与现象,所得结论不正确 的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向 溶液中滴加 溶液中滴加 、淀粉溶液 、淀粉溶液 | 溶液变蓝 |  有还原性 有还原性 |
| B | 向某溶液中滴加盐酸 | 产生气体 | 溶液中一定含有 |
| C | 向 中分别滴加盐酸、 中分别滴加盐酸、 溶液 溶液 |  溶解 溶解 | 氧化铝为两性氧化物 |
| D | 向 酸性溶液中滴加 酸性溶液中滴加 溶液 溶液 | 紫色褪去 |  有还原性 有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-02更新
|
294次组卷
|
4卷引用:陕西省商洛市2023-2024学年高一上学期期末统测化学试题
陕西省商洛市2023-2024学年高一上学期期末统测化学试题广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题天津市河北区2021-2022学年高一上学期期末质量检测化学试题(已下线)专题07 铁及其化合物 金属材料-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)

 固体是否氧化变质
固体是否氧化变质

