1 . 甲醇(CH3OH)在化学工业、农业生产等领域有着广泛应用。回答下列问题:
(1)CH3OH的电子式为___________ 。
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的___________ 。已知相关物质的燃烧热数值如下表,则反应CO(g)+2H2(g) CH3OH(l)的∆H=
CH3OH(l)的∆H=___________ 。
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l) CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。
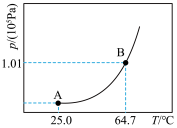
①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是___________ 。
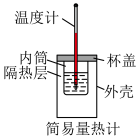
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到___________ (填字母)所示的现象。___________ kPa,馏分中甲醇的物质的量分数为___________ 。
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为___________ kW⋅h⋅kg-1(结果保留一位小数)。已知: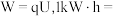 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。
②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的___________ 极相连,Al电极上发生的电极反应方程式为___________ 。
(1)CH3OH的电子式为
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的
 CH3OH(l)的∆H=
CH3OH(l)的∆H=| 物质 | CO(g) | H2(g) | CH3OH(l) |
| 燃烧热/kJ·mol-1 | -283.0 | -285.8 | -726.5 |
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l)
 CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到

| 物质 | CH3OH(l) | H2O(1) |
| p*(64.7℃)/kPa | 101.30 | 23.90 |
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为
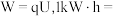 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的
您最近半年使用:0次
名校
2 . 某小组以废铁屑(久置但未生锈)为原料制备Fe(NO3)3,并利用配制的Fe(NO3)3标准溶液对“硫酸亚铁补铁剂”中铁元素的含量进行测定,实验过程如下:
【实验Ⅰ】Fe(NO3)3·9H2O的制备___________ ;稀硝酸要足量的目的有:①确保铁元素转化成Fe3+,②___________ 。
(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、___________ 。
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
___________ ,b=___________ 。
【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为___________ %。
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
【实验Ⅰ】Fe(NO3)3·9H2O的制备

(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
| A.溶液未恢复室温就注入容量瓶定容 |
| B.定容时俯视液面 |
| C.摇匀后发现液面低于刻度线,于是加水至刻度线 |
| D.容量瓶底部残留少量的蒸馏水而未做干燥处理 |
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
| 比色管编号 | S1 | S2 | S3 | S4 | S₅ | S6 |
| Fe(NO3)3溶液/mL | 0.50 | 0.75 | 1.00 | 1.25 | 1.50 | 2.00 |
| c(Fe3+)/(10-4mol·L-1) | 1 | 1.5 | 2 | 2.5 | 3 | 4 |
| 吸光度A | 0.12 | 0.17 | 0.22 | 0.27 | 0.32 | 0.42 |

【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
| A.提前除去【实验Ⅰ】溶解铁屑所用硝酸中的Fe3+杂质 |
| B.用浓硝酸溶液代替【实验Ⅳ】中所用的H2O2溶液 |
| C.整个实验中均采用相同浓度的KSCN溶液 |
| D.对每一份溶液平行测定多次吸光度A,取平均值作结果 |
您最近半年使用:0次
3 . 向绝热恒容密闭容器中通入一定量SO2与NO2的混合气体,在一定条件下发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。其正反应速率
SO3(g)+NO(g)。其正反应速率 正随时间t变化的曲线如下,不考虑副反应的影响,下列说法正确的是
正随时间t变化的曲线如下,不考虑副反应的影响,下列说法正确的是
 SO3(g)+NO(g)。其正反应速率
SO3(g)+NO(g)。其正反应速率 正随时间t变化的曲线如下,不考虑副反应的影响,下列说法正确的是
正随时间t变化的曲线如下,不考虑副反应的影响,下列说法正确的是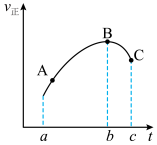
A. 逆随t变化的曲线在a~c时间段内与 逆随t变化的曲线在a~c时间段内与 正的趋势相同 正的趋势相同 |
| B.从A点到C点,NO的分压一直增大 |
| C.其他条件不变时,若在恒温条件下发生此反应,则SO2的平衡转化率减小 |
| D.A、B、C三点的Q值:QA>QB>Qc |
您最近半年使用:0次
名校
解题方法
4 . 室温下,通过下列实验探究0.0100mol/L Na2C2O4溶液的性质。
【实验1】用pH计测得该溶液pH=8.60。
【实验2】取5mL该溶液,滴加等体积等浓度稀盐酸。
【实验3】另取5mL该溶液,滴加等体积0.02mol/L CaCl2溶液,出现白色沉淀。已知室温下Ksp(CaC2O4=2.5×10-9)下列说法错误的是
【实验1】用pH计测得该溶液pH=8.60。
【实验2】取5mL该溶液,滴加等体积等浓度稀盐酸。
【实验3】另取5mL该溶液,滴加等体积0.02mol/L CaCl2溶液,出现白色沉淀。已知室温下Ksp(CaC2O4=2.5×10-9)下列说法错误的是
A.该Na2C2O4溶液中满足: >2 >2 |
B.实验2滴加盐酸过程中可能存在;c(Na+ )= c( )+2c( )+2c( )+c(C1-) )+c(C1-) |
C.实验3所得上层清液中:c( )=5×10-7mol⋅L-1 )=5×10-7mol⋅L-1 |
D.实验3所得上层清液中:2c(Ca2+)+c(H+ )=c( )+2c( )+2c( )+0.01+c(OH-) )+0.01+c(OH-) |
您最近半年使用:0次
名校
解题方法
5 . 下列有关实验装置或操作能达到相应目的的是
|
|
| A.通过注射器活塞移动验证钠与水反应放热 | B.探究浓度对反应速率的影响 |
|
|
| C.检查容量瓶是否漏液 | D.测定中和热 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
6 . 下列说法不正确的是
| A.Na、K、Rb的密度依次增大 |
| B.H2O、HF、NH3的沸点依次降低 |
| C.等质量的CH4、C2H4、C6H6完全燃烧的耗氧量依次减小 |
| D.等体积等pH的盐酸和醋酸分别与一定量锌反应生成等量氢气时,醋酸耗时短 |
您最近半年使用:0次
7 . 下列工业制备原理或流程不正确的是
A.工业冶炼镁:MgCl2(熔融) Mg+Cl2↑ Mg+Cl2↑ |
B.工业制硝酸:N2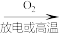 NO NO HNO3 HNO3 |
C.工业制氯气:2NaCl+2H2O 2NaOH+Cl2↑+H2↑ 2NaOH+Cl2↑+H2↑ |
D.工业制纯硅:石英砂 粗硅 粗硅 SiHCl3 SiHCl3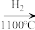 高纯硅 高纯硅 |
您最近半年使用:0次
8 . 化学与生活、生产、科技等密切相关。下列说法正确的是
| A.“杯酚”能分离C60和C70,体现了超分子的“分子识别”特性 |
| B.牙膏中添加氟化物用于预防龋齿是利用了氧化还原反应的原理 |
| C.“神州十七号”使用砷化镓(GaAs)太阳能电池,供电时GaAs发生了电子转移 |
| D.钾盐可用作紫色烟花的原料是因为电子跃迁到激发态过程中释放能量产生紫色光 |
您最近半年使用:0次
名校
解题方法
9 . 下列各组离子在溶液中可以大量共存的是
A.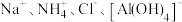 | B. |
C.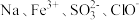 | D.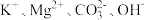 |
您最近半年使用:0次
名校
解题方法
10 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:___________ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释___________ 。
(2)加入H2O2的目的是___________ ;“调pH”时除ZnO外还可以选用的物质是___________ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了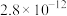 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为___________ 。证明Fe3+已除尽的化学方法是___________ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:___________ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。

(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
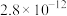 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
您最近半年使用:0次