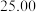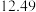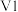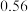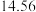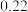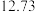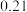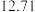名校
解题方法
1 . 电化学原理在污染治理方面有着重要的作用。回答下列问题:
Ⅰ.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:
已知:两电极为完全相同的惰性电极。______ 极。
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式______ 。
(3)电解过程中,混合溶液中的pH将______ (填“变大”、“变小”或“不变”),理由是______ 。
Ⅱ.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:______ 。
(5)酸性废水中的 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为______ 。
Ⅰ.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:
已知:两电极为完全相同的惰性电极。

(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式
(3)电解过程中,混合溶液中的pH将
Ⅱ.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:

(5)酸性废水中的
 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为
您最近一年使用:0次
名校
2 . 25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)HCOOH、 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为______ 。
(2)向 溶液中加入足量HCN,反应的离子方程式为
溶液中加入足量HCN,反应的离子方程式为______ 。
(3)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.000mol/L的NaOH标准溶液滴定:
①用NaOH固体配制100mL,1.000mol/L的NaOH溶液,需要用到的仪器 除天平,药匙,烧杯,玻璃棒,胶头滴管,还需要______ 。实验过程中,将25.00mLHCOOH放入锥形瓶,滴入酚酞2-3滴;用标准NaOH溶液进行滴定,滴定过程中,眼睛应注视______ 。
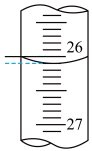
②连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为______ mL。
依据上表数据计算该HCOOH溶液的物质的量浓度为______ mol/L(计算结果保留四位有效数字)。
④下列操作中可能使所测HCOOH溶液的浓度数值偏低的是______ (填字母)。
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定法是一种常见的定量实验分析法,常见的滴定有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
①如据反应 ,可以用碘水滴定
,可以用碘水滴定 溶液,可以选
溶液,可以选______ 作指示剂;
②用 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点,当溶液中的
反应生成砖红色沉淀指示滴定终点,当溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 )时,溶液中的
)时,溶液中的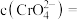
______  。(已知25℃时,
。(已知25℃时, 和AgCl的
和AgCl的 分别为
分别为 和
和 。)
。)
化学式 |
|
|
|
电离平衡常数 |
|
|
|
(1)HCOOH、
 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为(2)向
 溶液中加入足量HCN,反应的离子方程式为
溶液中加入足量HCN,反应的离子方程式为(3)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.000mol/L的NaOH标准溶液滴定:
①用NaOH固体配制100mL,1.000mol/L的NaOH溶液,需要用到的
②连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为
实验序号 | 待测 |
| ||
滴定前刻度 | 滴定后刻度 | 溶液的体积 | ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
④下列操作中可能使所测HCOOH溶液的浓度数值偏低的是
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定法是一种常见的定量实验分析法,常见的滴定有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
①如据反应
 ,可以用碘水滴定
,可以用碘水滴定 溶液,可以选
溶液,可以选②用
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点,当溶液中的
反应生成砖红色沉淀指示滴定终点,当溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 )时,溶液中的
)时,溶液中的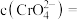
 。(已知25℃时,
。(已知25℃时, 和AgCl的
和AgCl的 分别为
分别为 和
和 。)
。)
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是___________ 。
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐( )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
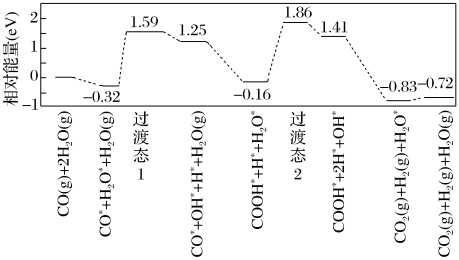
体积比为___________ 。___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
(1)对于在一个密闭容器中进行的反应 C(s)+H2O(g) = CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量;②增加CO的量;③将容器的体积缩小一半; ④保持体积不变,充入 He以增大压强;⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。
(2)新型纳米材料氧缺位高铁酸盐(
 )能将烟气中
)能将烟气中 除去,原理如图所示。该过程中转化的
除去,原理如图所示。该过程中转化的 和消耗的
和消耗的 体积比为
体积比为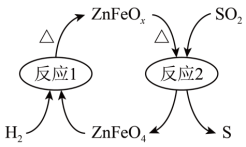
您最近一年使用:0次
解题方法
4 . 回答下列问题
(1)下列反应是氧化还原反应且是吸热反应的是___________ 。
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为___________ 。金属的两种常见电化学防护方法如下图所示,图甲中铁闸门连接电源的___________ (填“正极”或“负极”),图乙所示金属的防护方法称为___________ 。
(1)下列反应是氧化还原反应且是吸热反应的是
A.稀醋酸与烧碱溶液的反应
B.灼热的炭与CO2的反应
C.铁片与稀盐酸反应
D.Ba(OH)2•8H2O与NH4Cl反应
E.干冰汽化
(2)实际生产生活中,钢铁等金属因电化学腐蚀损失巨大,而电化学在金属制备和加工中也发挥着重要的作用。生活中钢铁腐蚀以吸氧腐蚀为主,该腐蚀过程中正极的电极反应式为
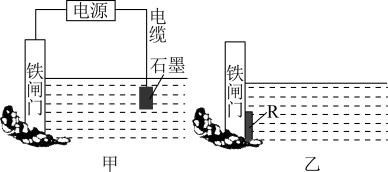
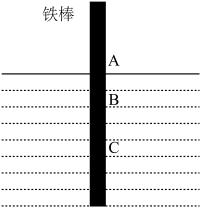
| A.铁棒AB段发生的反应为O2+2H2O+4e-=4OH- |
| B.腐蚀过程中在铁棒上会产生微电流,且方向是从BC段到AB段 |
| C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 |
| D.产生这种现象的本质是铁棒所处的化学环境不同 |
您最近一年使用:0次
解题方法
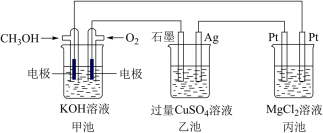
5 . 如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:___________ 。
(2)写出乙池石墨电极的名称为___________ (填“正极”“负极”或“阴极”“阳极”)。写出乙池中电解总反应的化学方程式:___________ 。
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生___________ g沉淀,此时乙池中溶液的体积为400 mL,该溶液的pH=___________ 。
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将___________ (填“增大”“减小”或“不变”,下同),丙中溶液的pH将___________ 。
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的___________ 极,电解质溶液最好用___________ 。若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用___________ 作电极。阳极反应的电极方程式为___________ 。
(2)写出乙池石墨电极的名称为
(3)甲池中消耗224 mL(标准状况下)O2,此时丙池中理论上最多产生
(4)若丙中电极不变,将其溶液换成NaOH溶液,开关闭合一段时间后,甲中溶液的pH将
(5)某同学利用甲醇燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图)。若用于制漂白液,a为电池的

您最近一年使用:0次
名校
6 . 室温下6种稀溶液:①HCl、② 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:
(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是______ (用序号填写)
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH______ 7(填“>”、“<”或“=”)。
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=______ 。
(4)已知:HClO的 ;
; 的
的 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:______ 。
(5)盐碱地(含较多 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的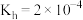 ,当
,当 溶液中
溶液中 时,溶液的
时,溶液的
______ 。
 、③
、③ 、④
、④ 、⑤氨水、⑥NaOH;回答下列问题:
、⑤氨水、⑥NaOH;回答下列问题:(1)中和等体积、pH相同的①②③溶液消耗NaOH最多的是
(2)将等体积、等物质的量浓度的③、⑥混合,则溶液的pH
(3)常温下,aL pH=13的⑥溶液与bLpH=2的②溶液混合所得混合溶液pH=12(混合过程中溶液体积变化忽略不计),则a∶b=
(4)已知:HClO的
 ;
; 的
的 ,
, 。写出向NaClO溶液中通入少量
。写出向NaClO溶液中通入少量 时发生反应的离子方程式:
时发生反应的离子方程式:(5)盐碱地(含较多
 、NaCl)不利于植物生长,已知
、NaCl)不利于植物生长,已知 的
的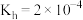 ,当
,当 溶液中
溶液中 时,溶液的
时,溶液的
您最近一年使用:0次
名校
7 . 草酸( 二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
(1)常温下,pH=3的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,pH=4的
,pH=4的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,则
,则
______ 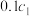 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)已知: 的电离大于
的电离大于 的水解,常温下,用
的水解,常温下,用 溶液滴定20.00mL某未知浓度
溶液滴定20.00mL某未知浓度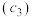 的
的 溶液,滴定曲线如图,c点所示溶液中:
溶液,滴定曲线如图,c点所示溶液中: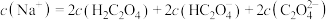 ,a点所示溶液中各离子的浓度由小到大的顺序为
,a点所示溶液中各离子的浓度由小到大的顺序为______ 。 酸性溶液滴定未知浓度
酸性溶液滴定未知浓度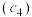 的无色
的无色 溶液,
溶液,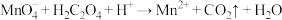 (未配平),滴定终点的判断方法是
(未配平),滴定终点的判断方法是______ 。
(4)乙学生按照滴定步骤进行了4次实验,分别记录有关数据如表:
依据上表数据计算法 溶液的物质的量浓度为
溶液的物质的量浓度为______ mol/L(保留4位有效数字)。
(5)下列操作中可能使测定结果偏高的是______(填字母)。
 二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。(1)常温下,pH=3的
 溶液的物质的量浓度为
溶液的物质的量浓度为 ,pH=4的
,pH=4的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,则
,则
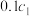 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)已知:
 的电离大于
的电离大于 的水解,常温下,用
的水解,常温下,用 溶液滴定20.00mL某未知浓度
溶液滴定20.00mL某未知浓度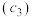 的
的 溶液,滴定曲线如图,c点所示溶液中:
溶液,滴定曲线如图,c点所示溶液中: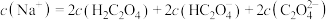 ,a点所示溶液中各离子的浓度由小到大的顺序为
,a点所示溶液中各离子的浓度由小到大的顺序为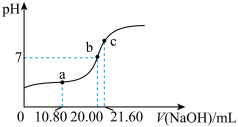
 酸性溶液滴定未知浓度
酸性溶液滴定未知浓度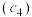 的无色
的无色 溶液,
溶液,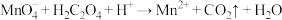 (未配平),滴定终点的判断方法是
(未配平),滴定终点的判断方法是(4)乙学生按照滴定步骤进行了4次实验,分别记录有关数据如表:
滴定次数 | 待测 |
| ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 25.31 | 25.31 |
第二次 | 25.00 | 1.52 | 28.40 | 26.88 |
第三次 | 25.00 | 0.22 | 25.51 | 25.29 |
第四次 | 25.00 | 0.89 | 26.19 | 25.30 |
 溶液的物质的量浓度为
溶液的物质的量浓度为(5)下列操作中可能使测定结果偏高的是______(填字母)。
A.酸式滴定管未用标准液润洗就直接注入 标准液 标准液 |
| B.测定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管尖嘴部分在滴定前有气泡,滴定后没有气泡 |
D.读取 标准液时,开始仰视读数,滴定结束时俯视读数 标准液时,开始仰视读数,滴定结束时俯视读数 |
您最近一年使用:0次
8 . 完成下列问题。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为_______ 。
②电解液中H+向_____ 极移动。
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:____ 极,A池阴极电极反应:______ ,C池阳极电极反应:_______ 。
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______ 。
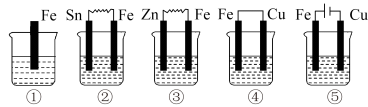
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为_____ 。______ 。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为
②电解液中H+向
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:
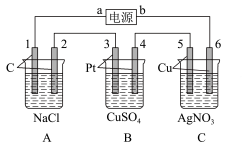
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为
您最近一年使用:0次
9 . 我国的歼-20战机使用了大量的钛金属, 是生产钛的重要中间原料,实验室用如下装置制备
是生产钛的重要中间原料,实验室用如下装置制备 (夹持装置略去)。
(夹持装置略去)。 溶液反应产生黑色金属钯。
溶液反应产生黑色金属钯。
②有关物质的性质。
请回答下列问题:
(1)装置A中a的作用是_______ ,A中制 的离子方程式为
的离子方程式为_______ 。
(2)装置C中的药品为_______ ,装置E用冰盐水浴的目的是_______ 。
(3)装置D中发生两个反应,其中副反应为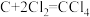 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式_______ 。
(4)进一步提纯E中产物的方法是_______(填编号)。
(5)测定产品纯度:准确量取3.4g产品,配成250mL含 的溶液,取25.00mL该溶液,加入还原剂将
的溶液,取25.00mL该溶液,加入还原剂将 全部转化为
全部转化为 ,再加入指示剂,用
,再加入指示剂,用 标准溶液滴定至终点,将
标准溶液滴定至终点,将 氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
①滴定时所用的指示剂为_______ (填标号)。
A.酚酞溶液 B.甲基橙 C.KSCN溶液 D. 溶液
溶液
②产品中 的纯度为
的纯度为_______ 。
 是生产钛的重要中间原料,实验室用如下装置制备
是生产钛的重要中间原料,实验室用如下装置制备 (夹持装置略去)。
(夹持装置略去)。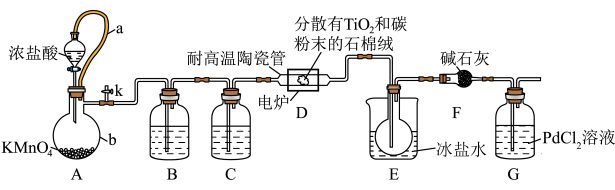
 溶液反应产生黑色金属钯。
溶液反应产生黑色金属钯。②有关物质的性质。
| 熔点/℃ | 沸点/℃ | 密度 | 水溶性 | |
 | -24 | 136.4 | 1.7 | 遇水极易水解,同时出现白雾 |
 | -23 | 76.8 | 1.6 | 难溶于水,与 互溶 互溶 |
(1)装置A中a的作用是
 的离子方程式为
的离子方程式为(2)装置C中的药品为
(3)装置D中发生两个反应,其中副反应为
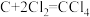 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式(4)进一步提纯E中产物的方法是_______(填编号)。
| A.过滤 | B.蒸发 | C.蒸馏 | D.分液 |
(5)测定产品纯度:准确量取3.4g产品,配成250mL含
 的溶液,取25.00mL该溶液,加入还原剂将
的溶液,取25.00mL该溶液,加入还原剂将 全部转化为
全部转化为 ,再加入指示剂,用
,再加入指示剂,用 标准溶液滴定至终点,将
标准溶液滴定至终点,将 氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。①滴定时所用的指示剂为
A.酚酞溶液 B.甲基橙 C.KSCN溶液 D.
 溶液
溶液②产品中
 的纯度为
的纯度为
您最近一年使用:0次
10 . 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序___________ 。
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:___________ 。
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为___________ mL。
(5)某学生根据三次实验分别记录有关数据如表:
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度:c(NaOH)=___________ mol/L。(计算结果保留4位有效数字)
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
(1)某学生的操作步骤如下:
A.移取20.00mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序
→___________→___________→___________→A→F。
(2)滴定终点的判断方法:
(3)滴定结束时,酸式滴定管中的液面如图所示,则读数为

A. | B. | C. | D. |
(5)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
| A.中和滴定到达终点时俯视滴定管内液面读数 |
| B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定 |
| C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 |
| D.锥形瓶用待测液润洗 |
您最近一年使用:0次

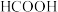

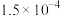
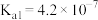
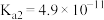

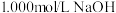 的体积
的体积