解题方法
1 . 人体吸入 会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:
会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:
(1) 具有氧化性,
具有氧化性, 与
与 反应会生成淡黄色沉淀,写出反应的化学方程式:
反应会生成淡黄色沉淀,写出反应的化学方程式:_______ 。
(2) 可以使品红溶液褪色,说明二氧化硫具有
可以使品红溶液褪色,说明二氧化硫具有_______ 性。
(3)石灰石——石膏法。该工艺原理利用石灰石加水制成的浆液( )作为吸收剂,吸收二氧化硫,并生成
)作为吸收剂,吸收二氧化硫,并生成 。再向其中通入烟气氧化生成
。再向其中通入烟气氧化生成 ,写出该工艺中生成
,写出该工艺中生成 的化学方程式:
的化学方程式:_______ 。
(4)近年来,有人提出了一种利用电解饱和氯化钠溶液循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:
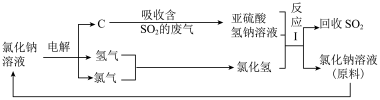
①此种方法中,可以循环利用的物质是_______ (填化学式)。
②写出电解饱和氯化钠溶液的化学方程式:_______ 。
③写出反应I的离子方程式:_______ 。
 会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:
会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:(1)
 具有氧化性,
具有氧化性, 与
与 反应会生成淡黄色沉淀,写出反应的化学方程式:
反应会生成淡黄色沉淀,写出反应的化学方程式:(2)
 可以使品红溶液褪色,说明二氧化硫具有
可以使品红溶液褪色,说明二氧化硫具有(3)石灰石——石膏法。该工艺原理利用石灰石加水制成的浆液(
 )作为吸收剂,吸收二氧化硫,并生成
)作为吸收剂,吸收二氧化硫,并生成 。再向其中通入烟气氧化生成
。再向其中通入烟气氧化生成 ,写出该工艺中生成
,写出该工艺中生成 的化学方程式:
的化学方程式:(4)近年来,有人提出了一种利用电解饱和氯化钠溶液循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:

①此种方法中,可以循环利用的物质是
②写出电解饱和氯化钠溶液的化学方程式:
③写出反应I的离子方程式:
您最近半年使用:0次
2 . I.硫元素是动植物生长不可缺少的元素,硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的试剂是_______ 。
(2)甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4,方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是_______ 。
②这两种方案,你认为哪一种方案更合理?_______ 。理由是_______ 。
II.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
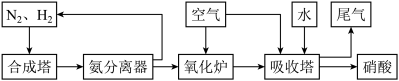
(3)合成塔中发生反应的化学方程式为_______ 。
(4)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的_______ 性质。
(5)氧化炉中,NH3转化为NO的化学方程式为_______ 。
(1)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的试剂是
(2)甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4,方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
II.氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:

(3)合成塔中发生反应的化学方程式为
(4)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨的
(5)氧化炉中,NH3转化为NO的化学方程式为
您最近半年使用:0次
名校
解题方法
3 . 请根据硫元素的价类二维图,回答下列问题:___________ ,Z转化为X所加试剂为___________ (填“氧化剂”或“还原剂”)。
(2)W的浓溶液与铜反应的化学方程式___________ 。
(3)欲制备 ,从氧化还原角度分析,合理的是___________(填字母)。
,从氧化还原角度分析,合理的是___________(填字母)。
(4)Y转化为W可以选择下列试剂___________ 。
A.酸性 溶液B.
溶液B. 溶液C.
溶液C. 溶液D.X的水溶液
溶液D.X的水溶液
写出你所选试剂将Y转化为W的离子方程式___________ 。
(5)将X与Z、W的稀溶液混合,可生成淡黄色固体,则在该反应中还原产物与氧化产物的质量之比为___________ 。

(2)W的浓溶液与铜反应的化学方程式
(3)欲制备
 ,从氧化还原角度分析,合理的是___________(填字母)。
,从氧化还原角度分析,合理的是___________(填字母)。A. | B. | C. | D. |
A.酸性
 溶液B.
溶液B. 溶液C.
溶液C. 溶液D.X的水溶液
溶液D.X的水溶液写出你所选试剂将Y转化为W的离子方程式
(5)将X与Z、W的稀溶液混合,可生成淡黄色固体,则在该反应中还原产物与氧化产物的质量之比为
您最近半年使用:0次
2023-03-21更新
|
541次组卷
|
3卷引用:四川省成都市第七中学2022-2023学年高一下学期3月月考化学试题
2023高三·全国·专题练习
解题方法
4 . 将 加入
加入 溶液中(写化学方程式)
溶液中(写化学方程式)_______ 。
 加入
加入 溶液中(写化学方程式)
溶液中(写化学方程式)
您最近半年使用:0次
解题方法
5 . 生产 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式:
过饱和溶液经结晶脱水制得。写出该过程的化学方程式:_______ 。 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗10.00mL。滴定反应的离子方程式为
的碘标准液滴定至终点,消耗10.00mL。滴定反应的离子方程式为_______ 。
 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式:
过饱和溶液经结晶脱水制得。写出该过程的化学方程式: 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗10.00mL。滴定反应的离子方程式为
的碘标准液滴定至终点,消耗10.00mL。滴定反应的离子方程式为
您最近半年使用:0次
6 . 化学在治理空气污染方面发挥着重要的作用。
I、化石燃料的过度使用是导致酸雨的主要原因。研究表明,NOx、SO2形成酸雨时的转化关系如图所示:
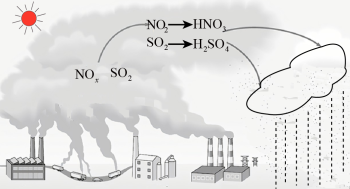
(1)HNO3的电离方程式为_______ 。
(2)SO2会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是_______ (用化学方程式表示)。
Ⅱ、NOx、SO2等均为大气污染物,需处理后才能排放。
(3)用NaOH溶液可以吸收NOx,反应的化学方程式如下:
i.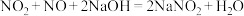
ii.
①反应i中,每消耗0.3molNO2,转移电子数为_______ 。
②反应ii中,氧化剂和还原剂的物质的量之比为_______ 。
(4)用氨水可以吸收SO2制取铵盐。
①实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为_______ 。
②用足量氨水吸收SO2的化学方程式为_______ 。
(5)利用NaClO吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。
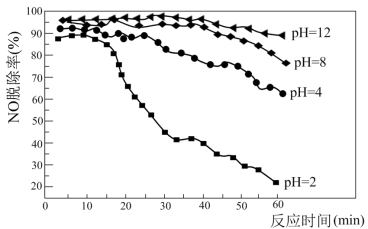
pH=2时,脱除SO2的离子方程式为_______ ;脱硝效率随反应时间的延长而逐渐降低的可能原因是_______ 。
I、化石燃料的过度使用是导致酸雨的主要原因。研究表明,NOx、SO2形成酸雨时的转化关系如图所示:

(1)HNO3的电离方程式为
(2)SO2会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是
Ⅱ、NOx、SO2等均为大气污染物,需处理后才能排放。
(3)用NaOH溶液可以吸收NOx,反应的化学方程式如下:
i.
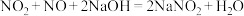
ii.

①反应i中,每消耗0.3molNO2,转移电子数为
②反应ii中,氧化剂和还原剂的物质的量之比为
(4)用氨水可以吸收SO2制取铵盐。
①实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为
②用足量氨水吸收SO2的化学方程式为
(5)利用NaClO吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。

pH=2时,脱除SO2的离子方程式为
您最近半年使用:0次
7 . SO2、Na2SO3、Na2S2O5(焦亚硫酸钠)中都含有+4价的S,具有还原性。
(1)Na2SO3是实验室常用试剂。
①Na2SO3固体需密封保存,其原因是______ 。
②实验室用Na2SO3固体与浓硫酸制备SO2,该反应的化学方程式为______ 。
③在Br2水中加入Na2SO3溶液反应的离子方程式为______ 。
(2)一定条件下,将SO2通入TeOSO4溶液中,反应一段时间后过滤、洗涤得到粗Te。
①SO2还原TeOSO4溶液得到Te的反应中,n(SO2):n(TeOSO4)=______ 。
②“洗涤”的具体操作为______ 。
③过程中须控制反应温度为80℃,温度不能过高的原因是______ 。
(3)焦亚硫酸钠(Na2S2O5)空气法处理含氰废水的部分机理如下,其中[O]代表活性氧原子,具有强氧化性:S2O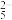 +H2O=2SO
+H2O=2SO +2H+、SO
+2H+、SO +O2=SO
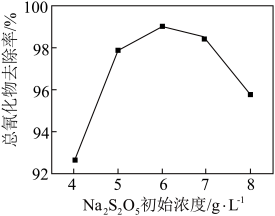
+O2=SO +[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g•L-1时,总氰化物去除率下降的原因可能是
+[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g•L-1时,总氰化物去除率下降的原因可能是______ 。
(1)Na2SO3是实验室常用试剂。
①Na2SO3固体需密封保存,其原因是
②实验室用Na2SO3固体与浓硫酸制备SO2,该反应的化学方程式为
③在Br2水中加入Na2SO3溶液反应的离子方程式为
(2)一定条件下,将SO2通入TeOSO4溶液中,反应一段时间后过滤、洗涤得到粗Te。
①SO2还原TeOSO4溶液得到Te的反应中,n(SO2):n(TeOSO4)=
②“洗涤”的具体操作为
③过程中须控制反应温度为80℃,温度不能过高的原因是
(3)焦亚硫酸钠(Na2S2O5)空气法处理含氰废水的部分机理如下,其中[O]代表活性氧原子,具有强氧化性:S2O
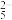 +H2O=2SO
+H2O=2SO +2H+、SO
+2H+、SO +O2=SO
+O2=SO +[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g•L-1时,总氰化物去除率下降的原因可能是
+[O]、CN-+[O]=CNO-。其他条件相同时,废水中氰化物去除率随Na2S2O5初始浓度的变化如图所示。当Na2S2O5初始浓度大于6g•L-1时,总氰化物去除率下降的原因可能是
您最近半年使用:0次
解题方法
8 . 煤是一种常用的燃料。煤燃烧产生的废气中含有的二氧化硫等有害气体会对环境造成污染,因此需要将废气净化后再排放。
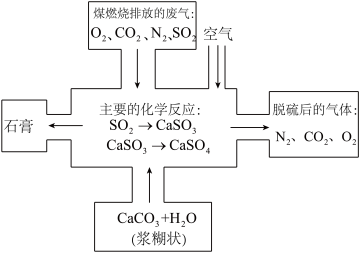
(1)这些废气会对环境造成怎样的影响?__________
(2)如果废气中的二氧化硫进入大气,会发生哪些化学变化?写出相关反应的化学方程式。__________
(3)如图是对煤燃烧产生的废气进行脱硫处理的基本流程图,试写出废气脱硫过程中发生的主要反应的化学方程式。__________

(1)这些废气会对环境造成怎样的影响?
(2)如果废气中的二氧化硫进入大气,会发生哪些化学变化?写出相关反应的化学方程式。
(3)如图是对煤燃烧产生的废气进行脱硫处理的基本流程图,试写出废气脱硫过程中发生的主要反应的化学方程式。
您最近半年使用:0次
解题方法
9 . 将二氧化硫的水溶液在空气中放置一段时间后,在溶液中能检测到硫酸根离子的存在,且溶液的 变小,试说明其原因
变小,试说明其原因____ 。
 变小,试说明其原因
变小,试说明其原因
您最近半年使用:0次
解题方法
10 . 硫酸厂的烟道气会严重污染环境,为保护环境、变废为宝,有多种脱硫方案,如石灰石-石膏法、氨水法、活性炭法、氧化镁法等。请写出下列反应的化学方程式。
(1)二氧化硫与熟石灰反应_______ 。
(2)亚硫酸钙( )与氧气反应
)与氧气反应_______ 。
(3)二氧化硫与氨水反应_______ 。
(4)亚硫酸铵与氧气反应_______ 。
(1)二氧化硫与熟石灰反应
(2)亚硫酸钙(
 )与氧气反应
)与氧气反应(3)二氧化硫与氨水反应
(4)亚硫酸铵与氧气反应
您最近半年使用:0次



