解题方法
1 . 某待测溶液中可能含有 、
、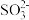 、
、 、
、 、
、 、
、 、
、 中的若干种和一种常见金属阳离子(
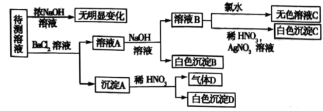
中的若干种和一种常见金属阳离子( ),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
(2)待测溶液中是否有 、
、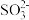 ?
?_______ 。
(3)形成沉淀B时反应的离子方程式为_______ 。
(4)形成沉淀C时反应的离子方程式为_______ 。
(5)若气体D遇空气变红棕色,则该反应的化学方程式为_______ 。
 、
、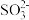 、
、 、
、 、
、 、
、 、
、 中的若干种和一种常见金属阳离子(
中的若干种和一种常见金属阳离子( ),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
),现进行如下图所示实验(每次实验所用试剂均足量,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 |
 、
、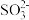 ?
?(3)形成沉淀B时反应的离子方程式为
(4)形成沉淀C时反应的离子方程式为
(5)若气体D遇空气变红棕色,则该反应的化学方程式为
您最近半年使用:0次
2021-02-16更新
|
683次组卷
|
2卷引用:(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 章末综合检测卷
2 . 酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。SO2、NOx是形成酸雨的主要物质,研究SO2、NOx等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
(1)酸雨是指pH_______ 的雨水。
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:① ;②
;②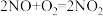 ;③
;③_______ 。
(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是_______ 。
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为_______ 。
③用氨水将SO2转化为NH4HSO3,再氧化成 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是_______ 、_______ (用离子方程式表示)。
(1)酸雨是指pH
(2)NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:①
 ;②
;②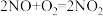 ;③
;③(3)SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式为
③用氨水将SO2转化为NH4HSO3,再氧化成
 来脱除烟气中的SO2,原理是
来脱除烟气中的SO2,原理是
您最近半年使用:0次
2021-02-07更新
|
171次组卷
|
2卷引用:广西河池市2020-2021学年高一上学期期末教学质量检测化学试题
名校
3 . 钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是____ 。
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式______ 。
ClO + VO2++ = Cl-+ VO
+ VO2++ = Cl-+ VO +
+
(3) V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是____ 。
(4)在20.00 mL 0.1 mol.L-1 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 ___ 。
a.VO2+ b. c. V2+ d.V
c. V2+ d.V
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是
(2)向上述所得溶液中加入KClO3溶液,完善并配平反应的离子方程式
ClO
 + VO2++ = Cl-+ VO
+ VO2++ = Cl-+ VO +
+ (3) V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则
 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是(4)在20.00 mL 0.1 mol.L-1
 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 a.VO2+ b.
 c. V2+ d.V
c. V2+ d.V
您最近半年使用:0次
2021-01-31更新
|
660次组卷
|
4卷引用:安徽省合肥市2021年高三第一次教学质量检测化学试题
安徽省合肥市2021年高三第一次教学质量检测化学试题(已下线)热点10 氧化还原反应与电极反应-2021年高考化学【热点·重点·难点】专练(新高考)山东省泰安市宁阳县第四中学2022-2023学年高三上学期10月月考化学试题(等级考)山东省泰安市宁阳县第四中学2023-2024学年高三上学期10月月考化学试题
解题方法
4 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是___________ (用化学方程式表示)。
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:___________ 。
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:___________ 。
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为: 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是___________ 。
②空气样品中SO2的体积分数为___________ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
随着时间的推移,pH逐渐变小的原因是
(2)防治SO2对环境的污染。
①从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
②从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式:
(3)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量溴水,反应的化学方程式为:
 。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近半年使用:0次
2021-01-27更新
|
456次组卷
|
3卷引用:江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题
江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练广东省深圳市光明区2022-2023学年高一下学期开学考试化学试题
解题方法
5 . (1)在一定条件下,可以用H2O2氧化H2S。随着参加反应的 变化,氧化产物不同,当
变化,氧化产物不同,当 =4时,氧化产物的分子式为
=4时,氧化产物的分子式为________ 。
(2)利用废铁屑制备聚合硫酸铁的过程中,需要向反应釜中加入氧化剂氧化Fe2+,最合适的是________ 。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为______________ 。
(4)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_____________ 。
(5)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式___________ 。
(6)NH3在催化剂条件下还原NO2生成N2和H2O的化学方程式:_________________ 。
 变化,氧化产物不同,当
变化,氧化产物不同,当 =4时,氧化产物的分子式为
=4时,氧化产物的分子式为(2)利用废铁屑制备聚合硫酸铁的过程中,需要向反应釜中加入氧化剂氧化Fe2+,最合适的是
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为(4)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
(5)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式
(6)NH3在催化剂条件下还原NO2生成N2和H2O的化学方程式:
您最近半年使用:0次
6 . 简要回答下列问题。
(1)亚硫酸钠固体暴露在空气中易变质的原因是___________ 。
(2)为了延长铁制品的使用寿命,提出一种保护铁制品的方法:___________ 。
(3)2017年9月国家多部门共同提出,在全国推广清洁汽车燃料——乙醇汽油,到2020年基本实现全覆盖。这样做的目的是___________ 。
(1)亚硫酸钠固体暴露在空气中易变质的原因是
(2)为了延长铁制品的使用寿命,提出一种保护铁制品的方法:
(3)2017年9月国家多部门共同提出,在全国推广清洁汽车燃料——乙醇汽油,到2020年基本实现全覆盖。这样做的目的是
您最近半年使用:0次
解题方法
7 . 资料显示: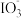 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为________ , 的还原性
的还原性________ I-(填“>”“=”或“<”)。
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入________ ,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
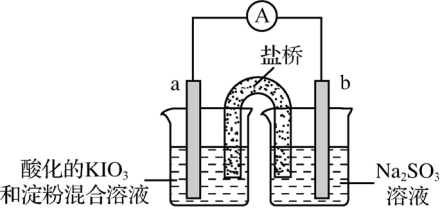
①甲同学在b电极附近的溶液中检测出了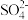
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 在a极放电的产物是
在a极放电的产物是________ 。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是________ 。
④下列说法正确的是________ 。
a. a电极附近蓝色不再褪去时, 尚未完全氧化
尚未完全氧化
b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被 还原
还原
c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
 在酸性溶液中能氧化I-,反应为
在酸性溶液中能氧化I-,反应为 +5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
+5I-+6H+=3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
 的还原性
的还原性(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。

①甲同学在b电极附近的溶液中检测出了
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。
 在a极放电的产物是
在a极放电的产物是③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
④下列说法正确的是
a. a电极附近蓝色不再褪去时,
 尚未完全氧化
尚未完全氧化b. a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被
 还原
还原c. 电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
您最近半年使用:0次
名校
8 . 化学还原法是处理含Cr2O 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
Cr2O
 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
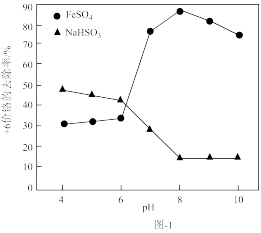
①在酸性条件下,请写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___ 。
②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.___ 。
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。
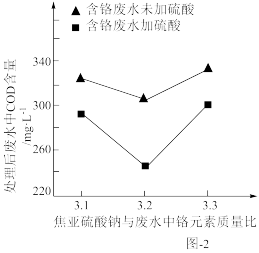
①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是___ 。
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是___ 。
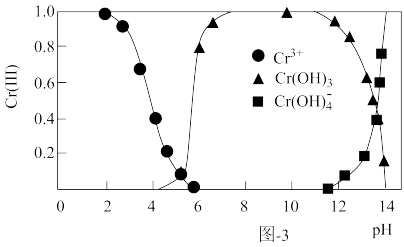
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在___ ;若pH过高,溶液中残留铬量增大,其原因为___ 。
 的工业废水常用的方法,主要分为“还原”和“沉淀”两步:
的工业废水常用的方法,主要分为“还原”和“沉淀”两步:Cr2O

 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3已知:①Na2S2O5+H2O=2NaHSO3
②“COD”是指化学需氧量,反映了水样中较强还原性物质含量的多少。水中还原性物质越少,则COD越低,表明水质污染程度越小。
(1)取含Cr2O
 的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
的工业废水,分别在不同pH条件下,向每个水样中分别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图-1所示。
①在酸性条件下,请写出NaHSO3与Cr2O
 反应的离子方程式:
反应的离子方程式:②分析比较亚铁盐和亚硫酸盐去除+6价Cr的效果。
Ⅰ.亚铁盐在中性和碱性条件下,对+6价Cr的去除效果优于酸性条件下的去除效果,亚硫酸盐则相反;
Ⅱ.
(2)用焦亚硫酸钠(Na2S2O5)处理废水后,可能会使废水中的COD增大。在焦亚硫酸钠与废水中铬元素不同质量比的情况下,加H2SO4与未加H2SO4处理含铬废水后其COD对比变化如图-2所示。

①未加H2SO4时,随着Na2S2O5质量增大,废水COD增大的原因是
②在焦亚硫酸钠与废水质量比相同的情况下,加H2SO4时,与未加H2SO4相比,废水COD均有所下降,原因可能是
(3)三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH的变化如图-3所示,为尽可能除去铬元素实现达标排放,沉淀过程中pH要控制在

您最近半年使用:0次
2020-11-19更新
|
478次组卷
|
5卷引用:江苏省无锡市2021届高三上学期期中考试化学(选修)试题
江苏省无锡市2021届高三上学期期中考试化学(选修)试题江苏省徐州市王杰中学2021届高三12月份阶段性检测化学试题江苏省无锡市2020-2021学年高三上学期期中考试化学试题(已下线)化学-2023年高考押题预测卷01(江苏卷)(含考试版、全解全析、参考答案、答题卡)江苏省前黄高级中学2022-2023学年高三下学期二模适应性考试化学试题
9 . 在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 _____________________________ ,又变为棕黄色的原因是用离子方程式解释 _____________________________ 。
您最近半年使用:0次
名校
解题方法
10 . (1)过量Fe与稀HNO3溶液反应的离子方程式:___________ ;
(2)少量Ca(HCO3)2溶液与NaOH溶液反应的离子方程式____________ ;
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O 还原成Cr3+,该反应的离子方程式为
还原成Cr3+,该反应的离子方程式为____________ 。
(4)已知反应:6HCl(浓)+KClO3=KCl+3Cl2↑+3H2O。
①在标准状况下,生成6.72 L氯气时转移电子的物质的量为_______ ,氧化剂___________ ,氧化产物_______ 。反应中转移1.5mole-时,其中被氧化的HCl为________ mol。
②配平____ CuSO4+___ FeS2+___ H2O=_____ Cu2S+____ FeSO4+____ H2SO4
(5)电解饱和食盐水 写出电极反应:阳极:_______ 反应类型:___________ ,总反应离子方程:__________ 。
(2)少量Ca(HCO3)2溶液与NaOH溶液反应的离子方程式
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O
 还原成Cr3+,该反应的离子方程式为
还原成Cr3+,该反应的离子方程式为(4)已知反应:6HCl(浓)+KClO3=KCl+3Cl2↑+3H2O。
①在标准状况下,生成6.72 L氯气时转移电子的物质的量为
②配平
(5)电解饱和食盐水 写出电极反应:阳极:
您最近半年使用:0次



