1 . 硫代硫酸钠(Na2S2O3)在纺织业、造纸业等领域有广泛应用。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O)。
【查阅资料】
ⅰ.Na2S2O3•5H2O易溶于水,遇酸易分解生成S和SO2。
ⅱ.向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
ⅲ.Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
【制备产品】
实验装置如图所示(省略夹持装置):
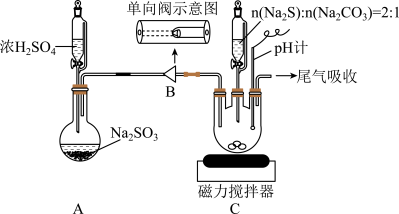
实验步骤:
ⅰ.检查装置气密性,按图示加入试剂。
ⅱ.先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4.装置A产生的SO2经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液pH约为7时,停止通入SO2气体,得产品混合溶液,结束反应。
ⅲ.过滤C中混合溶液,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O3•5H2O产品。
请回答下列问题:
(1)反应开始后,C中先有浑浊产生,后又变澄清。此浑浊物是___________ (写化学式)。
(2)步骤Ⅰ单向阀的作用是___________ ;装置C中的反应混合溶液pH过高将导致产率降低,原因是___________ 。
(3)制备完成后,兴趣小组选用下列试剂设计实验方案检验硫代硫酸钠中含有硫酸根杂质:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
(4)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(ii)进行了改进,改进后的操作是___________ 。
【查阅资料】
ⅰ.Na2S2O3•5H2O易溶于水,遇酸易分解生成S和SO2。
ⅱ.向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
ⅲ.Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
【制备产品】
实验装置如图所示(省略夹持装置):

实验步骤:
ⅰ.检查装置气密性,按图示加入试剂。
ⅱ.先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4.装置A产生的SO2经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液pH约为7时,停止通入SO2气体,得产品混合溶液,结束反应。
ⅲ.过滤C中混合溶液,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O3•5H2O产品。
请回答下列问题:
(1)反应开始后,C中先有浑浊产生,后又变澄清。此浑浊物是
(2)步骤Ⅰ单向阀的作用是
(3)制备完成后,兴趣小组选用下列试剂设计实验方案检验硫代硫酸钠中含有硫酸根杂质:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
| 实验步骤 | 现象 |
| ①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
| ③ | ④ |
| ⑤静置, | ⑥ |
您最近一年使用:0次
名校
解题方法
2 . CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co 元素主要以Co2O3、 CoO 的形式存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图:

已知:①焦亚硫酸钠(Na2S2O5)常作食品抗氧化剂。CaF2、MgF2 难溶于水。
②CoCl2∙6H2O 的熔点为 86℃,易溶于水、乙醚等;常温下稳定无毒,加热至 110~120℃时, 失去结晶水变成有毒的无水氯化钴。
③部分金属阳离子形成氢氧化物的 pH 见表:
回答下列问题:
(1)“550℃焙烧”的目的是_______ 。
(2)“浸取”的过程中,用离子方程式表示 Na2S2O5的主要作用是_______ 。
(3)滤液 1 中加入 NaClO3溶液的作用是_______ 。
(4)加入Na2CO3 溶液生成滤渣 2 的主要离子方程式为_______ 。
滤液 3 经过多次萃取与反萃取制备CoCl2 晶体:
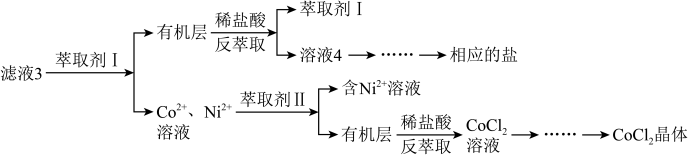
(5)滤液 3 中加入萃取剂 I,然后用稀盐酸反萃取的目的是_______ 。
(6)制备晶体CoCl2∙6H2O,需在减压环境下烘干的原因是_______ 。
(7)测定产品的纯度:称取 CoCl2∙6H2O 样品,将其用适当试剂转化为 CoC2O4,再转化为(NH4)2C2O4溶液,稀硫酸酸化后用高锰酸钾标准溶液滴定,滴定终点的判定_______ 。

已知:①焦亚硫酸钠(Na2S2O5)常作食品抗氧化剂。CaF2、MgF2 难溶于水。
②CoCl2∙6H2O 的熔点为 86℃,易溶于水、乙醚等;常温下稳定无毒,加热至 110~120℃时, 失去结晶水变成有毒的无水氯化钴。
③部分金属阳离子形成氢氧化物的 pH 见表:
| Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
| 开始沉淀 pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
| 完全沉淀 pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
(1)“550℃焙烧”的目的是
(2)“浸取”的过程中,用离子方程式表示 Na2S2O5的主要作用是
(3)滤液 1 中加入 NaClO3溶液的作用是
(4)加入Na2CO3 溶液生成滤渣 2 的主要离子方程式为
滤液 3 经过多次萃取与反萃取制备CoCl2 晶体:

(5)滤液 3 中加入萃取剂 I,然后用稀盐酸反萃取的目的是
(6)制备晶体CoCl2∙6H2O,需在减压环境下烘干的原因是
(7)测定产品的纯度:称取 CoCl2∙6H2O 样品,将其用适当试剂转化为 CoC2O4,再转化为(NH4)2C2O4溶液,稀硫酸酸化后用高锰酸钾标准溶液滴定,滴定终点的判定
您最近一年使用:0次
解题方法
3 . 下列各组离子在水溶液中能大量共存的是
A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)写出下列实验事实与所给酸对应的性质(填序号)
A.酸性 B.挥发性 C.吸水性 D.脱水性 E.不稳定性 F.氧化性
①浓硝酸使紫色石蕊试液先变红后褪色___________
②浓硫酸可作氯气的干燥剂___________
③浓硫酸加到蔗糖中,蔗糖变黑___________
(2)“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是___________
①制 :
: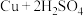 (浓)
(浓)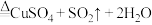
②制 ;
;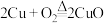 ;
; (稀)
(稀)
③制 :
: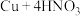 (浓)
(浓)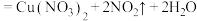
④制 :
: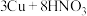 (稀)
(稀)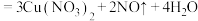
(3)某同学向 溶液中通入
溶液中通入 ,未观察到白色沉淀生成,由此可知酸性强弱:
,未观察到白色沉淀生成,由此可知酸性强弱:
___________ HCl(填“>”或“<”)。取上述所得溶液进行下列操作,能观察到白色沉淀生成的___________ (填字母)。
A.通入 B.滴加
B.滴加 溶液 C.滴加稀盐酸 D.滴加NaOH溶液
溶液 C.滴加稀盐酸 D.滴加NaOH溶液
(4) 中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、
中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、 溶液、
溶液、 、NaOH溶液、氨水。
、NaOH溶液、氨水。
①要证明 具有还原性,应选用的试剂是
具有还原性,应选用的试剂是___________ ,看到的现象是___________ 。
②选用 与
与 反应,反应的现象是
反应,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)写出下列实验事实与所给酸对应的性质(填序号)
A.酸性 B.挥发性 C.吸水性 D.脱水性 E.不稳定性 F.氧化性
①浓硝酸使紫色石蕊试液先变红后褪色
②浓硫酸可作氯气的干燥剂
③浓硫酸加到蔗糖中,蔗糖变黑
(2)“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
①制
 :
: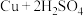 (浓)
(浓)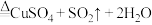
②制
 ;
;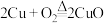 ;
; (稀)
(稀)
③制
 :
: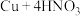 (浓)
(浓)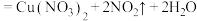
④制
 :
: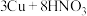 (稀)
(稀)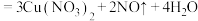
(3)某同学向
 溶液中通入
溶液中通入 ,未观察到白色沉淀生成,由此可知酸性强弱:
,未观察到白色沉淀生成,由此可知酸性强弱:
A.通入
 B.滴加
B.滴加 溶液 C.滴加稀盐酸 D.滴加NaOH溶液
溶液 C.滴加稀盐酸 D.滴加NaOH溶液(4)
 中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、
中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、 溶液、
溶液、 、NaOH溶液、氨水。
、NaOH溶液、氨水。①要证明
 具有还原性,应选用的试剂是
具有还原性,应选用的试剂是②选用
 与
与 反应,反应的现象是
反应,反应的现象是
您最近一年使用:0次
5 . 溴、碘主要存在于海水里,有“海洋元素”的美称。我国海带产量位居世界第一,海带除供食用外,还可大量用于制碘。从海带中提取碘单质的工艺流程如图。请回答下列问题:
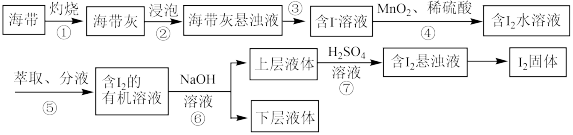
(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是_____ (填氢化物的化学式),位于元素周期表前五周期的第ⅦA族元素对应的单质的氧化性由强到弱的顺序为_____ (填化学式), 的空间结构为
的空间结构为_____ 。
(2)步骤④发生反应的离子方程式为_____ (已知: 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用_____ (填标号)代替。
A. B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用_____ 吸收含溴单质的空气来达到富集溴元素的目的。

(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是
 的空间结构为
的空间结构为(2)步骤④发生反应的离子方程式为
 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用A.
 B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用
您最近一年使用:0次
解题方法
6 . 已知 与足量的
与足量的 硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是
硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是
 与足量的
与足量的 硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是
硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是A. 中硫元素被还原 中硫元素被还原 |
B.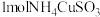 完全反应,转移 完全反应,转移 电子 电子 |
| C.该反应中硫酸既体现了酸性又体现了氧化性 |
| D.刺激性气味的气体是二氧化硫和氨气 |
您最近一年使用:0次
7 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于水,可溶于氯离子浓度较大的体系,易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,生产CuCl的工艺如下:
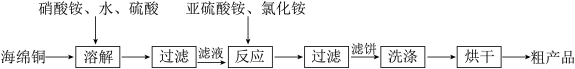
下列说法错误的是

下列说法错误的是
A.“溶解”过程发生氧化还原反应的离子方程式是3Cu+8H++2NO =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
B.“反应”过程发生反应的离子方程式是Cu2++SO +Cl-+H2O=CuCl↓+SO +Cl-+H2O=CuCl↓+SO +2H+ +2H+ |
| C.“溶解”过程中硫酸可用浓盐酸代替 |
| D.“烘干”需在隔绝空气的环境中进行 |
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.利用下图装置制备 ,并研究
,并研究 的性质。
的性质。

(1)A装置利用亚硫酸钠和硫酸反应制备 ,写出化学方程式
,写出化学方程式___________ 。
(2)填写下表
(3)SO2和氯气按照体积比1∶1通入水中,溶液的漂白性___________ (填“增强”“减弱”“不变”)原因是__________ (用化学方程式表示)。
Ⅱ.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
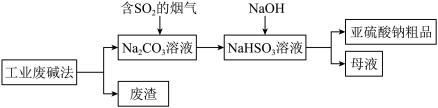
(4)上述流程中,加入 后,发生反应的离子方程式为
后,发生反应的离子方程式为___________ 。
(5)亚硫酸钠粗品中含有少量 ,原因是
,原因是___________ 。
 ,并研究
,并研究 的性质。
的性质。
(1)A装置利用亚硫酸钠和硫酸反应制备
 ,写出化学方程式
,写出化学方程式(2)填写下表
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色 | ||
| 体现SO2的性质 |
Ⅱ.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为
 )吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
(4)上述流程中,加入
 后,发生反应的离子方程式为
后,发生反应的离子方程式为(5)亚硫酸钠粗品中含有少量
 ,原因是
,原因是
您最近一年使用:0次
解题方法
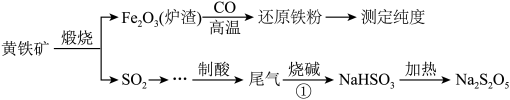
9 . 以黄铁矿(主要成分 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠(
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠( ,
,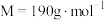 ),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
回答下列问题:
(1) 中硫元素的化合价为
中硫元素的化合价为___________ 。
(2)由炉渣制备还原铁粉的化学方程式为___________ 。
(3)生产 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式
过饱和溶液经结晶脱水制得。写出该过程的化学方程式___________ 。
(4)①实验制得的 固体中含有少量
固体中含有少量 杂质,文字叙述其可能的原因是
杂质,文字叙述其可能的原因是________ 。
②葡萄酒酿造过程中要添加 作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是
作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是___________ 。
(5) 纯度测定:取
纯度测定:取 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,向其中滴加
该溶液,向其中滴加 的碘溶液,最终滴加
的碘溶液,最终滴加 碘溶液将溶液中
碘溶液将溶液中 恰好完全反应。此过程反应的离子方程式为
恰好完全反应。此过程反应的离子方程式为________ ;样品中 的质量分数为
的质量分数为________ (已知其它杂质不反应)。
 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠(
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠( ,
,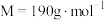 ),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
回答下列问题:
(1)
 中硫元素的化合价为
中硫元素的化合价为(2)由炉渣制备还原铁粉的化学方程式为
(3)生产
 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式
过饱和溶液经结晶脱水制得。写出该过程的化学方程式(4)①实验制得的
 固体中含有少量
固体中含有少量 杂质,文字叙述其可能的原因是
杂质,文字叙述其可能的原因是②葡萄酒酿造过程中要添加
 作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是
作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是(5)
 纯度测定:取
纯度测定:取 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,向其中滴加
该溶液,向其中滴加 的碘溶液,最终滴加
的碘溶液,最终滴加 碘溶液将溶液中
碘溶液将溶液中 恰好完全反应。此过程反应的离子方程式为
恰好完全反应。此过程反应的离子方程式为 的质量分数为
的质量分数为
您最近一年使用:0次
10 . 碘是人体不可缺少的微量元素,采用离子交换法从卤水(富含 )中提取碘的工艺流程如下。下列说法错误的是
)中提取碘的工艺流程如下。下列说法错误的是
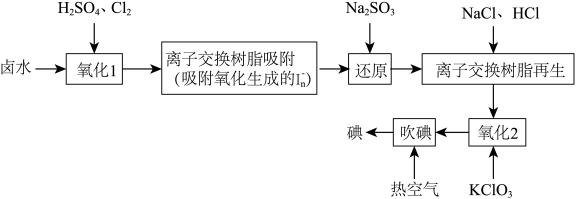
 )中提取碘的工艺流程如下。下列说法错误的是
)中提取碘的工艺流程如下。下列说法错误的是
A.“氧化1”的主要离子方程式为 |
| B.离子交换树脂的作用是富集碘元素 |
C.理论上参加反应的 |
| D.“吹碘”鼓入热空气是利用了I2易升华的性质 |
您最近一年使用:0次



