名校
1 . 下列物质都能与浓热氢氧化钠溶液反应,产生气体与众不同的是
| A.Al | B.Si | C.P | D.B |
您最近一年使用:0次
名校
解题方法
2 . 下列反应的化学或离子方程式错误的是
A. 制 制 的离子方程式: 的离子方程式: |
B.白磷与 溶液反应: 溶液反应: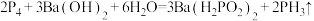 |
C. 与足量的 与足量的 溶液反应的离子方程式: 溶液反应的离子方程式: |
D.雌黄制备雄黄的方程式: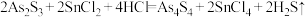 |
您最近一年使用:0次
3 . 大多数离子液体含有体积很大的阴、阳离子(如图所示)。其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同主族。下列说法正确的是
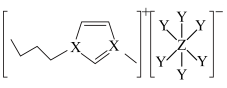

| A.Z的氯化物的分子式一定为ZCl3 | B.气态氢化物的熔沸点:Z>Y>X |
| C.电负性:Y>X>Z | D.此阴离子中Y、Z均满足8电子稳定结构 |
您最近一年使用:0次
4 . 碳酸锂是制备各种锂化合物的关键原料。一种以磷酸锂渣(主要成分Li3PO4)为原料制备碳酸锂的工艺流程示意图如下。
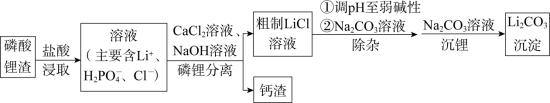
已知:部分物质的溶解性表(20℃)
(1)写出浸取时Li3PO4与盐酸反应的化学方程式:_______ 。
(2)加入盐酸的量不宜过多的原因是_______ 。
(3)钙渣的主要成分是_______ 。
(4)磷锂分离时,需要不断加入适量NaOH溶液以维持溶液的pH基本不变。结合离子方程式解释其原因是_______ 。
(5)沉锂时,反应的离子方程式是_______ 。

已知:部分物质的溶解性表(20℃)
| 阳离子 | 阴离子 | ||
 |  | 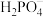 | |
| Li+ | 难溶 | 可溶 | 易溶 |
| Ca2+ | 难溶 | 难溶 | 可溶 |
(2)加入盐酸的量不宜过多的原因是
(3)钙渣的主要成分是
(4)磷锂分离时,需要不断加入适量NaOH溶液以维持溶液的pH基本不变。结合离子方程式解释其原因是
(5)沉锂时,反应的离子方程式是
您最近一年使用:0次
5 .  为正盐,能将溶液中的
为正盐,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是
 为正盐,能将溶液中的
为正盐,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是A.上述反应中,氧化产物是 |
| B.该反应氧化剂与还原剂的物质的量之比为1∶4 |
C. 中含有离子键、极性共价键和非极性共价键 中含有离子键、极性共价键和非极性共价键 |
D. 是三元酸,与 是三元酸,与 反应可生成三种盐 反应可生成三种盐 |
您最近一年使用:0次
名校
解题方法
6 . 关于非金属含氧酸及其盐的性质,下列说法正确的是
A.浓 具有强吸水性,能吸收糖类化合物中的水分并使其炭化 具有强吸水性,能吸收糖类化合物中的水分并使其炭化 |
B.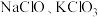 等氯的含氧酸盐均可用于制取氯气 等氯的含氧酸盐均可用于制取氯气 |
C.加热 与浓 与浓 混合物可制备 混合物可制备 ,说明 ,说明 比 比 酸性强 酸性强 |
D.浓 和稀 和稀 与 与 反应的还原产物分别为 反应的还原产物分别为 和 和 ,故稀 ,故稀 氧化性更强 氧化性更强 |
您最近一年使用:0次
7 . 实验室利用红磷(P)与Cl2反应可制取少量PCl3或PCl5。
I.利用如图所示装置制取少量PCl3(部分夹持装置已略去)。
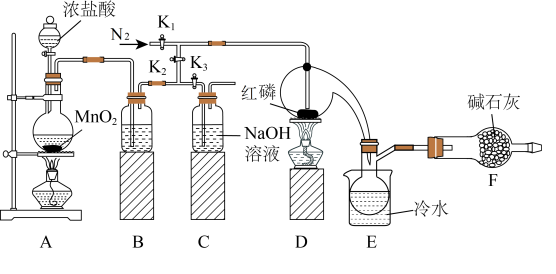
(1)组装好装置,在放入试剂前应先_____ 。
(2)A中发生反应的离子方程式为_____ 。
(3)B中所装试剂为_____ 。
(4)实验开始前,打开K1通入一段时间氮气来除去装置中的空气,除去空气的目的是_____ ;除去装置A、B中空气的具体方法是_____ 。
(5)除去产物中PCl5杂质的化学反应方程式是_____ 。
II.测定产品中PCl3的质量分数
实验步骤:
①迅速称取mg产品,加水反应后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反应。
③向②所得溶液中加入几滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振荡,当溶液恰好由蓝色变为无色时,记录所消耗Na2S2O3溶液的体积。
④重复②、③操作3次,平均消耗Na2S2O3溶液V2mL。
(6)第①步溶于水的化学反应方程式是_____ 。
(7)逐滴滴加Na2S2O3溶液使用的仪器是_____ 。(已知:H2S2O3是弱酸)。
(8)根据上述数据测得该产品中PCl3的质量分数为_____ 。(已知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6)
| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,与O2反应生成POCl3 |
| PCl5 | — | 约100℃升华 | 遇水生成H3PO4和HCl,与红磷反应生成PCl3 |

(1)组装好装置,在放入试剂前应先
(2)A中发生反应的离子方程式为
(3)B中所装试剂为
| A.饱和碳酸氢钠溶液 | B.饱和氯化钠溶液 |
| C.氢氧化钠溶液 | D.浓硫酸 |
(5)除去产物中PCl5杂质的化学反应方程式是
II.测定产品中PCl3的质量分数
实验步骤:
①迅速称取mg产品,加水反应后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反应。
③向②所得溶液中加入几滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振荡,当溶液恰好由蓝色变为无色时,记录所消耗Na2S2O3溶液的体积。
④重复②、③操作3次,平均消耗Na2S2O3溶液V2mL。
(6)第①步溶于水的化学反应方程式是
(7)逐滴滴加Na2S2O3溶液使用的仪器是
(8)根据上述数据测得该产品中PCl3的质量分数为
您最近一年使用:0次
名校
解题方法
8 .  为正盐,其中P为
为正盐,其中P为 价O为
价O为 价,能将溶液中的
价,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是
 为正盐,其中P为
为正盐,其中P为 价O为
价O为 价,能将溶液中的
价,能将溶液中的 还原为
还原为 ,可用于化学镀银。反应的离子方程式为
,可用于化学镀银。反应的离子方程式为 。下列说法正确的是
。下列说法正确的是A.上述反应中,氧化产物是 |
| B.该反应氧化剂与还原剂的物质的量之比为1∶4 |
C. 溶于水破坏离子键、极性共价键和非极性共价键 溶于水破坏离子键、极性共价键和非极性共价键 |
D. 是三元酸,与 是三元酸,与 反应可生成三种盐 反应可生成三种盐 |
您最近一年使用:0次
2023-03-23更新
|
204次组卷
|
3卷引用:广西壮族自治区玉林市第一中学2022-2023学年高二上学期期末考试化学试题
名校
9 . 根据物质类别预测物质性质是常用的方法之一,下列预测正确的是
| 选项 | 已知性质 | 性质预测 |
| A | Fe能置换出 溶液中的Cu 溶液中的Cu | Na也能置换出 溶液中的Cu 溶液中的Cu |
| B | 氮气与氧气不容易化合 | 磷单质与氧气也不容易化合 |
| C |  能使澄清石灰水变浑浊 能使澄清石灰水变浑浊 |  也能使澄清石灰水变浑浊 也能使澄清石灰水变浑浊 |
| D |  通入氯化钡溶液,溶液不变浑浊 通入氯化钡溶液,溶液不变浑浊 |  通入硝酸钡溶液,溶液也不变浑浊 通入硝酸钡溶液,溶液也不变浑浊 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-18更新
|
222次组卷
|
2卷引用:广东省汕尾市2022-2023学年高一上学期期末考试化学试题
名校
10 . I、高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+ NaOH + Cl2→ Na2FeO4+ NaNO3+ NaCl + H2O
(1)高铁酸钠中,铁元素的化合价是_______ ;上述制取铁酸钠的反应中,铁元素被_______ (填“还原”或“氧化”)。
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法_______ 。
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为_______ 。
②除去FeCl3溶液中混有的FeCl2可加入或通入_______ 。
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为_______ (填化学式)。
②从分类来看,NaH2PO2属于_______ 。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式_______ 。
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为
②除去FeCl3溶液中混有的FeCl2可加入或通入
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
您最近一年使用:0次
2022-10-31更新
|
145次组卷
|
2卷引用:湖南省邵阳市第二中学2021-2022学年高一上学期第一次月考化学试题



