真题
解题方法
1 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______________ 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________ ,氧化性最弱的简单阳离子是___ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是___________________________ ;制铝时,电解Al2O3而不电解AlCl3的原因是_________________________________________ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:____________ ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______________________________ 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是_______ 。
a. NH3b. HI c. SO2d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____________ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)
 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)写出SiCl4的电子式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a. NH3b. HI c. SO2d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:
您最近一年使用:0次
2016-12-09更新
|
2295次组卷
|
4卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)
2011·天津·一模
2 . 某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成分、性质和用途,设计了如下实验步骤:
Ⅰ、用下列实验装置制取纯净干燥的氯气

写出A、B中所盛放最佳化学试剂的名称_________ 、__________ ,画出虚线框内所需装置图并标明所需试剂的名称_________ 。
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:_________ ;假设③:_________ 。
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
由此得出结论:假设_______ 成立(填序号①②③)。
Ⅲ、为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_________ (填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]< Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV、a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式___________ 。活动小组的同学们又设计了两种从上述废液中回收Cu的方案:
方案1:设计流程图如下:
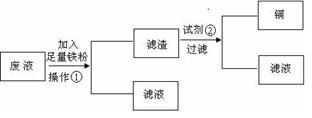
请分别写出操作①和试剂②的名称_________ ,_______ 。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作________ 极。当观察到阴极有少量气泡产生时,停止电解,这时要回收的Cu已全部析出。
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:______________ 。
Ⅰ、用下列实验装置制取纯净干燥的氯气

写出A、B中所盛放最佳化学试剂的名称
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 向a溶液中滴加酸性KMnO4溶液 | KMnO4溶液紫色不褪色 | 固体物质中不含 |
由此得出结论:假设
Ⅲ、为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Ksp[Fe(OH)3]< Ksp[Mg(OH)2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
IV、a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式
方案1:设计流程图如下:

请分别写出操作①和试剂②的名称
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:
您最近一年使用:0次
3 . 现有A、B、C、D、E、F、G七种元素,其中 A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;常温下D2是气体,标况时D2气体的密度约是1.43g/L;E原子半径在同周期中除稀有气体外最大, F原子M层上的电子比K层多5个。金属G的合金在生活中用量最大,用途最广。
(1)G在元素周期表中的位置是_________ ,画出F的离子结构示意图____________
(2)D、E、F离子半径由大到小顺序为:___________________ (用离子符号表示)
(3)A与D可形成原子个数比为1:1的化合物,用电子式表示该化合物的形成过程_________________________
(4)D与E形成某离子化合物H具有漂白性,写出H的电子式_______________ ,该化合物和B与D形成的某化合物反应的化学方程式为:_______________ ,1molH发生该反应转移电子数为_____________
(5)若X为正盐,X中含有的化学键类型为_______________ ,写出加热该盐的化学方程式:_______________
(6)B和F两种元素相比较,原子得电子能力较强的为_______________ ,以下三种说法中,可以验证B和F得电子能力强弱的是_______________ (填写编号);
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(7)金属元素G可与F形成化合物GF3。将G的单质与石墨用导线相连浸入GF3溶液中形成一个原电池。该原电池工作时,石墨一极发生的反应可以表示为___________ ,当有1.2mol e-转移时单质G质量变化为___________ g
(8)用A元素的单质与D元素的常见单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入A的单质,乙极通入D的单质,则甲极的电极反应式为:___________________ 。
(1)G在元素周期表中的位置是
(2)D、E、F离子半径由大到小顺序为:
(3)A与D可形成原子个数比为1:1的化合物,用电子式表示该化合物的形成过程
(4)D与E形成某离子化合物H具有漂白性,写出H的电子式
(5)若X为正盐,X中含有的化学键类型为
(6)B和F两种元素相比较,原子得电子能力较强的为
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(7)金属元素G可与F形成化合物GF3。将G的单质与石墨用导线相连浸入GF3溶液中形成一个原电池。该原电池工作时,石墨一极发生的反应可以表示为
(8)用A元素的单质与D元素的常见单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入A的单质,乙极通入D的单质,则甲极的电极反应式为:
您最近一年使用:0次
4 . 氢能是发展中的新能源,它的利用包括氢的制备、保存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是______________ (至少答出两点)。但是氢气直接燃烧的能量及转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_____________________________ 。
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) ΔH1O2(g)+B(l)=A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)=H2O2(l)的ΔH____ 0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________ 。
a.容器内气体压强保持不变b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______ 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH− FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
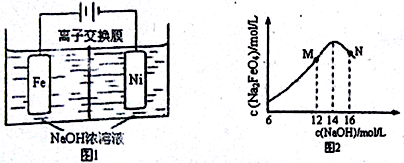
①电解一段时间后,c(OH-)降低的区域在_______ (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________________ 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_______________________________________________ 。
(1)与汽油相比,氢气作为燃料的优点是
(2)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l) ΔH1O2(g)+B(l)=A(l)+H2O2(l) ΔH2,其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)=H2O2(l)的ΔH
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)=MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是
a.容器内气体压强保持不变b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−
 FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH-)降低的区域在
②电解过程中,须将阴极产生的气体及时排出,其原因是
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:
您最近一年使用:0次
2016-12-09更新
|
1158次组卷
|
4卷引用:2016年全国普通高等学校招生统一考试化学(天津卷精编版)
2016年全国普通高等学校招生统一考试化学(天津卷精编版)(已下线)2016年全国普通高等学校招生统一考试化学(天津卷参考版)江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷
5 . 某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
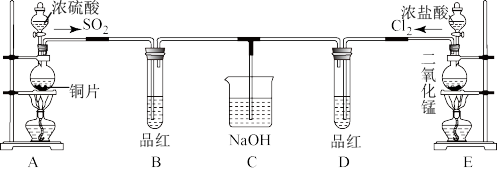
(1)写出A中反应的化学方程式__________ ,浓硫酸表现出__________ 性。
(2)实验室用装置E制备Cl2,离子方程式为:_____________ 该反应中的还原剂是_________ (填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________ (填名称)
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:__________ ,D:__________ .
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________________ (用化学方程式表示)。
(5)第三个实验小组同学查阅资料得知:氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
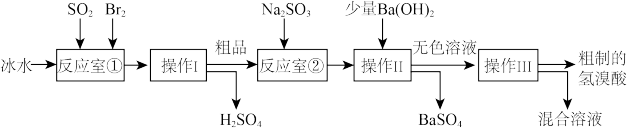
已知:Br 2是易挥发、深红棕色的液体,与Cl2化学性质相似;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
①反应室①使用冰水的目的___________ 。
②操作I的名称__________ ,操作Ⅱ的名称___________ 。
③反应室②中加入Na2SO3的目的是_____________ 。
④工业生产中制得的氢溴酸带有淡黄色。于是甲乙两同学设计了实验加以探究:
A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_____________ ,若假设成立可观察到的现象为___________ 。
B.乙同学假设工业氢溴酸呈淡黄色是因为___________ ,其用于证明该假设成立的方法为____________ 。

(1)写出A中反应的化学方程式
(2)实验室用装置E制备Cl2,离子方程式为:
(3)①装置A和E中,常用于萃取操作的仪器是
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:
(5)第三个实验小组同学查阅资料得知:氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:

已知:Br 2是易挥发、深红棕色的液体,与Cl2化学性质相似;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
①反应室①使用冰水的目的
②操作I的名称
③反应室②中加入Na2SO3的目的是
④工业生产中制得的氢溴酸带有淡黄色。于是甲乙两同学设计了实验加以探究:
A.甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为
B.乙同学假设工业氢溴酸呈淡黄色是因为
您最近一年使用:0次
2016-12-09更新
|
1734次组卷
|
2卷引用:2015-2016学年天津市红桥区高一上学期期末考试化学试卷
解题方法
6 . A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
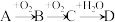
(1)若A是一种金属,C是淡黄色固体,写出C的一种用途____ ;
(2)若A为淡黄色固体单质,写出D的浓溶液与铜反应的化学方程式_____ ;
(3)若A为单质,D为弱酸,则A在工业生产中可用于制备同族另一种非金属单质,该反应的化学方程式为____ ;
(4)若A是化合物,C是红棕色气体,则A的化学式为_____ ;C转化为D的过程中,氧化剂与还原剂的质量比为____ 。
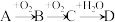
(1)若A是一种金属,C是淡黄色固体,写出C的一种用途
(2)若A为淡黄色固体单质,写出D的浓溶液与铜反应的化学方程式
(3)若A为单质,D为弱酸,则A在工业生产中可用于制备同族另一种非金属单质,该反应的化学方程式为
(4)若A是化合物,C是红棕色气体,则A的化学式为
您最近一年使用:0次
名校
解题方法
7 . 镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示:
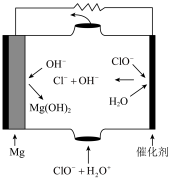
该电池的正极反应式为__________________________________ 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=H2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) =2Mg(s)+Mg2NiH4(s)的△H3=__________ 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
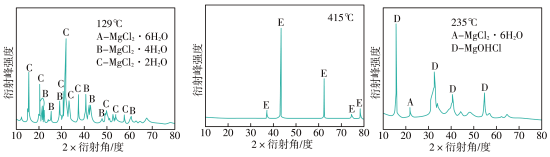
测得E中Mg元素质量分数为60.0%,则E的化学式为_______ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为__________________ 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2==MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________ 。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示:

该电池的正极反应式为
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=H2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) =2Mg(s)+Mg2NiH4(s)的△H3=
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:

①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。

测得E中Mg元素质量分数为60.0%,则E的化学式为
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2==MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为
您最近一年使用:0次
2016-12-09更新
|
850次组卷
|
2卷引用:2015届天津市和平区高三4月模拟练习理科综合化学试卷
14-15高一上·天津东丽·期末
名校
8 . 下列有关物质的用途错误的是
| A.水玻璃可用作木材防火剂 |
| B.二氧化硅是制造光导纤维的材料 |
| C.石英是制造太阳能电池的常用材料 |
| D.石灰石和纯碱均是生产普通玻璃的原料 |
您最近一年使用:0次
解题方法
9 . 从铝土矿(主要成分是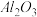 ,含
,含 、
、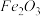 等杂质)中提取
等杂质)中提取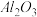 的两种方法如下:
的两种方法如下:
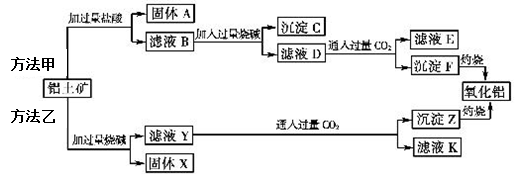
请回答下列问题:
(1)方法甲中,固体A的化学式____________
(2)方法乙加入烧碱后生成SiO32-的离子方程式为___________________
(3)简述检验滤液B中含 的方法
的方法______________________________
(4)滤液K中溶质的主要成份是__________ (填化学式),写出该物质的一种用途_____________ 。
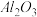 ,含
,含 、
、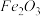 等杂质)中提取
等杂质)中提取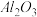 的两种方法如下:
的两种方法如下:
请回答下列问题:
(1)方法甲中,固体A的化学式
(2)方法乙加入烧碱后生成SiO32-的离子方程式为
(3)简述检验滤液B中含
 的方法
的方法(4)滤液K中溶质的主要成份是
您最近一年使用:0次
10 . PVB(聚乙烯醇缩丁醛)和PI(聚异戊二烯)均为用途广泛的有机制品,用乙炔为原料制备PVB和PI的流程如图。

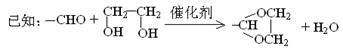
(1)A中的官能团名称是_____ 。
(2)已知反应⑤属于加成反应,上述转化中还有_____ (填序号)也属于该反应类型。
(3)反应③的条件是_____ 。
(4)E是A的同分异构体,E的核磁共振氢谱显示有2种不同化学环境的氢,且E能发生银镜反应E发生银镜反应的化学方程式是_________________ 。
(5)反应⑦的化学方程式是_______________ 。
(6)依照PI的合成路线,若将反应①中的反应物“ ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是_____ 。
(7)已知: ,以
,以 为原料合成
为原料合成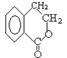 ,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式
,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式______________________________________________________________ 。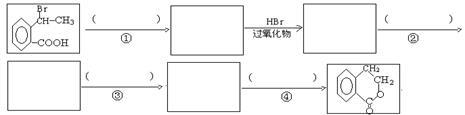

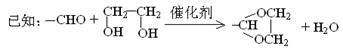
(1)A中的官能团名称是
(2)已知反应⑤属于加成反应,上述转化中还有
(3)反应③的条件是
(4)E是A的同分异构体,E的核磁共振氢谱显示有2种不同化学环境的氢,且E能发生银镜反应E发生银镜反应的化学方程式是
(5)反应⑦的化学方程式是
(6)依照PI的合成路线,若将反应①中的反应物“
 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是(7)已知:
 ,以
,以 为原料合成
为原料合成 ,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式
,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式
您最近一年使用:0次



