名校
1 . 按要求回答下列问题:
(1)写出乙烯分子的结构式:___________ 。
(2)写出有机物2-甲基-1,3-丁二烯的结构简式___________ 。
(3)下列物质的沸点按由高到低的顺序排列正确的是___________。
①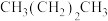 ②
②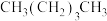 ③
③ ④
④
(4)下列选项中互为同系物的是___________ ;互为同分异构体的是___________ ;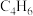 的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为
的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为___________ 。
(1)写出乙烯分子的结构式:
(2)写出有机物2-甲基-1,3-丁二烯的结构简式
(3)下列物质的沸点按由高到低的顺序排列正确的是___________。
①
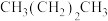 ②
②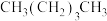 ③
③ ④
④
| A.②④①③ | B.④②①③ | C.④③②① | D.②④③① |
(4)下列选项中互为同系物的是
① 和
和 ②
②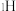 、
、 、
、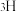 ③
③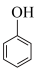 与
与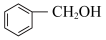 ④
④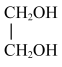 与
与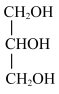 ⑤
⑤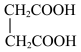 与
与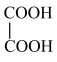 ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦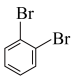 与
与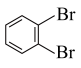
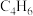 的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为
的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为
您最近一年使用:0次
2024-05-04更新
|
475次组卷
|
3卷引用:辽宁省铁岭市昌图县第一高级中学2023-2024学年高二下学期4月月考化学试卷
解题方法
2 . A、B、C、D、E五种元素的核电荷数依次增大,且都小于20,其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1;B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍;C原子的最外层电子数等于D原子的最外层电子数的一半,请回答下列问题:
(1)A元素基态原子占据最高能级的电子云轮廓图为________ 形;B元素原子中未成对电子为________ 。
(2)写出C元素基态原子简化的电子排布式:________ ;AB组成的最简单化合物的分子构型为________ 。
(3)D元素的价层电子排布图为:________ 。
(4)元素B与D的电负性的大小关系是B________ D(填“>”“<”或“=”,下同),与C相邻的同周期两种元素与C的第一电离能大小由强到弱顺序为________ (用三种元素符号表示)。
(1)A元素基态原子占据最高能级的电子云轮廓图为
(2)写出C元素基态原子简化的电子排布式:
(3)D元素的价层电子排布图为:
(4)元素B与D的电负性的大小关系是B
您最近一年使用:0次
3 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。
(1)以 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。
① 分子空间构型为
分子空间构型为________ ,写出 极易溶于水的原因
极易溶于水的原因________ 。
②实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

ⅰ.两种晶胞所含铁原子个数比为________ 。
ⅱ.图1晶胞的棱长为apm( ),则其密度
),则其密度
________  (写出化简的表达式)。
(写出化简的表达式)。
③我国科学家开发出Fe-LiH双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能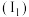 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因________ 。
(2) 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为________ 。
② 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是________ 。其他含氮配合物,如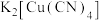 的配离子是
的配离子是________ 、配合物 的配体是
的配体是________ ,配位数为________ 。
(3)常温下 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
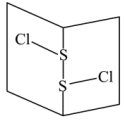
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有________ 键(填“极性”、“非极性”,下同),是________ 分子。
(4)已知N、P、As为同一主族元素,则写出三种元素最简单氢化物沸点由高到低的顺序为(用化学式表示)________ 。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。(1)以
 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。①
 分子空间构型为
分子空间构型为 极易溶于水的原因
极易溶于水的原因②实际生产中采用铁的氧化物
 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为apm(
 ),则其密度
),则其密度
 (写出化简的表达式)。
(写出化简的表达式)。③我国科学家开发出Fe-LiH双中心催化剂,在合成
 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能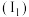 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因(2)
 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。①
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是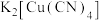 的配离子是
的配离子是 的配体是
的配体是(3)常温下
 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有(4)已知N、P、As为同一主族元素,则写出三种元素最简单氢化物沸点由高到低的顺序为(用化学式表示)
您最近一年使用:0次
解题方法
4 . 高氯酸三碳酰肼合镍化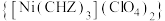 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:
(1)基态铜原子的价电子的轨道表示式为________ 。
(2)基态碳原子核外电子有________ 种不同运动状态。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为________ , 的VSEPR模型是
的VSEPR模型是________ 。
(4)化学式中的CHZ为碳酰肼,其结构为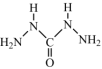 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:
①CHZ中氮原子的杂化轨道类型为________ 。
②1molCHZ中含有的 键数目为
键数目为________  。
。
③键角:
________ (填“>”“<”或“=”) 。
。
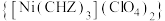 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:(1)基态铜原子的价电子的轨道表示式为
(2)基态碳原子核外电子有
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为 的VSEPR模型是
的VSEPR模型是(4)化学式中的CHZ为碳酰肼,其结构为
 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:①CHZ中氮原子的杂化轨道类型为
②1molCHZ中含有的
 键数目为
键数目为 。
。③键角:

 。
。
您最近一年使用:0次
5 . 2021年10月16日,神舟十三号载人飞船与“天和”核心舱成功径向交会对接。化学助力我国航天事业发展,借助元素周期表可以认识各种材料的组成、结构和性质。a~h8种元素在元素周期表中的位置如下:
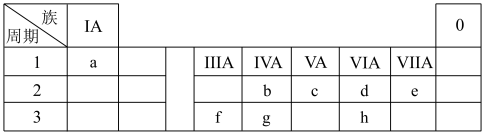
(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为________ (填化学式)。
(2)g单质在太阳能电池和芯片制造等领域有着重要应用,g最高价氧化物的化学式为________ ;b的氧化物含有的化学键类型为________ 。(填“离子键”“极性键”或“非极性键”)
(3)飞船的制造使用了f的合金,f的简单离子结构示意图为________ ,比较f和g原子半径大小:f________ (填“>”“<”或“=”)g。
(4)元素c与元素e所形成的简单氢化物的稳定性大小:c________ (填“>”“<”或“=”)e。
(5)试比较b、g两种元素最高价氧化物的晶体熔点大小b______ g(用化学式和“>”“<”表示)

(1)a的单质常用作火箭推进剂,该过程中a单质对应的产物为
(2)g单质在太阳能电池和芯片制造等领域有着重要应用,g最高价氧化物的化学式为
(3)飞船的制造使用了f的合金,f的简单离子结构示意图为
(4)元素c与元素e所形成的简单氢化物的稳定性大小:c
(5)试比较b、g两种元素最高价氧化物的晶体熔点大小b
您最近一年使用:0次
解题方法
6 . 下列关于范德华力与氢键的叙述中正确的是
| A.范德华力比氢键的作用还要弱 |
| B.物质的物理性质只与范德华力有关 |
| C.范德华力与氢键的强弱都只与相对分子质量有关 |
| D.任何物质中都存在范德华力,而氢键只存在于含有N、O、F的物质中 |
您最近一年使用:0次
解题方法
7 . 下列关于物质结构的描述中正确的是
A. 分子的空间填充模型: 分子的空间填充模型: |
B.基态 的价层电子轨道表示式为: 的价层电子轨道表示式为: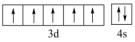 |
C. 分子中 分子中 键原子轨道电子云图: 键原子轨道电子云图: |
D.在1个 分子中共有3个 分子中共有3个 键,碳原子杂化方式有两种 键,碳原子杂化方式有两种 |
您最近一年使用:0次
名校
解题方法
8 . 有机物是一类重要的化合物,不仅种类繁多,而且与我们的日常生活密切相关。烷烃的主要来源是石油和天然气,是重要的化工原料和能源物资。几种烷烃分子的球棍模型如图:___________ (选填编号)。
a.都是可燃物 b.特征反应是取代反应
c.随碳原子个数的增加,沸点依次升高 d.随氢原子个数增加,含氢量升高
(2) 分子中最多有
分子中最多有___________ 个碳原子处于同一平面。
(3)含有4个甲基的辛烷有___________ 种(不考虑立体异构),写出其中主链为5个碳原子的同分异构体的结构简式:___________ 。
(4)表中烷烃的氢原子的化学环境均只有一种,分析下表中各项的排布规律,按此规律排布第6项 应为
应为___________ (选填编号)。
a. b.
b. c.
c.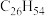 d.
d.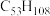
(5)烷烃的氯代物也有非常广泛的用途。全氯丁烷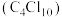 可作耐火材料。已知氯元素有两种稳定同位素:
可作耐火材料。已知氯元素有两种稳定同位素: 和
和 ,则
,则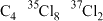 的分子结构有(不考虑立体异构)
的分子结构有(不考虑立体异构)___________ 种。
(6)通过燃烧法可以确定有机物的分子式。 时,某气态烃对氢气的相对密度为35,取该烃
时,某气态烃对氢气的相对密度为35,取该烃 与
与 (过量)混合,完全燃烧后生成标准状况下
(过量)混合,完全燃烧后生成标准状况下 ,则该烃的分子式是
,则该烃的分子式是___________ 。
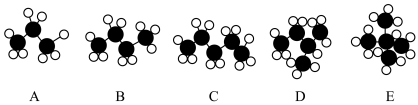
a.都是可燃物 b.特征反应是取代反应
c.随碳原子个数的增加,沸点依次升高 d.随氢原子个数增加,含氢量升高
(2)
 分子中最多有
分子中最多有(3)含有4个甲基的辛烷有
(4)表中烷烃的氢原子的化学环境均只有一种,分析下表中各项的排布规律,按此规律排布第6项
 应为
应为| 1 | 2 | 3 | 4 | 5 | 6 |  |
 |  | 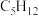 | 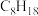 |  |
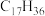 b.
b.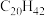 c.
c.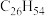 d.
d.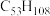
(5)烷烃的氯代物也有非常广泛的用途。全氯丁烷
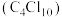 可作耐火材料。已知氯元素有两种稳定同位素:
可作耐火材料。已知氯元素有两种稳定同位素: 和
和 ,则
,则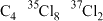 的分子结构有(不考虑立体异构)
的分子结构有(不考虑立体异构)(6)通过燃烧法可以确定有机物的分子式。
 时,某气态烃对氢气的相对密度为35,取该烃
时,某气态烃对氢气的相对密度为35,取该烃 与
与 (过量)混合,完全燃烧后生成标准状况下
(过量)混合,完全燃烧后生成标准状况下 ,则该烃的分子式是
,则该烃的分子式是
您最近一年使用:0次
2024-04-03更新
|
291次组卷
|
2卷引用:辽宁省铁岭市昌图县第一高级中学2023-2024学年高二下学期4月月考化学试卷
名校
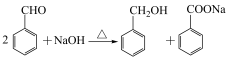
9 . 苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,某研究小组在实验室制备苯甲醇与苯甲酸,并测定苯甲酸的纯度。
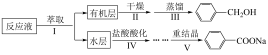
I.制备反应原理及反应结束后对反应液的处理步骤如下:
溴酚蓝:是一种pH指示剂,变色范围为pH=3.0(黄)~4.6(蓝);易溶于氢氧化钠溶液,溶于甲醇、乙醇和苯,微溶于水。
(1)关于制备、提纯过程下列说法正确的是_____。
(2)该小组拟用如图装置进行步骤Ⅲ,装置a应选用_____ (填字母代号),选择减压蒸馏的理由是_____ 。
Ⅱ.苯甲酸的纯度测定:
(3)为精确测定产品纯度,拟用以下实验方案:称取mg苯甲酸样品,溶于V1mL浓度为0.5 的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5
的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5 盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5
盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5 盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;
盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;
①“用0.5 盐酸调至酚酞红色消失”这一操作的作用是
盐酸调至酚酞红色消失”这一操作的作用是_____ 。
②滴定终点现象是_____ ;
③产品的纯度是_____ (以质量分数表示)。
I.制备反应原理及反应结束后对反应液的处理步骤如下:
| 名称 | 相对分子质量 | 熔点℃ | 沸点℃ | 溶解性 | 其他 |
| 苯甲醇 | 108 |  15.3 15.3 | 205.7 | 在水中溶解度较小,易溶于乙醚、乙醇 | 该品可燃,有毒,具刺激性 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | 微溶于冷水,易溶于乙醇、热水 | 毒性较小,引起皮肤刺 |

(1)关于制备、提纯过程下列说法正确的是_____。
| A.步骤I:可用乙醚作为萃取剂 |
| B.步骤Ⅳ:具体操作为热水溶解、加入活性炭脱色、冷却结晶 |
| C.步骤V:产品宜用冷水洗涤 |
| D.步骤V:产品可用酒精灯、沸水浴加热烘干 |
(2)该小组拟用如图装置进行步骤Ⅲ,装置a应选用
Ⅱ.苯甲酸的纯度测定:
(3)为精确测定产品纯度,拟用以下实验方案:称取mg苯甲酸样品,溶于V1mL浓度为0.5
 的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5
的氢氧化钠溶液中,加入1滴酚酞指示剂,用0.5 盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5
盐酸调至酚酞红色消失。加入适量乙醚、溴酚蓝指示剂,摇匀,用0.5 盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;
盐酸滴定,边滴定边将水层和乙醚层充分摇匀,达到滴定终点,记录耗酸体积。做3组平行实验,所消耗盐酸的平均体积为V2mL;①“用0.5
 盐酸调至酚酞红色消失”这一操作的作用是
盐酸调至酚酞红色消失”这一操作的作用是②滴定终点现象是
③产品的纯度是
您最近一年使用:0次
2024-04-03更新
|
427次组卷
|
2卷引用:辽宁省铁岭市昌图县第一高级中学2023-2024学年高二下学期4月月考化学试卷
名校
10 . 同分异构体是物质多样性的重要原因之一。下列说法中正确的是
A.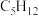 有2种同分异构体 有2种同分异构体 |
| B.相对分子质量相同、结构不同的两种化合物互为同分异构体 |
| C.同分异构体之间的转化是化学变化 |
D.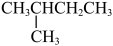 和 和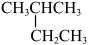 互为同分异构体 互为同分异构体 |
您最近一年使用:0次
2024-04-03更新
|
453次组卷
|
3卷引用:辽宁省铁岭市昌图县第一高级中学2023-2024学年高二下学期4月月考化学试卷



