解题方法
1 . 用下列装置进行实验,不能达到实验目的的是


A.装置①可用于收集 、 、 、 、 等气体 等气体 |
B.装置②除去 胶体中的 胶体中的 、 、 |
| C.装置③用石墨作电极电解饱和食盐水可制备NaClO |
D.装置④若用于吸收 ,并防止倒吸,则X可为 ,并防止倒吸,则X可为 |
您最近一年使用:0次
2022-11-28更新
|
196次组卷
|
3卷引用:安徽省铜陵市等5地2022届高三下学期二模统考化学试题
名校
2 . 下列实验装置能达到相应实验目的的是

| A.图A是制备氯气 |
| B.图B是制备并检验SO2气体的性质 |
| C.图C是检查装置的气密性 |
| D.图D是收集NO |
您最近一年使用:0次
2022-03-17更新
|
488次组卷
|
6卷引用:安徽省铜陵市第一中学2022-2023 学年高一下学期期中教学质量检测化学试题
解题方法
3 . 乙酸正丁酯(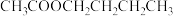 )是无色透明液体,具有强烈香蕉味,沸点为125℃。是重要的有机化工原料,被广泛用于溶剂、涂料和医药等行业。实验室用如下方法制备乙酸正丁酯:
)是无色透明液体,具有强烈香蕉味,沸点为125℃。是重要的有机化工原料,被广泛用于溶剂、涂料和医药等行业。实验室用如下方法制备乙酸正丁酯:
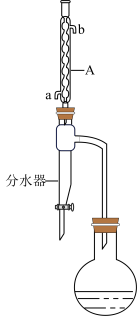
Ⅰ.在50mL的圆底烧瓶中加入10.0mL正丁醇(微溶于水)、8mL冰醋酸和0.5g硫酸镍,混合均匀后加入几粒沸石,连接装置如图所示(夹持和加热装置已略去)。
Ⅱ.反应约1h后停止加热,冷却,过滤分离出催化剂,将烧瓶中的混合物与分水器中的酯层合并,转入分液漏斗中,用10mL饱和碳酸钠溶液洗涤至中性,再依次用饱和氯化钠溶液、饱和氯化钙溶液洗涤,分出酯层。
Ⅲ.将分离出来的酯层倒入干燥锥形瓶中,加入1~2g无水硫酸镁,过滤,将酯层转移到干燥的蒸馏烧瓶中,加入几粒沸石进行蒸馏,收集122~126℃的馏分。
回答下列问题:
(1)仪器A的名称为_______ 。
(2)写出生成乙酸正丁酯的化学方程式:_______ 。
(3)用10mL饱和碳酸钠溶液洗涤的目的是_______ 。
(4)向分液漏斗中加入饱和碳酸钠溶液洗涤时,在摇动后应进行的操作是_______ 。
(5)步骤Ⅲ加入无水硫酸镁的目的是_______ ;该步骤进行蒸馏时,应选用_______ (填“直形”“球形”或“蛇形”)冷凝管。
(6)可利用分水器中的现象判断反应已经完成,该现象是_______ 。
(7)本方法中用硫酸镍作催化剂的优点是硫酸镍能重复利用,催化剂重复利用次数与产率的关系如图所示。随着重复次数的增多,产率逐渐下降的原因可能是_______ 。

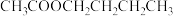 )是无色透明液体,具有强烈香蕉味,沸点为125℃。是重要的有机化工原料,被广泛用于溶剂、涂料和医药等行业。实验室用如下方法制备乙酸正丁酯:
)是无色透明液体,具有强烈香蕉味,沸点为125℃。是重要的有机化工原料,被广泛用于溶剂、涂料和医药等行业。实验室用如下方法制备乙酸正丁酯:
Ⅰ.在50mL的圆底烧瓶中加入10.0mL正丁醇(微溶于水)、8mL冰醋酸和0.5g硫酸镍,混合均匀后加入几粒沸石,连接装置如图所示(夹持和加热装置已略去)。
Ⅱ.反应约1h后停止加热,冷却,过滤分离出催化剂,将烧瓶中的混合物与分水器中的酯层合并,转入分液漏斗中,用10mL饱和碳酸钠溶液洗涤至中性,再依次用饱和氯化钠溶液、饱和氯化钙溶液洗涤,分出酯层。
Ⅲ.将分离出来的酯层倒入干燥锥形瓶中,加入1~2g无水硫酸镁,过滤,将酯层转移到干燥的蒸馏烧瓶中,加入几粒沸石进行蒸馏,收集122~126℃的馏分。
回答下列问题:
(1)仪器A的名称为
(2)写出生成乙酸正丁酯的化学方程式:
(3)用10mL饱和碳酸钠溶液洗涤的目的是
(4)向分液漏斗中加入饱和碳酸钠溶液洗涤时,在摇动后应进行的操作是
(5)步骤Ⅲ加入无水硫酸镁的目的是
(6)可利用分水器中的现象判断反应已经完成,该现象是
(7)本方法中用硫酸镍作催化剂的优点是硫酸镍能重复利用,催化剂重复利用次数与产率的关系如图所示。随着重复次数的增多,产率逐渐下降的原因可能是

您最近一年使用:0次
2022-11-28更新
|
462次组卷
|
3卷引用:安徽省铜陵市等5地2022届高三下学期二模统考化学试题
11-12高二上·江苏无锡·期中
名校
4 . 为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
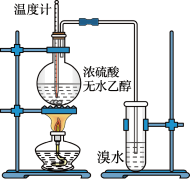
(1)写出甲同学实验中两个反应的化学方程式:_____________ 、___________________________ 。
(2)乙同学观察到的黑色物质是_____________ ,刺激性气体是_____________ 。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________ 。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
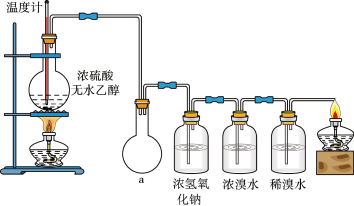
①设计装置a的作用是____________________
②浓溴水的作用是_______________________ ,稀溴水的作用是____________________ 。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:
(2)乙同学观察到的黑色物质是
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是
②浓溴水的作用是
您最近一年使用:0次
2019-04-30更新
|
278次组卷
|
9卷引用:【全国百强校】安徽省铜陵市第一中学2018-2019学年高二下学期期中考试化学试题
【全国百强校】安徽省铜陵市第一中学2018-2019学年高二下学期期中考试化学试题(已下线)2011-2012学年江苏省无锡一中高二上学期期中考试化学试卷(选修)(已下线)2011-2012学年辽宁省开原高中高二下学期期中考试化学试卷(已下线)2011-2012学年河南省新郑一中高二下学期竞赛班期末考试化学试卷2015-2016学年河北省邯郸市鸡泽一中高二下学期期末化学试卷河北省曲阳县一中2018-2019学年高二下学期3月月考化学试题2020届高三化学二轮每周大题必练— ——反应原理的探究型实验三轮冲刺2020届高三化学考题必刷——物质反应原理探究分析题 内蒙古北京八中乌兰察布分校2020-2021学年高二上学期期中(学科素养评估二)考试化学试题
5 . 硫酸亚铁铵是一种重要的化工原料,用途十分广泛。在无机化学工业中,它是制取其它铁化合物的原料,如用于制造氧化铁系颜料、磁性材料、黄血盐和其他铁盐等。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气。某化学小组选用如图所示部分装置进行实验(夹持装置略),验证分解产物中含有氨气和水蒸气。
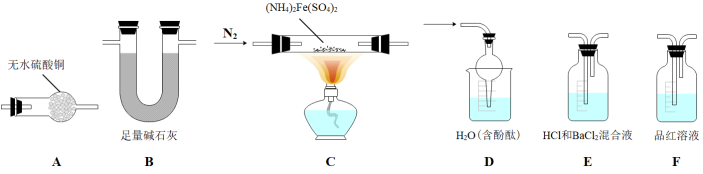
(1)加热之前应该先通氮气,防止空气中的_______ 干扰实验。
(2)所选用装置的正确连接顺序为_______ (填装置序号)。
(3)证明有水蒸气生成的实验现象为_______ 。
(4)证明有氨气生成的实验现象为_______ 。
(5)经检验C 中分解后只有红棕色粉末,用试管取少许与氢碘酸混合后,再加入少量的四氯化碳振荡,下层出现的现象为_______ ,该反应的离子方程式为_______ 。
(6)写出该实验中硫酸亚铁铵受热分解的化学方程式_______ 。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气。某化学小组选用如图所示部分装置进行实验(夹持装置略),验证分解产物中含有氨气和水蒸气。

(1)加热之前应该先通氮气,防止空气中的
(2)所选用装置的正确连接顺序为
(3)证明有水蒸气生成的实验现象为
(4)证明有氨气生成的实验现象为
(5)经检验C 中分解后只有红棕色粉末,用试管取少许与氢碘酸混合后,再加入少量的四氯化碳振荡,下层出现的现象为
(6)写出该实验中硫酸亚铁铵受热分解的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 某同学做了如下实验:
下列说法中正确的是
| 装置 | 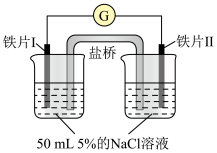 | 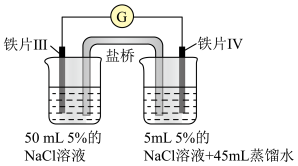 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法中正确的是
| A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转 |
| B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 |
| C.铁片Ⅰ、Ⅲ的腐蚀速率相等 |
| D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 |
您最近一年使用:0次
2019-03-08更新
|
1021次组卷
|
6卷引用:安徽省枞阳县浮山中学2019-2020学年高二上学期期中考试化学试题
7 . 以新型甲醇碱性燃料电池为电源,电解NaOH稀溶液和饱和食盐水可制备氯气和烧碱,设计装置如图所示。下列说法正确的是
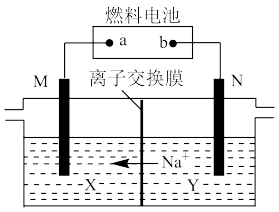

A.a电极的反应式为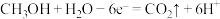 |
| B.X区为NaOH稀溶液,Y区为饱和食盐水 |
C.N极生成1mol气体时,有 通过离子交换膜 通过离子交换膜 |
D.M极生成22.4L气体时,理论上导线中流过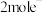 |
您最近一年使用:0次
2022-11-28更新
|
500次组卷
|
3卷引用:安徽省铜陵市等5地2022届高三下学期二模统考化学试题
11-12高一下·安徽宿州·期中
名校
8 . 实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题。
(1)实验装置:
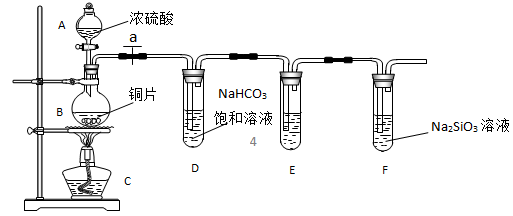
填写所示仪器名称 A_________ B________________________
(2)实验步骤:
连接仪器、_____________ 、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________ ;装置E中足量酸性KMnO4溶液的作用是_____________________________ ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是____________________________ ;
③依据试管 D 中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___ (填 “能”或“否”),试管 D 中发生反应的离子方程式是______________________
(1)实验装置:

填写所示仪器名称 A
(2)实验步骤:
连接仪器、
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是
③依据试管 D 中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
您最近一年使用:0次
2017-08-25更新
|
557次组卷
|
7卷引用:安徽省铜陵市第一中学2017-2018学年高一下学期期中考试化学试题
安徽省铜陵市第一中学2017-2018学年高一下学期期中考试化学试题(已下线)2011-2012年安徽省宿州13所重点中学高一下学期期中质检化学试卷(已下线)2011-2012学年山东省济宁市梁山一中高一下学期期中考试化学试卷 (已下线)2012-2013学年江西省白鹭洲中学高一下学期期中考试化学试卷(已下线)2013-2014湖北省黄石市三中高一下学期期中考试化学试卷江西省赣中南五校2018届高三上学期第二次联考理综化学试题江西省吉安市吉水县第二中学2019-2020高一下学期期中考试化学试题
9 . 某化学课外小组用如下图所示的装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式____________ 。
(2)反应时观察到A中反应液微沸并充满红棕色的蒸气,产生该现象的原因是____________ 。
(3) 除去溶于溴苯中的液溴,实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,写出有关反应的化学方程式____________ 。
(4)C中盛放CCl4的作用是____________ 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入_________ ,出现____________ 现象则能证明。

(1)写出A中反应的化学方程式
(2)反应时观察到A中反应液微沸并充满红棕色的蒸气,产生该现象的原因是
(3) 除去溶于溴苯中的液溴,实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,写出有关反应的化学方程式
(4)C中盛放CCl4的作用是
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入
您最近一年使用:0次
10 . 下列操作正确的是
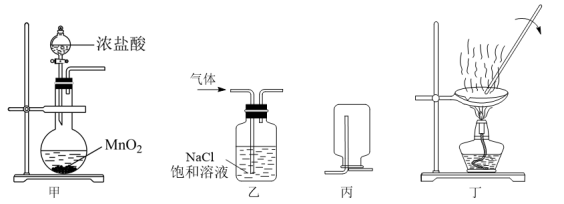

| A.甲装置可以用于制备氯气 |
| B.乙装置可以用于洗去氯气中混有的氯化氢 |
| C.丙可以用于收集CO |
| D.丁装置用于实验室焙烧硫酸铜晶体制备硫酸铜 |
您最近一年使用:0次
2021-12-19更新
|
241次组卷
|
2卷引用:安徽省铜陵市第一中学、安徽师范大学附属中学2021-2022学年高三上学期12月联考理综化学试题



