解题方法
1 . 亚硝酰氯(NOCl)常用作催化剂和合成洗涤剂,其熔点:-64.5℃,沸点:-5.5℃,是一种黄色气体,液体状态呈红褐色,遇水易水解。对眼睛、皮肤和黏膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。某学习小组在实验室中用下图所示装置制备NOCl。已知:HNO2既有氧化性又有还原性;AgNO2微于水,能溶于硝酸,AgNO2+HNO3=AgNO3+HNO2。

回答下列问题:
(1)仪器a的名称为________ ,装置B的作用是________ 。
(2)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞加入适量稀硝酸,当观察到C中________ 时关闭K1、K2。向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3。
(3)实验过程中,若学习小组同学用酒精灯大火加热制取NO,对本实验造成的不利影响是_________________________ (写出两条)
(4)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸)时会生成亚硝酰氯和氯气,该反应的化学方程式为___________________________ 。
(5)已知在0~10℃下,NOC1与水反应生成HNO2和HCl。设计实验证明NOCl与水的反应产物中含有HNO2___________________________ 。
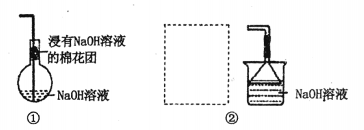
(6)甲同学设计了如图①所示的装置进行尾气处理。烧瓶底部的氢氧化钠溶液吸收氯气和NOCl不能被吸收的NO,与烧瓶内的氧气反应后生成的NO、NO2混合气体被烧瓶瓶颈处的NaOH溶液吸收,达到处理尾气的目的。但乙同学认为烧瓶内空气有限,仍可能造成污染气体逸出。为解决这一问题,乙同学设计了新的方案②,请在虚线方框内补充完整________ 。

回答下列问题:
(1)仪器a的名称为
(2)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞加入适量稀硝酸,当观察到C中
(3)实验过程中,若学习小组同学用酒精灯大火加热制取NO,对本实验造成的不利影响是
(4)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸)时会生成亚硝酰氯和氯气,该反应的化学方程式为
(5)已知在0~10℃下,NOC1与水反应生成HNO2和HCl。设计实验证明NOCl与水的反应产物中含有HNO2
(6)甲同学设计了如图①所示的装置进行尾气处理。烧瓶底部的氢氧化钠溶液吸收氯气和NOCl不能被吸收的NO,与烧瓶内的氧气反应后生成的NO、NO2混合气体被烧瓶瓶颈处的NaOH溶液吸收,达到处理尾气的目的。但乙同学认为烧瓶内空气有限,仍可能造成污染气体逸出。为解决这一问题,乙同学设计了新的方案②,请在虚线方框内补充完整

您最近一年使用:0次
2 . 在研究物质的性质时,可以从物质类别、物质所含核心元素的化合价这两个基本角度预测物质可能具有的性质,并通过实验进行验证。
(1)已知某铝土矿的主要成分由Al2O3、SiO2、Fe2O3,组成。从物质类别的角度判断,SiO2属于_______ 氧化物(填“酸性”、“碱性”或“两性”)。从铝土矿中分离Al2O3的过程如图所示,则试剂甲、乙、丙分别是_______ (填字母)。
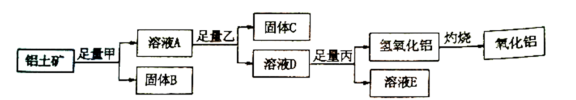
a.烧碱、盐酸、二氧化碳 b.烧碱、盐酸、氨水
c.盐酸、烧碱、氨水 d.盐酸、烧碱、二氧化碳
(2)某化学研究小组根据H2O2中氧元素的化合价,预测H2O2性质,并设计如图实验进行验证。
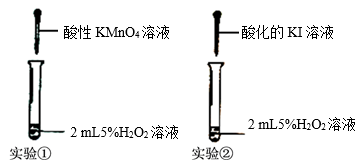
I.实验①证明酸性KMnO4溶液与H2O2反应的现象除了溶液颜色变浅或褪色外,还有_______ 。
II.实验②在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式:_______ 。以上实验可得出H2O2具有的性质是_______ 。
(3)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了试剂FeCl3和Na2S进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
可能发生的两种不同原理的反应的离子方程式是_______ 、_______ 。
(1)已知某铝土矿的主要成分由Al2O3、SiO2、Fe2O3,组成。从物质类别的角度判断,SiO2属于

a.烧碱、盐酸、二氧化碳 b.烧碱、盐酸、氨水
c.盐酸、烧碱、氨水 d.盐酸、烧碱、二氧化碳
(2)某化学研究小组根据H2O2中氧元素的化合价,预测H2O2性质,并设计如图实验进行验证。

I.实验①证明酸性KMnO4溶液与H2O2反应的现象除了溶液颜色变浅或褪色外,还有
II.实验②在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式:
(3)某同学猜测Fe3+可以与S2-发生反应,为验证其猜测,他结合资料信息,选择了试剂FeCl3和Na2S进行实验,确认了Fe3+与S2-能发生反应。
资料:部分硫化物的溶解性表(室温)
| 化学式 | 溶解性 |
| Na2S | 可溶 |
| Fe2S3 | 不溶,在热水或酸中分解 |
| FeS | 不溶 |
您最近一年使用:0次
解题方法
3 . 氯气是一种重要的化工产品和基础原料,实验室制备氯气装置如下,请回答:

(1)装置A中的化学方程式为_______ 。在该反应中浓盐酸表现的性质是_______ (填字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)装置B的作用是_______ 。
(3)氯气能将 氧化为I2,因氯气有毒常用H2O2替代,H2O2氧化
氧化为I2,因氯气有毒常用H2O2替代,H2O2氧化 的离子方程式是
的离子方程式是_______ 。
(4)有同学认为H2O2既有氧化性又有还原性,理论依据是_______ (从氧元素价态回答),选择合适的试剂设计实验,可以验证H2O2的还原性,提供试剂:0.1mol/LKMnO4(H+)溶液、0.1mol/LKI溶液、淀粉溶液、10% H2O2溶液、0.1mol/LFeCl3溶液。请写出H2O2只做还原剂的离子方程式_______ ,该反应中能够证明H2O2被氧化的实验现象是_______ 。

(1)装置A中的化学方程式为
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)装置B的作用是
(3)氯气能将
 氧化为I2,因氯气有毒常用H2O2替代,H2O2氧化
氧化为I2,因氯气有毒常用H2O2替代,H2O2氧化 的离子方程式是
的离子方程式是(4)有同学认为H2O2既有氧化性又有还原性,理论依据是
您最近一年使用:0次
解题方法
4 . 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:
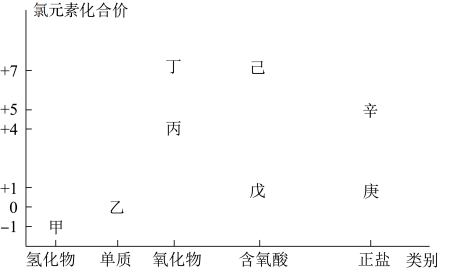
(1)丁属于___________ (“酸性”或“碱性”)氧化物;
(2)图中甲、乙、丙、戊中,属于电解质的是___________ (填化学式);根据氯元素的化合价判断,乙物质___________ ;
A. 只有氧化性 B. 只有还原性 C. 既有氧化性又有还原性
(3)电解甲溶液制备己的化学反应为: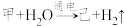 (未配平),则配平后参与反应的甲与H2O的物质的量之比是
(未配平),则配平后参与反应的甲与H2O的物质的量之比是___________ ;
(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为___________ ;
(5)已知己是最强的无机酸,写出己的电离方程式___________ 。

(1)丁属于
(2)图中甲、乙、丙、戊中,属于电解质的是
A. 只有氧化性 B. 只有还原性 C. 既有氧化性又有还原性
(3)电解甲溶液制备己的化学反应为:
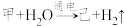 (未配平),则配平后参与反应的甲与H2O的物质的量之比是
(未配平),则配平后参与反应的甲与H2O的物质的量之比是(4)庚是漂白粉的有效成分,用乙制取庚的化学方程式为
(5)已知己是最强的无机酸,写出己的电离方程式
您最近一年使用:0次
2021-11-17更新
|
1158次组卷
|
4卷引用:河南省洛阳市第二中学2022-2023学年高一上学期期末达标考试化学试题
13-14高一上·北京门头沟·期末
解题方法
5 . 回答下列关于铁元素及其化合物的知识:
(1) 向一支装有FeCl3溶液的试管中滴加NaOH溶液,现象为_____________ ,其中含铁元素的产物的化学式是________ ;
(2) 为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明. 方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理_______________ ;
②写出Fe2+与氯气反应的离子方程式_______________________ ;
③实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,其目的是__________
(3) 鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被________ ;若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有________ 。
A. 氧化性 B. 还原性 C. 酸性 D. 碱性.
(1) 向一支装有FeCl3溶液的试管中滴加NaOH溶液,现象为
(2) 为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明. 方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理
②写出Fe2+与氯气反应的离子方程式
③实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,其目的是
(3) 鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被
A. 氧化性 B. 还原性 C. 酸性 D. 碱性.
您最近一年使用:0次
名校
6 . 铁元素的“价—类”二维图如图所示:
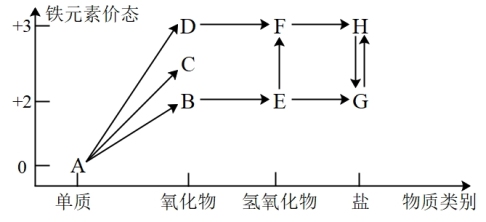
(1)C的化学式是_______ , 反应的化学方程式是
反应的化学方程式是_______ ,反应过程的现象为_______ 。
(2)维生素C可将H转化为G,维生素C具有_______ (填“酸性”、“氧化性”或“还原性”)。
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是_______ 。
A. B.
B. C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的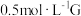 溶液,
溶液, 溶液
溶液
①上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是_______ 。
②产生气泡的原因是_______ 。

(1)C的化学式是
 反应的化学方程式是
反应的化学方程式是(2)维生素C可将H转化为G,维生素C具有
(3)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
 B.
B. C.
C.
(4)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
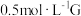 溶液,
溶液, 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入5滴 酸化的G溶液于试管中,加入5滴 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是②产生气泡的原因是
您最近一年使用:0次
2022-01-23更新
|
805次组卷
|
8卷引用:河南省宜阳县第一高级中学2022-2023学年高一上学期期末考试化学试题
7 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
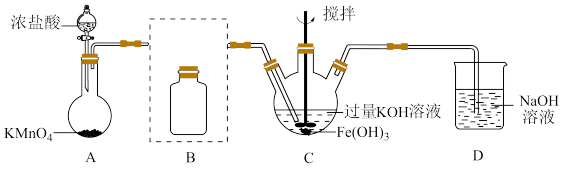
①A为氯气发生装置。A中反应方程式是________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有________________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________________ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
2018-06-09更新
|
9685次组卷
|
31卷引用:河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题
河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源18 化学实验设计与探究(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019年高考总复习巅峰冲刺-专题03 氧化还原反应 离子反应应试策略(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市耀华中学2023届高三第一次统练化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题第三章 金属及其化合物 第14讲 铁及其化合物的转化关系(已下线)第一部分 化学综合实验 热点6 物质性质探究实验北京一零一中学2023-2024学年高一上学期11月统练三化学试卷河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题
名校
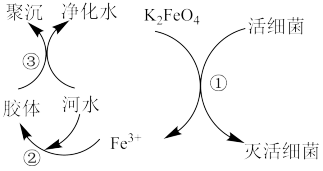
8 . 高铁酸钾( ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 价。
(2)过程①中活性菌表现了_______ (填“氧化”或“还原”)性,该过程的还原产物是_______ (填离子符号);过程③属于_______ (填“物理”或“化学”)变化。
(3)根据上述原理分析,作水处理剂时, 的作用有
的作用有_______ (填两个)。
(4)制备高铁酸钾常用的反应原理为 (反应未配平)。
(反应未配平)。
①该反应中,Cl元素的化合价由_______ 价变为_______ 价;通过该反应说明:在碱性条件下,氧化性
_______ (填“>”、“=”或“<”) 。
。
②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:_______ ,将该反应改写为离子方程式:_______ 。
 ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)过程①中活性菌表现了
(3)根据上述原理分析,作水处理剂时,
 的作用有
的作用有(4)制备高铁酸钾常用的反应原理为
 (反应未配平)。
(反应未配平)。①该反应中,Cl元素的化合价由

 。
。②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:
您最近一年使用:0次
2022-11-03更新
|
270次组卷
|
3卷引用:河南省宜阳县第一高级中学2022-2023学年高一上学期期中考试化学试题
9 . 烃类物质是整个有机化学的基础,烃及其衍生物共同构成了庞大的有机物世界。
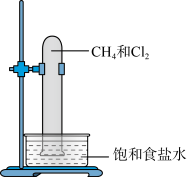
(1)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。_______ 。_______ (填化学式)。
③甲烷与氯气反应生成的产物最多的是_______ (填化学式)。
④若将1mol 与一定量的
与一定量的 反应,得到等物质的量的4种有机产物,则消耗
反应,得到等物质的量的4种有机产物,则消耗 的物质的量为
的物质的量为_______ mol。
(2)异丁烷的结构简式_______ 。
(3)分子式为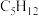 的同分异构体有
的同分异构体有_______ 种,其中一氯代物只有一种的烃的结构简式是_______ 。
(4)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。乙醇的官能团名称是_______ 。使用酸性 溶液可以检测酒驾,利用了乙醇的
溶液可以检测酒驾,利用了乙醇的_______ (填“氧化性”或“还原性”)。
(5)乙烷与 在光照条件下发生取代反应可以生成氯乙烷
在光照条件下发生取代反应可以生成氯乙烷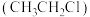 ,该反应的机理为自由基反应(自由基:带有单电子的原子或原子团,如
,该反应的机理为自由基反应(自由基:带有单电子的原子或原子团,如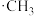 、
、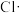 ),
), 的形成过程可简化表示如下:
的形成过程可简化表示如下:
链引发:
链增长:
链终止: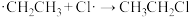

但在该反应过程中还会有1,1-二氯乙烷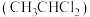 生成,将生成该物质的反应机理补充完整:
生成,将生成该物质的反应机理补充完整:
链引发: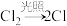
链增长:_______ ;
链终止:_______ ;
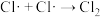
(1)实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
A. B.
B. C.
C. D.
D.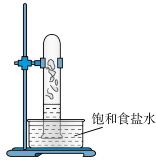
③甲烷与氯气反应生成的产物最多的是
④若将1mol
 与一定量的
与一定量的 反应,得到等物质的量的4种有机产物,则消耗
反应,得到等物质的量的4种有机产物,则消耗 的物质的量为
的物质的量为(2)异丁烷的结构简式
(3)分子式为
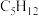 的同分异构体有
的同分异构体有(4)我国已对酒驾实行了“醉驾入刑”,酒的主要成分是乙醇。乙醇的官能团名称是
 溶液可以检测酒驾,利用了乙醇的
溶液可以检测酒驾,利用了乙醇的(5)乙烷与
 在光照条件下发生取代反应可以生成氯乙烷
在光照条件下发生取代反应可以生成氯乙烷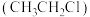 ,该反应的机理为自由基反应(自由基:带有单电子的原子或原子团,如
,该反应的机理为自由基反应(自由基:带有单电子的原子或原子团,如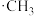 、
、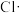 ),
), 的形成过程可简化表示如下:
的形成过程可简化表示如下:链引发:

链增长:

链终止:
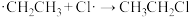

但在该反应过程中还会有1,1-二氯乙烷
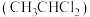 生成,将生成该物质的反应机理补充完整:
生成,将生成该物质的反应机理补充完整:链引发:
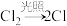
链增长:
链终止:
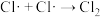
您最近一年使用:0次
名校
10 . 对于一定条件下的氧化还原反应:2Fe3++2I- 2Fe2++I2,下列说法
2Fe2++I2,下列说法不正确 的是
 2Fe2++I2,下列说法
2Fe2++I2,下列说法| A.该反应达到平衡后,改变溶液的酸碱性不会影响平衡状态 |
| B.该反应达到平衡后,加入CCl4充分振荡可使平衡向右移动 |
| C.该反应达到平衡后,体系中Fe3+和I2的氧化性强弱相当 |
| D.将该反应设计成原电池,当电流计示数刚好变为“0”时,达到该反应进行的限度 |
您最近一年使用:0次
2020-09-09更新
|
183次组卷
|
5卷引用:河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题
河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题北京市2021届高三上学期入学定位考试化学试题北京市第四十三中学2021届高三上学期12月月考化学试题重庆南开中学2021-2022学年(2022届)高三上学期7月考试化学试题(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)



