名校
解题方法
1 . 下列叙述正确的是
| A.反应物总能量高于生成物总能量,该反应一定能自发进行 |
| B.若将1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ |
C.若C(石墨,s) C(金刚石,s) C(金刚石,s)  H>0,则金刚石比石墨稳定 H>0,则金刚石比石墨稳定 |
D.已知C(s)+O2(g) = CO2(g)  H1;C(s)+ H1;C(s)+ O2(g)=CO(g) O2(g)=CO(g)  H2,则 H2,则 H1> H1> H2 H2 |
您最近一年使用:0次
7日内更新
|
53次组卷
|
2卷引用:广东省东莞市常平中学2023-2024学年高二下学期期中考试化学试卷
名校
解题方法
2 . 某化学学习小组探究浓度对硝酸氧化能力的影响。
Ⅰ.资料显示:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO;氢氧化钠能吸收NO2,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。
(1)装置a的名称_______ 。
(2)写出装置①中反应的离子反应方程式_______ 。
(3)①~⑥装置中,没有发生氧化还原反应的是_______ 。(填装置序号)
(4)下列说法正确的是_______。
Ⅱ.测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:
(5)下列说法正确的是_______ 。
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于12.2mol/LHNO3溶液反应说明不存在“钝化”现象。
(6)已知:在上述反应条件下,反应后铁以Fe3+形式存在于溶液中。当硝酸浓度为9.75mol·L-1时,计算氧化剂与还原剂的物质的量之比为:_______ 。
Ⅰ.资料显示:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO;氢氧化钠能吸收NO2,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。
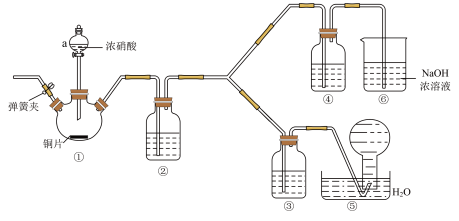
(1)装置a的名称
(2)写出装置①中反应的离子反应方程式
(3)①~⑥装置中,没有发生氧化还原反应的是
(4)下列说法正确的是_______。
| A.能证明氧化性的相对强弱的实验现象为③中溶液上方出现红棕色气体 |
| B.②中的试剂为水 |
| C.滴加浓硝酸前要先打开弹簧夹通一段时间氮气 |
| D.⑥的作用是吸收尾气NO |
Ⅱ.测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:
(5)下列说法正确的是
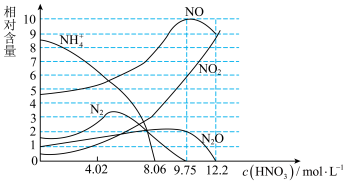
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于12.2mol/LHNO3溶液反应说明不存在“钝化”现象。
(6)已知:在上述反应条件下,反应后铁以Fe3+形式存在于溶液中。当硝酸浓度为9.75mol·L-1时,计算氧化剂与还原剂的物质的量之比为:
您最近一年使用:0次
3 . 高分子化合物H是一种重要工业原料,其单体A不易溶于水,可以发生如图变化。请回答下列问题:_______ 。
(2)有机物A中官能团的名称为_______ 、_______ 。
(3)反应①的反应类型为_______ ;反应⑤的反应类型为_______ 。
(4)反应②的化学方程式是_______ 。
(5)写出高分子化合物H的结构简式:_______ 。
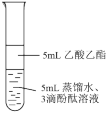
(6)产物的探究:④反应在如图中发生,取下试管乙振荡,红色褪去。为了探究褪色原因,进行如下实验。
①用化学方程式解释实验Ⅰ中产生气泡的原因是_______ 。
②测得实验Ⅰ褪色后的下层溶液呈碱性,对比实验Ⅰ和实验Ⅱ,
小组得出该实验中乙酸与碳酸钠反应_______ (填“是”或“不是”)溶液褪色的主要原因。
③针对实验Ⅱ中现象,小组同学提出猜想:酚酞更易溶于乙酸乙酯。
实验Ⅲ中观察到_______ ,证实该猜想正确。

(2)有机物A中官能团的名称为
(3)反应①的反应类型为
(4)反应②的化学方程式是
(5)写出高分子化合物H的结构简式:
(6)产物的探究:④反应在如图中发生,取下试管乙振荡,红色褪去。为了探究褪色原因,进行如下实验。

编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
操作 | 充分振荡、静置 | 充分振荡、静置 | 充分振荡、静置、分液。取下层溶液,加入饱和Na2CO3溶液 |
现象 | 上层液体变薄,冒气泡,下层溶液红色褪去 | 上层液体不变薄,无气泡,下层溶液红色褪去 | —— |
②测得实验Ⅰ褪色后的下层溶液呈碱性,对比实验Ⅰ和实验Ⅱ,
小组得出该实验中乙酸与碳酸钠反应
③针对实验Ⅱ中现象,小组同学提出猜想:酚酞更易溶于乙酸乙酯。
实验Ⅲ中观察到
您最近一年使用:0次
4 . 回答下列问题:
(1)根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中_______ (填“吸收”或“放出”)的能量为_______ kJ。 ,n(NO)随时间变化如下表:
,n(NO)随时间变化如下表:
①0~2s内,用O2表示该反应的反应速率为_______ mol·L-1·s-1。
②下列措施能够使该反应的反应速率加快的是_______ (填字母)。
a.降低温度 b.使用合适的催化剂 c.减小容器容积
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的N2O5。_______ (填“石墨Ⅰ”或“石墨Ⅱ”)。
②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2为_______ L。
在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图甲所示),该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示,请分析并回答如下问题:_______ (填化学式)。
(5)0~t1时间段的温度为_______ 。
(1)根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中

 ,n(NO)随时间变化如下表:
,n(NO)随时间变化如下表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
②下列措施能够使该反应的反应速率加快的是
a.降低温度 b.使用合适的催化剂 c.减小容器容积
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的N2O5。

②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2为
在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图甲所示),该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示,请分析并回答如下问题:
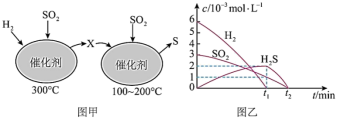
(5)0~t1时间段的温度为
您最近一年使用:0次
名校
5 . 下列生产或实验事实引出的相应结论正确的是
| 选项 | 事实 | 结论 |
| A | 在容积可变的密闭容器中发生反应:2NH3(g) N2H4 (g)+H2 (g),把容器体积缩小一半 N2H4 (g)+H2 (g),把容器体积缩小一半 | 正反应速率加快,逆反应速率也加快 |
| B | 将少量Na2S2O3样品溶于水,滴入过量的稀硝酸后,再滴入BaCl2溶液,有白色沉淀产生 | 说明Na2S2O3已变质 |
| C | 向盛有某溶液的试管中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 与氨溶液中无铵根离子 |
| D | 向鸡蛋清溶液中滴加饱和硫酸铵溶液,振荡,有固体析出 | 硫酸铵溶液能使蛋白质变性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数一定为3NA |
| B.标准状况下,11.2L己烷所含的分子数为0.5NA |
| C.含2mol H2SO4的浓硫酸与足量的铜在加热条件下反应,生成SO2的体积在标准状况下为22.4L |
| D.3mol NO2溶于水,转移的电子数为NA |
您最近一年使用:0次
名校
解题方法
7 . I.化学反应常伴随热效应,某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测定,用公式Q= cρV总· T计算获得,用如图所示装置进行中和热的测定实验。
T计算获得,用如图所示装置进行中和热的测定实验。___________ ,碎泡沫塑料的作用是___________ 。
(2)取浓度分别为0.5000mol·L-1的NaOH溶液和0.5500mol·L-1的盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为___________ J(c和ρ分别取4.18J·g-1·℃-1和1.0g·mL-1,忽略水以外各物质吸收的热量)。
Ⅱ.已知: (
( )遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯
)遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯 的纯度。
的纯度。
(3)滴定前,滴定管的正确操作是:检漏→蒸馏水洗涤→___________ →开始滴定。
A.装入滴定液至零刻度以上
B.调整滴定液液面至零刻度或零刻度以下
C.排除气泡
D.用滴定液润洗2至3次
E.记录起始读数
(4)取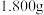 产品,加入到
产品,加入到

 溶液中加热充分水解,冷却后加蒸馏水稀释至
溶液中加热充分水解,冷却后加蒸馏水稀释至 ,取
,取 溶液于锥形瓶中,滴加2滴甲基橙,用
溶液于锥形瓶中,滴加2滴甲基橙,用 盐酸标准溶液滴定至终点,重复实验,结果记录如下:
盐酸标准溶液滴定至终点,重复实验,结果记录如下:
达到滴定终点的现象是___________ ,产品的纯度为___________ 。
(5)下列操作会导致SO2Cl2纯度测定结果偏低的是___________。
 T计算获得,用如图所示装置进行中和热的测定实验。
T计算获得,用如图所示装置进行中和热的测定实验。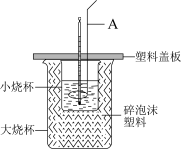
(2)取浓度分别为0.5000mol·L-1的NaOH溶液和0.5500mol·L-1的盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为
Ⅱ.已知:
 (
( )遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯
)遇水极易水解生成HCl和H2SO4;可利用中和滴定法确定制备的磺酰氯 的纯度。
的纯度。(3)滴定前,滴定管的正确操作是:检漏→蒸馏水洗涤→
A.装入滴定液至零刻度以上
B.调整滴定液液面至零刻度或零刻度以下
C.排除气泡
D.用滴定液润洗2至3次
E.记录起始读数
(4)取
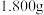 产品,加入到
产品,加入到

 溶液中加热充分水解,冷却后加蒸馏水稀释至
溶液中加热充分水解,冷却后加蒸馏水稀释至 ,取
,取 溶液于锥形瓶中,滴加2滴甲基橙,用
溶液于锥形瓶中,滴加2滴甲基橙,用 盐酸标准溶液滴定至终点,重复实验,结果记录如下:
盐酸标准溶液滴定至终点,重复实验,结果记录如下:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗盐酸标准溶液体积/mL | 10.02 | 9.98 | 11.12 |
(5)下列操作会导致SO2Cl2纯度测定结果偏低的是___________。
| A.滴定前读数正确,滴定后俯视读数 |
| B.滴定时不慎将盐酸标准溶液滴到锥形瓶外 |
| C.滴定前无气泡,滴定达终点时发现滴定管尖嘴内有气泡出现 |
| D.装盐酸标准溶液的滴定管用蒸馏水洗后没有润洗 |
您最近一年使用:0次
名校
解题方法
8 . 当前,我国公布了实现“碳达峰、碳中和”目标的具体时间。因此,含碳化合物的综合利用,有效缓解温室效应成为研究热点。回答下列问题:
(1)CO2可与 H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1=-49 kJ·mol-1
H1=-49 kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2=+41 kJ·mol-1
H2=+41 kJ·mol-1
则:Ⅲ.CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)  H=
H=___________ 。
若将物质的量之比为1:2的 CO 和 H2 充入恒温恒容密闭容器中进行反应Ⅲ,下列事实能说明此反应已达到平衡状态的是___________ 。
A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.V(CO)和 v(H2) 的速率之比为 1:2
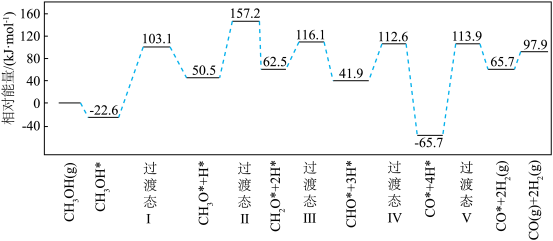
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea=___________ kJ·mol-1,写出该步骤的化学方程式:___________ 。 和
和 充入
充入 恒容密闭容器中进行反应Ⅲ,反应相同时间
恒容密闭容器中进行反应Ⅲ,反应相同时间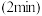 时测得不同温度下
时测得不同温度下 的转化率如图所示:
的转化率如图所示:___________ 。
A.升高温度 B.充入Ar使压强增大 C.充入CO使压强增大 D.选择高效催化剂
②温度在 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率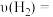
___________ 。
③由图可知,在温度低于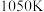 时,CO的转化率随温度的升高而增大,原因是
时,CO的转化率随温度的升高而增大,原因是___________ 。
④已知c点时容器内气体的压强为p,则在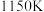 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为___________ 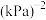 (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
(1)CO2可与 H2制甲醇:在催化剂作用下,发生以下反应:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1=-49 kJ·mol-1
H1=-49 kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2=+41 kJ·mol-1
H2=+41 kJ·mol-1则:Ⅲ.CO(g) + 2H2(g)
 CH3OH(g)
CH3OH(g)  H=
H=若将物质的量之比为1:2的 CO 和 H2 充入恒温恒容密闭容器中进行反应Ⅲ,下列事实能说明此反应已达到平衡状态的是
A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.V(CO)和 v(H2) 的速率之比为 1:2
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea=
 和
和 充入
充入 恒容密闭容器中进行反应Ⅲ,反应相同时间
恒容密闭容器中进行反应Ⅲ,反应相同时间 时测得不同温度下
时测得不同温度下 的转化率如图所示:
的转化率如图所示: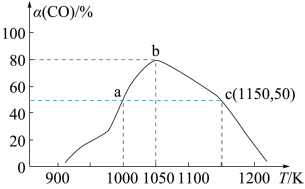
A.升高温度 B.充入Ar使压强增大 C.充入CO使压强增大 D.选择高效催化剂
②温度在
 下,从反应开始至
下,从反应开始至 末,这段时间内的反应速率
末,这段时间内的反应速率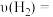
③由图可知,在温度低于
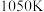 时,CO的转化率随温度的升高而增大,原因是
时,CO的转化率随温度的升高而增大,原因是④已知c点时容器内气体的压强为p,则在
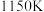 下该反应的压强平衡常数
下该反应的压强平衡常数 为
为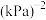 (用含p的代数式表示,
(用含p的代数式表示, 是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
是用各气体的分压替代浓度来计算的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
9 . 下列相关事实能用勒夏特列解释的是
| A.大部分盐类水解符合“越稀越水解”的规律 |
| B.加入MnO2能加快H2O2分解放出O2 |
C.合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,工业上采用高温条件更有利于合成氨 2NH3(g) ΔH=-92.4kJ/mol,工业上采用高温条件更有利于合成氨 |
D.硫酸工业中的重要反应2SO2+O2 2SO3,工业上常加入V2O5做催化剂 2SO3,工业上常加入V2O5做催化剂 |
您最近一年使用:0次
名校
解题方法
10 . 已知:25℃时,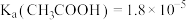 。
。
(1)常温下,将pH和体积均相同的 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:___________ 溶液(填“ ”或“
”或“ ”)。
”)。
②a、b两点对应的溶液中,水的电离程度a___________ b(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③酸度( )也可表示溶液的酸碱性,
)也可表示溶液的酸碱性,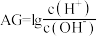 。常温下,
。常温下, 的硝酸溶液
的硝酸溶液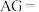
___________ 。
(2)常温下,向某浓度的二元弱酸草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:___________ 。
②如果所得溶液溶质为KHC2O4,则该溶液显___________ (填“酸性”、“碱性”或“中性”);原因是___________ (结合数据计算说明)。
③当所得溶液pH=2.7时,溶液中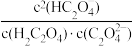 =
=___________ 。
④等浓度等体积的KHC2O4、K2C2O4混合,溶液中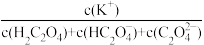 =
=___________ 。
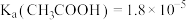 。
。(1)常温下,将pH和体积均相同的
 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:
 ”或“
”或“ ”)。
”)。②a、b两点对应的溶液中,水的电离程度a
 ”、“
”、“ ”或“
”或“ ”)。
”)。③酸度(
 )也可表示溶液的酸碱性,
)也可表示溶液的酸碱性,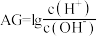 。常温下,
。常温下, 的硝酸溶液
的硝酸溶液
(2)常温下,向某浓度的二元弱酸草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O
 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题: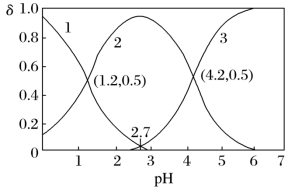
②如果所得溶液溶质为KHC2O4,则该溶液显
③当所得溶液pH=2.7时,溶液中
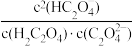 =
=④等浓度等体积的KHC2O4、K2C2O4混合,溶液中
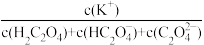 =
=
您最近一年使用:0次