名校
解题方法
1 . 下列生活中的物质与其有效成分的化学式、用途的对应关系中,正确的是
| 选项 | A | B | C | D |
| 生活中的物质 | 苏打 | 84消毒液 | 小苏打 | 漂白粉 |
| 有效成分化学式 | Na2CO3 | NaClO | NaHCO3 | NaClO |
| 用途 | 做抗酸药 | 做食品漂白剂 | 做发酵粉 | 做消毒剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-03更新
|
130次组卷
|
2卷引用:新疆维吾尔自治区伊犁哈萨克自治州新源县2021-2022学年高一上学期期中联考化学试题
2 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的氧化物有_____ (填化学式)。
(2)将X与Y混合,可生成黄色固体,该反应中氧化剂与还原剂的物质的量之比为_____ 。
(3)Z的浓溶液与铜单质在加热条件下可以发生化学反应,该反应的化学方程式为_____ ,该反应中每转移2mol电子,生成气体的体积为_____ (标准状况下)。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的氧化物有
(2)将X与Y混合,可生成黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在加热条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
您最近一年使用:0次
3 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ (填“氧化”或“还原”,下同)。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________ 性。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。
①配平上述氧化还原反应方程式___________ 。
②该反应中,氧化剂是___________ (填化学式),被氧化的元素是___________ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为:
的反应为: 。
。
①该反应中的还原产物是___________ (写化学式),反应中每生成1mol 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为___________ ,转移电子的数目为___________ 。
②用“单线桥”标出反应中电子转移的方向与数目___________ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是___________ (填字母)。
a. b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为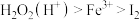 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为___________ 。
(1)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。①配平上述氧化还原反应方程式
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为:
的反应为: 。
。①该反应中的还原产物是
 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为②用“单线桥”标出反应中电子转移的方向与数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是a.
 b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为
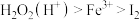 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近一年使用:0次
名校
4 . A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):

(1)若A是一种金属C是淡黄色固体,则B的化学式为______ ;A→C反应的化学方程式为______ ;写出C的一种用途______ (用化学方程式表示)。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为______ ,电子式为______ 。B→C反应的化学方程式为______ 。A和C是否能反应?______ (填“能”或“不能”),若能,写出反应的化学方程式:______ (若不能,此空不填)。

(1)若A是一种金属C是淡黄色固体,则B的化学式为
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为
您最近一年使用:0次
2022-12-14更新
|
157次组卷
|
2卷引用:新疆伊宁市第八中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
5 . 下列物质的用途不正确的是
| A.硅是制造太阳能电池的常用材料 |
| B.黏土和石灰石是制取水泥的原料 |
| C.水玻璃可用作木材防火剂 |
| D.硅是制造光导纤维的材料 |
您最近一年使用:0次
2022-03-27更新
|
513次组卷
|
3卷引用:新疆霍城县第二中学2021-2022学年高一下学期期中考试化学试题
11-12高一上·广东汕头·期中
名校
6 . 氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是
| A.金属冶炼 | B.燃放鞭炮 | C.食物腐败 | D.点制豆腐 |
您最近一年使用:0次
2021-09-27更新
|
840次组卷
|
18卷引用:新疆伊犁州新源县2021-2022学年高二下学期期末考试化学试题
新疆伊犁州新源县2021-2022学年高二下学期期末考试化学试题(已下线)2011-2012年广东省汕头市金山中学高一上学期期中考试化学试卷(已下线)2011-2012学年安徽省合肥一中高一上学期期中考试化学试卷2015-2016学年山东省文登一中高一上学期第二次诊断性测试化学试卷2015-2016学年广西桂林中学高二上期中考试文化学试卷山西省太原市第五中学2017-2018学年高一12月月考化学试题【全国百强校】浙江省萧山中学2018-2019学年高一下学期2月份摸底考试化学试题辽宁省朝阳市柳城高中2019-2020学年高一上学期期中考试化学试题福建省泉州第五中学高中化学必修1【专题练习】氧化还原反应(已下线)【新东方】 2020-33人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 教材帮吉林省长春市第一五一中学2020-2021学年高一上学期期中考试化学试题吉林省吉林市第五十五中学2021-2022学年高一上学期九月月考化学试卷重庆市涪陵高级中学校2021-2022学年高三上学期第一次月考化学试题(已下线)衔接点11 氧化还原反应概念-2022年初升高化学无忧衔接?甘肃省民勤县第一中学2022-2023学年高一上学期开学考试化学试题黑龙江省黑河市第九中学2021--2022学年高一上学期期中考试化学试题安徽省淮北市国泰中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
7 . 第四周期中的18 种元素具有重要的用途,在现代工业中备受青睐。
(1)其中,未成对电子数最多的元素名称为_______ ,该元素的基态原子中,电子占据的最高能层具有的原子轨道数为_______ 。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能不符合这一规律原因是_______ 。
(3)AsH3 中心原子杂化的类型为_______ ,分子构型为_______
(4)过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。基态铁原子核外的价电子排布图为_______ 。
(5)与CN-互为等电子体的一种分子为_______ (填化学式);1.5mol [Fe(CN)6]3-中含有键的数目为_______
(1)其中,未成对电子数最多的元素名称为
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能不符合这一规律原因是
(3)AsH3 中心原子杂化的类型为
(4)过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。基态铁原子核外的价电子排布图为
(5)与CN-互为等电子体的一种分子为
您最近一年使用:0次
2021-05-29更新
|
112次组卷
|
2卷引用:新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题
解题方法
8 . 第四周期某些过渡元素在工业生产中有着极其重要的作用。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:___________ 。
(2) 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为___________ 。
Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1) 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是___________ 。
(2)铁氰化钾 是检验
是检验 的重要试剂。
的重要试剂。
①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式___________ 。
②铁氰化钾中存在的化学键有___________ (填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。
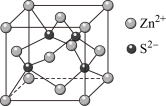
(1)该晶胞中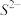 的配位数为
的配位数为___________ 。
(2)若晶胞参数为 ,则该晶体密度的计算式为
,则该晶体密度的计算式为___________  (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:
(2)
 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)
 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是(2)铁氰化钾
 是检验
是检验 的重要试剂。
的重要试剂。①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式
②铁氰化钾中存在的化学键有
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。

(1)该晶胞中
 的配位数为
的配位数为(2)若晶胞参数为
 ,则该晶体密度的计算式为
,则该晶体密度的计算式为 (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
您最近一年使用:0次
2021-05-18更新
|
258次组卷
|
2卷引用:新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题
解题方法
9 . 为了验证木炭可被浓硫酸氧化为CO2,选用如图所示仪器(内含物质)组装成实验装置:
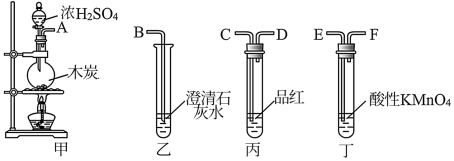
(1)如按气流由左向右流向,连接双数装置的正确顺序是(填各接口字母)A接___________ ,___________ 接___________ ,___________ 接 B;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中___________ ,丙中___________ ;
(3)丁中酸性KMnO4溶液的作用是___________ ,该反应氧化剂与还原剂的物质的量之比为___________ 。
(4)硫酸的性质有:A.脱水性 B.酸性 C.强氧化性 D.吸水性,在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
①实验室干燥氢气___________ ;
②浓硫酸与金属铜的反应___________ ;
③实际生产中,浓硫酸可用钢瓶贮运___________ ;
④向滤纸上滴加浓硫酸,滤纸变黑___________ 。

(1)如按气流由左向右流向,连接双数装置的正确顺序是(填各接口字母)A接
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中
(3)丁中酸性KMnO4溶液的作用是
(4)硫酸的性质有:A.脱水性 B.酸性 C.强氧化性 D.吸水性,在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
①实验室干燥氢气
②浓硫酸与金属铜的反应
③实际生产中,浓硫酸可用钢瓶贮运
④向滤纸上滴加浓硫酸,滤纸变黑
您最近一年使用:0次
名校
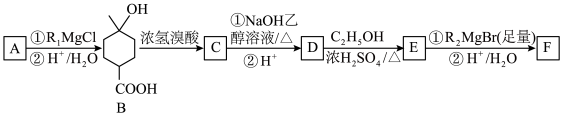
10 . 某有机物F( )是一种用途广泛的试剂,可用作抗氧化剂、香料、医药、农药等。工业上合成它的一种路径如图所示(R1、R2代表烷基):
)是一种用途广泛的试剂,可用作抗氧化剂、香料、医药、农药等。工业上合成它的一种路径如图所示(R1、R2代表烷基):
已知:①R'COOC2H5
②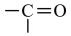 (不是羧基)
(不是羧基)
(1)R2MgBr的化学式为____________ ,A的结构简式为___________ ,F的分子式为________ 。
(2)B中官能团的名称为______________
(3)D到E的反应类型是______________ 。
(4)写出C与NaOH的乙醇溶液反应的化学方程式:__________ 。
(5)满足下列条件的D的同分异构体还有_______ 种。
①与D物质含有相同官能团 ②含有六元环且环上有两个取代基
 )是一种用途广泛的试剂,可用作抗氧化剂、香料、医药、农药等。工业上合成它的一种路径如图所示(R1、R2代表烷基):
)是一种用途广泛的试剂,可用作抗氧化剂、香料、医药、农药等。工业上合成它的一种路径如图所示(R1、R2代表烷基):
已知:①R'COOC2H5

②
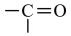 (不是羧基)
(不是羧基)
(1)R2MgBr的化学式为
(2)B中官能团的名称为
(3)D到E的反应类型是
(4)写出C与NaOH的乙醇溶液反应的化学方程式:
(5)满足下列条件的D的同分异构体还有
①与D物质含有相同官能团 ②含有六元环且环上有两个取代基
您最近一年使用:0次



