名校
解题方法
1 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为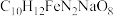 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
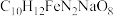 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: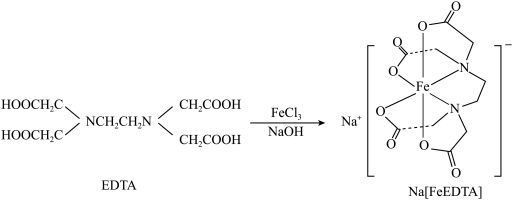
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.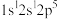 | B. | C. | D.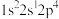 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
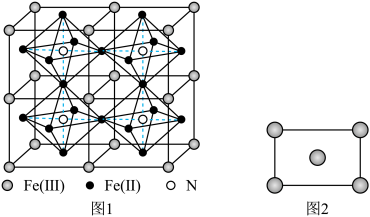
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
889次组卷
|
8卷引用:北京市第二中学2022-2023学年高二下学期期末考试化学试题
北京市第二中学2022-2023学年高二下学期期末考试化学试题北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学
解题方法
2 . A、B、C是中学化学中常见的物质,且A、B、C均含有同一种元素,在一定条件下相互转化关系如下图所示(部分产物已略去)。请回答:
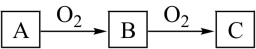
(1)若B是无色气体,C是红棕色气体。
① A、B、C所含相同元素在元素周期表中的位置是______ 。
② 下列说法正确的是______ (填字母)。
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式__________________ 。
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
① A、B、C所含相同元素的原子结构示意图是______ 。
② 下列说法不正确的是______ (填字母)。
a.A一定是黄色晶体
b.可以用上述转化关系制备硫酸
c.B与水反应做还原剂。
③C的水溶液与氢氧化钠的反应为______________ (填吸热或放热)反应。
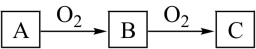
(1)若B是无色气体,C是红棕色气体。
① A、B、C所含相同元素在元素周期表中的位置是
② 下列说法正确的是
a.常温下,A为无色气体
b.A、B、C中所含相同元素的化合价依次升高
c.C与水反应只做还原剂。
③若A是化合物,写出由A氧化生产B的化学方程式
(2)若B是一种有刺激性气味的有毒气体,C与水反应生成硫酸
① A、B、C所含相同元素的原子结构示意图是
② 下列说法不正确的是
a.A一定是黄色晶体
b.可以用上述转化关系制备硫酸
c.B与水反应做还原剂。
③C的水溶液与氢氧化钠的反应为
您最近一年使用:0次
2020-07-07更新
|
197次组卷
|
2卷引用:北京市延庆区2019-2020学年高一下学期期中考试化学试题
名校
3 . X、Y、Z、W、M为五种短周期元素,且原子序数依次增大。X与W、Z与M分别同主族,M的原子最外层电子数比次外层少2个。X与Y可以按照原子个数比3:1形成化合物A,1个A分子中含有10个电子。请回答:
(1)Y在周期表中的位置是___________ 。
(2)甲、乙、丙为三种强电解质,分别由上述五种元素中的三种组成。甲、乙、丙的稀溶液之间存在如下转化关系:

①乙、丙溶液混合加热的离子方程式为:___________ 。
②金属Cu与甲、乙的混合溶液反应的离子方程式为:___________ 。
(3)化合物WY3是合成抗禽流感药物“达菲”的中间物质,WY3受撞击会生成一种非金属单质和一种化合物W3Y,请写出该反应的化学方程式___________ 。若反应生成标准状况下33.6L气体单质,则电子转移的物质的量为___________ mol。
(1)Y在周期表中的位置是
(2)甲、乙、丙为三种强电解质,分别由上述五种元素中的三种组成。甲、乙、丙的稀溶液之间存在如下转化关系:

①乙、丙溶液混合加热的离子方程式为:
②金属Cu与甲、乙的混合溶液反应的离子方程式为:
(3)化合物WY3是合成抗禽流感药物“达菲”的中间物质,WY3受撞击会生成一种非金属单质和一种化合物W3Y,请写出该反应的化学方程式
您最近一年使用:0次
2010·北京西城·二模
4 . 化合物A是制玻璃的主要原料之一。常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性。D元素是地壳中含量仅次于氧的非金属元素。化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%。上述物质间的转化关系如下图所示。
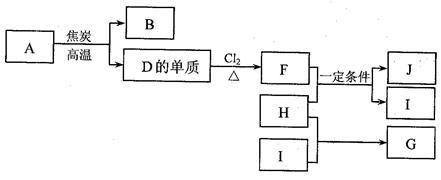
(1)除A外,制玻璃的主要原料还有物质(填化学式)_______ 、_______ 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,原因是(用化学方程式表示)_______ 。
(2)D元素在元素周期表中的位置是___________ 。
(3)H的电子式是_________ 。
(4)F和H反应生成J和I反应的化学方程式是___________ 。
(5)下列说法正确的是(填选项序号)______ 。
a.上述由A生成D的单质的反应属于置换反应
b. D元素在自然界中主要以单质形式存在
c. G是含有极性共价键的离子化合物
d. I是强电解质,G是弱电解质,二者的水溶液都显酸性

(1)除A外,制玻璃的主要原料还有物质(填化学式)
盛放NaOH溶液的试剂瓶不能用玻璃塞,原因是(用化学方程式表示)
(2)D元素在元素周期表中的位置是
(3)H的电子式是
(4)F和H反应生成J和I反应的化学方程式是
(5)下列说法正确的是(填选项序号)
a.上述由A生成D的单质的反应属于置换反应
b. D元素在自然界中主要以单质形式存在
c. G是含有极性共价键的离子化合物
d. I是强电解质,G是弱电解质,二者的水溶液都显酸性
您最近一年使用:0次
5 . 硒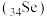 是一种应用广泛的元素。
是一种应用广泛的元素。
Ⅰ.检测细胞体内的
风湿性关节炎与细胞体内产生的 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。 位于元素周期表中
位于元素周期表中_____________ 区(填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。
② 的结构式是
的结构式是_____________ 。
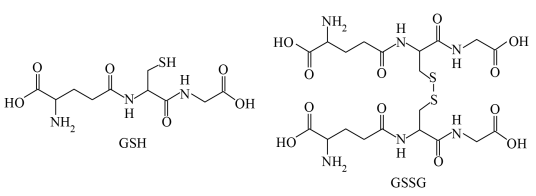
(2)在 中,
中, 转化为
转化为 。
。 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子__________ 。
② 中,
中, 与
与 的物质的量之比为
的物质的量之比为_________________ 。
Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。_________________ 。
②晶胞中“ ”表示
”表示_________________ (填离子符号)。
(4)新型镁电池放电时,图1晶胞中 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的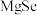 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的_____________________ (填序号)。
 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
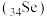 是一种应用广泛的元素。
是一种应用广泛的元素。Ⅰ.检测细胞体内的

风湿性关节炎与细胞体内产生的
 有关。一种含
有关。一种含 的荧光探针分子
的荧光探针分子 检测
检测 及再生的转化如图。
及再生的转化如图。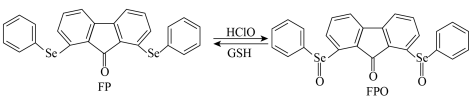
 位于元素周期表中
位于元素周期表中 ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。②
 的结构式是
的结构式是(2)在
 中,
中, 转化为
转化为 。
。
 ”在
”在 中标出所有的手性碳原子
中标出所有的手性碳原子②
 中,
中, 与
与 的物质的量之比为
的物质的量之比为Ⅱ.应用于光电领域
 可作为新型镁电池的正极材料,其晶胞结构如图所示。
可作为新型镁电池的正极材料,其晶胞结构如图所示。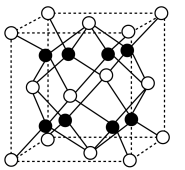
②晶胞中“
 ”表示
”表示(4)新型镁电池放电时,图1晶胞中
 位置不变,
位置不变, 嵌入的同时
嵌入的同时 被挤出。生成的
被挤出。生成的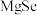 晶体结构与
晶体结构与 晶体相似,其中
晶体相似,其中 位于图1晶胞的
位于图1晶胞的 .棱心
.棱心  .面心
.面心  .体心
.体心  .顶点
.顶点
您最近一年使用:0次
6 . 金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是_______ 。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________ 。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________ 。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是____________________________________ 。
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________ 。
(4)电解法可以提纯粗镓,具体原理如图2所示:
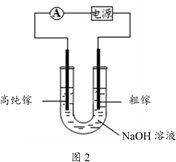
①粗镓与电源____ 极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________ 。
(1) 镓(Ga)的原子结构示意图为
 ,镓元素在周期表中的位置是
,镓元素在周期表中的位置是(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

图中A点和C点化学平衡常数的关系是:KA
(4)电解法可以提纯粗镓,具体原理如图2所示:

①粗镓与电源
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
您最近一年使用:0次
名校
解题方法
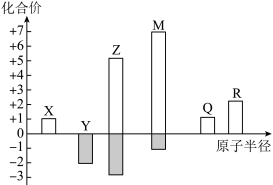
7 . X、Y、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所。 电子式为
电子式为_________ 。
(2)比较Y和Z的简单氢化物,更稳定的是_________ (填化学式)。
(3)已知Q位于第三周期,则R在元素周期表中的位置是_________ 。
(4)下列推断正确的是_________ (填“序号”)。
a.简单离子半径: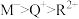
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式_________ ;比较 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是_________ (填离子符号),从原子结构的角度解释原因_________ 。
 电子式为
电子式为(2)比较Y和Z的简单氢化物,更稳定的是
(3)已知Q位于第三周期,则R在元素周期表中的位置是
(4)下列推断正确的是
a.简单离子半径:
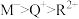
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式
 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是
您最近一年使用:0次
名校
8 . 氧、硫、硒( )、碲(
)、碲( )、钋(
)、钋(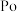 )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ 。
(2)某温度时,该族单质与 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下:
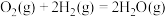

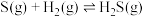


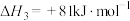
①硫和硒的氢化物的热稳定性:H2S_____ H2Se (填>、=或<);用原子结构知识解释你的判断结果_______ 。
②写出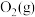 与
与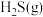 反应生成
反应生成 和
和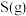 的热化学方程式
的热化学方程式_______ 。
(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为_______ 。
②生物浸出时的总反应的氧化剂是_______ 。
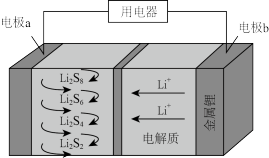
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: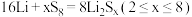 。下列说法
。下列说法错误 的是_______
 )、碲(
)、碲( )、钋(
)、钋(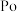 )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:(1)
 在周期表中的位置为
在周期表中的位置为(2)某温度时,该族单质与
 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下: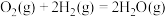

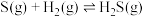


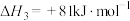
①硫和硒的氢化物的热稳定性:H2S
②写出
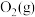 与
与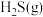 反应生成
反应生成 和
和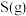 的热化学方程式
的热化学方程式(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为
②生物浸出时的总反应的氧化剂是
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极
 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: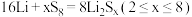 。下列说法
。下列说法
A.电池工作时,正极可发生反应: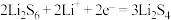 |
B.电池工作时,外电路中流过 电子,负极材料减重 电子,负极材料减重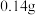 |
C.石墨烯的作用主要是提高电极 的导电性 的导电性 |
D.电池充电时间越长,电池中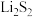 的量越多 的量越多 |
您最近一年使用:0次
2022-07-05更新
|
134次组卷
|
2卷引用:北京市第十二中学2021-2022学年高一下学期6月月考化学试题
名校
9 . 摩擦剂是牙膏的主体成分, 是一种常见的摩擦剂.
是一种常见的摩擦剂.
(1) 在元素周期表中的位置是
在元素周期表中的位置是_____________ .
(2)根据用途推测 在水中的溶解性:
在水中的溶解性:_____________ (填“易溶”或“难溶”).
(3)制备 的方法如下:
的方法如下:

①写出反应Ⅰ的离子方程式________________________ .
②比较酸性强弱:
_____________ 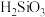 (填“>”或“<”).
(填“>”或“<”).
③结合原子结构解释②中酸性关系: 和S电子层数相同,
和S电子层数相同,__________________________ .
(4)为满足不同需求,牙膏中会添加一些特殊物质,如含氟牙膏中添加氟化亚锡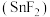 .
.
已知锡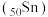 元素与
元素与 同族.下列说法正确的是
同族.下列说法正确的是_____________ (填序号).
a. 元素的最高正化合价为
元素的最高正化合价为 B.
B. 的原子半径比
的原子半径比 大
大
c. 和
和 均可以作良好的半导体材料 D.锡酸
均可以作良好的半导体材料 D.锡酸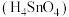 的酸性强于硅酸
的酸性强于硅酸
(5)工业上可以用木炭还原 制备粗硅(同时生成一种还原性气体),该反应的化学方程式为:
制备粗硅(同时生成一种还原性气体),该反应的化学方程式为:_____________ ;该反应能否验证 和C的非金属性强弱?
和C的非金属性强弱?_____________ (填“能”、“不能”)
(6)甲同学按如图所示的装置进行实验.打开分液漏斗活塞,一段时间后,观察试管中现象.甲认为该实验能验证C与 元素的非金属性强弱.你是否同意其观点?
元素的非金属性强弱.你是否同意其观点?_____________ (填“同意”、“不同意”);
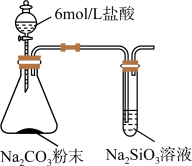
(a)若同意,指出试管中预期的现象,并写出锥形瓶中反应的离子方程式;(b)若不同意,请改进实验,写出实验方案._____________
 是一种常见的摩擦剂.
是一种常见的摩擦剂.(1)
 在元素周期表中的位置是
在元素周期表中的位置是(2)根据用途推测
 在水中的溶解性:
在水中的溶解性:(3)制备
 的方法如下:
的方法如下:
①写出反应Ⅰ的离子方程式
②比较酸性强弱:

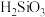 (填“>”或“<”).
(填“>”或“<”).③结合原子结构解释②中酸性关系:
 和S电子层数相同,
和S电子层数相同,(4)为满足不同需求,牙膏中会添加一些特殊物质,如含氟牙膏中添加氟化亚锡
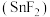 .
.已知锡
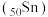 元素与
元素与 同族.下列说法正确的是
同族.下列说法正确的是a.
 元素的最高正化合价为
元素的最高正化合价为 B.
B. 的原子半径比
的原子半径比 大
大c.
 和
和 均可以作良好的半导体材料 D.锡酸
均可以作良好的半导体材料 D.锡酸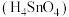 的酸性强于硅酸
的酸性强于硅酸(5)工业上可以用木炭还原
 制备粗硅(同时生成一种还原性气体),该反应的化学方程式为:
制备粗硅(同时生成一种还原性气体),该反应的化学方程式为: 和C的非金属性强弱?
和C的非金属性强弱?(6)甲同学按如图所示的装置进行实验.打开分液漏斗活塞,一段时间后,观察试管中现象.甲认为该实验能验证C与
 元素的非金属性强弱.你是否同意其观点?
元素的非金属性强弱.你是否同意其观点?
(a)若同意,指出试管中预期的现象,并写出锥形瓶中反应的离子方程式;(b)若不同意,请改进实验,写出实验方案.
您最近一年使用:0次
10 . W、X、Y为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为3s23p4,X的电离能数据如下表所示。
(1)Y在元素周期表中的位置是___________ 。
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈___________ (填“酸”或“碱”)性,依据是___________ 。
②W和X的最高价氧化物对应的水化物中,碱性较强的是___________ (写化学式),结合资料说明理由:___________ 。
| 电离能 |  |  |  |  | … |
 | 738 | 1451 | 7733 | 10540 | … |
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为
 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
②W和X的最高价氧化物对应的水化物中,碱性较强的是
您最近一年使用:0次
2024-02-22更新
|
96次组卷
|
2卷引用:北京市汇文中学2023-2024学年高二上学期期末化学试题



