名校
解题方法
1 . 元素化合物知识在化工生产和生活中发挥着重要作用,根据教材知识和题中所给资料完成下列各题
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。
资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中, 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。
②在碱性、中性或微弱酸性溶液中, 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。
资料Ⅲ:硫代硫酸钠: 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。
S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式___________ ,写出在碱性溶液中, 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式___________ 。
(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式___________ 。
(3)写出Na2S2O3与盐酸反应的化学方程式___________ 。
(4)1个Na2S2O8中化合价为-2价的氧原子有___________ 个,其阴离子 结构中含有
结构中含有___________ 个过氧键(—O—O—)。
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以
 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中,
 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。②在碱性、中性或微弱酸性溶液中,
 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。资料Ⅲ:硫代硫酸钠:
 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式
 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式
(3)写出Na2S2O3与盐酸反应的化学方程式
(4)1个Na2S2O8中化合价为-2价的氧原子有
 结构中含有
结构中含有
您最近一年使用:0次
2 . 某小组同学在实验室设计实验验证物质的性质及其相互转化。
Ⅰ.设计了如图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
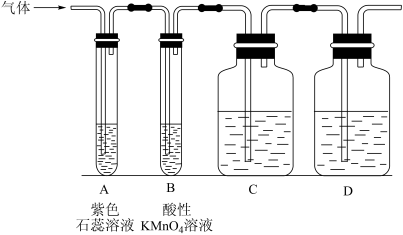
(1)从物质分类的角度,SO2属于____ (填“酸性”或“碱性”)氧化物。
(2)利用Cu与浓H2SO4反应也可以制得SO2气体,请写出该反应的化学方程式____ 。
(3)从元素化合价的角度分析,SO2既有氧化性又有还原性。
①当通入SO2一段时间后,可观察B中溶液褪色,说明SO2具有____ 性,补充完整反应的离子方程式:________SO2+________MnO +________=________SO
+________=________SO +________Mn2++________。
+________Mn2++________。____
②如验证SO2还具有另一方面的性质,可选择的药品是____ (填字母)。
A.氯化铁溶液 B.浓硫酸 C.氯水 D.硫化钠溶液
Ⅱ.实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如图方案进行提纯:
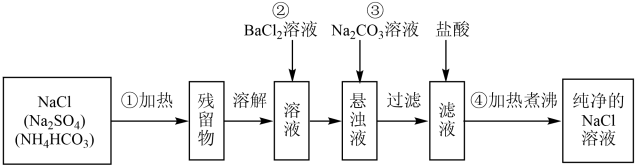
(4)请写出①加热除去NH4HCO3的化学方程式____ 。
(5)进行操作②后,如何判断SO 已除尽,方法是
已除尽,方法是____ 。
(6)操作④的目的是____ 。
Ⅰ.设计了如图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。

(1)从物质分类的角度,SO2属于
(2)利用Cu与浓H2SO4反应也可以制得SO2气体,请写出该反应的化学方程式
(3)从元素化合价的角度分析,SO2既有氧化性又有还原性。
①当通入SO2一段时间后,可观察B中溶液褪色,说明SO2具有
 +________=________SO
+________=________SO +________Mn2++________。
+________Mn2++________。②如验证SO2还具有另一方面的性质,可选择的药品是
A.氯化铁溶液 B.浓硫酸 C.氯水 D.硫化钠溶液
Ⅱ.实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如图方案进行提纯:

(4)请写出①加热除去NH4HCO3的化学方程式
(5)进行操作②后,如何判断SO
 已除尽,方法是
已除尽,方法是(6)操作④的目的是
您最近一年使用:0次
名校
解题方法
3 . 某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
(1)探究BaCO3和BaSO4之间的转化
实验操作:
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,___________ 。
②写出实验Ⅱ中加入C溶液后发生反应的离子方程式是___________ 。
③现有0.34mol的BaSO4沉淀,使用1L饱和Na2CO3溶液(物质的量浓度为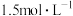 )处理,需要反复处理
)处理,需要反复处理___________ 次,才能使BaSO4全部转化为BaCO3.
(2)探究AgCl和AgI之间的转化
①用化学用语表示AgI的沉淀溶解平衡___________ 。
②25℃时,若使Ag+沉淀完全,则溶液中Cl﹣的浓度至少为___________  。
。
实验Ⅲ: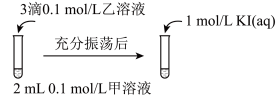
可供选择的试剂有:a.AgNO3溶液 b.NaCl溶液 c.KI溶液
③若要用实验Ⅲ证明AgCl能够转化为AgI,甲溶液应选择___________ (填上方试剂的编号);应用实验Ⅲ的方式,无论怎样选择试剂,学生都无法观察到AgI转化为AgCl,于是又设计了如下实验。
实验Ⅳ:
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
④查阅有关资料可知,Ag+可氧化I﹣,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率___________ (填“大于”或“小于”)沉淀反应速率。设计原电池实验(使用盐桥阻断Ag+与I﹣的相互接触)如上图所示,则该原电池总反应的离子方程式为___________ 。
已知:实验测得电压表读数:a>c>b>0.
⑤结合信息,解释实验Ⅳ中b<a的原因:___________ 。
⑥实验Ⅳ的现象能说明AgI可向AgCl转化,理由是:___________ 。
综合实验Ⅰ~Ⅳ,可得出结论:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现。
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
 (25℃) (25℃) | 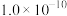 |  | 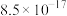 |  |
(1)探究BaCO3和BaSO4之间的转化
实验操作:

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生沉淀部分溶解 |
②写出实验Ⅱ中加入C溶液后发生反应的离子方程式是
③现有0.34mol的BaSO4沉淀,使用1L饱和Na2CO3溶液(物质的量浓度为
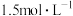 )处理,需要反复处理
)处理,需要反复处理(2)探究AgCl和AgI之间的转化
①用化学用语表示AgI的沉淀溶解平衡
②25℃时,若使Ag+沉淀完全,则溶液中Cl﹣的浓度至少为
 。
。实验Ⅲ:

可供选择的试剂有:a.AgNO3溶液 b.NaCl溶液 c.KI溶液
③若要用实验Ⅲ证明AgCl能够转化为AgI,甲溶液应选择
实验Ⅳ:
| 装置 | 步骤 | 电压表读数 |
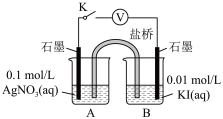 | i.如图连接装置并加入试剂,闭合K | a |
| ii.向B中滴入AgNO3溶液,至沉淀完全 | b | |
| iii.再向B中投入一定量NaCl固体 | c | |
| iv。重复i,再向B中加入与iii等量NaCl固体 | a |
④查阅有关资料可知,Ag+可氧化I﹣,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率
已知:实验测得电压表读数:a>c>b>0.
⑤结合信息,解释实验Ⅳ中b<a的原因:
⑥实验Ⅳ的现象能说明AgI可向AgCl转化,理由是:
综合实验Ⅰ~Ⅳ,可得出结论:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现。
您最近一年使用:0次
4 . I、中国高铁被誉为中国新“四大发明”之一,它对实现“一带一路”的构想有重要的作用。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和___________ 。
(2)高铁车厢的大部分材料是铝合金,是利用了铝合金材料___________ (填2种)等优点。
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为___________ 。
Ⅱ、含氯物质在生产生活中有重要作用。
实验室制取氯气的装置如图所示。
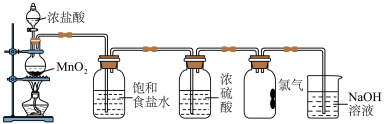
(4)收集氯气的集气瓶中,导管没有画完整,请将装置补充完整___________ 。
(5)NaOH溶液的作用是(用离子方程式表示)___________
(6)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习小组分析成因时提出如下猜想:
猜想a;随H+浓度降低,MnO2的氧化性减弱。
猪想b:随Cl-浓度降低,Cl-的还原性___________ (填“增强”、“不变”或“减弱”)。
猜想c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、SO 对体系中各物质的氧化性与还原性均无影响。
对体系中各物质的氧化性与还原性均无影响。
②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物中加入试剂。
通过三组实验,a、b、c三个猜想都得到了证实,则X为___________ (填化学式),Y为___________ (填化学式)。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和
(2)高铁车厢的大部分材料是铝合金,是利用了铝合金材料
(3)高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为
Ⅱ、含氯物质在生产生活中有重要作用。
实验室制取氯气的装置如图所示。

(4)收集氯气的集气瓶中,导管没有画完整,请将装置补充完整
(5)NaOH溶液的作用是(用离子方程式表示)
(6)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习小组分析成因时提出如下猜想:
猜想a;随H+浓度降低,MnO2的氧化性减弱。
猪想b:随Cl-浓度降低,Cl-的还原性
猜想c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、SO
 对体系中各物质的氧化性与还原性均无影响。
对体系中各物质的氧化性与还原性均无影响。②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物中加入试剂。
| 组别 | 试剂 | 产物 |
| 1 | 较浓硫酸 | 有Cl2生成 |
| 2 | X | 有Cl2生成 |
| 3 | X和Y | 无Cl2生成 |
您最近一年使用:0次
名校
解题方法
5 . Ⅰ 某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下图:
某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下图:

查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能氧化Cr3+。
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)固体A的主要成分为____________________  填化学式
填化学式 。
。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5的目的是______________ 。
(3)写出④反应的离子反应方程式:____________________________ 。
(4)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240mL时发生反应的化学方程式为____________________________ ,固体D中含铁化合物的物质的量为____________ 。

Ⅱ 经检测该化工厂的工业废水中含
经检测该化工厂的工业废水中含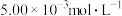 的
的 ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料
,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 的化合价依次为+3、+2),又设计了如下工艺流程:
的化合价依次为+3、+2),又设计了如下工艺流程:

(5)第①步反应的离子方程式为__________________________ 。
(6)欲使1L该废水中的 完全转化为
完全转化为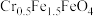 。理论上需要加
。理论上需要加 的质量为
的质量为________ 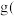 已知
已知 的摩尔质量为278g/mol。)
的摩尔质量为278g/mol。)
 某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下图:
某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下图:
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能氧化Cr3+。
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
| 开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
| 沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为
 填化学式
填化学式 。
。(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5的目的是
(3)写出④反应的离子反应方程式:
(4)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240mL时发生反应的化学方程式为

Ⅱ
 经检测该化工厂的工业废水中含
经检测该化工厂的工业废水中含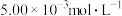 的
的 ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料
,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 的化合价依次为+3、+2),又设计了如下工艺流程:
的化合价依次为+3、+2),又设计了如下工艺流程:
(5)第①步反应的离子方程式为
(6)欲使1L该废水中的
 完全转化为
完全转化为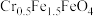 。理论上需要加
。理论上需要加 的质量为
的质量为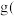 已知
已知 的摩尔质量为278g/mol。)
的摩尔质量为278g/mol。)
您最近一年使用:0次
6 . 实验小组制备高铁酸钾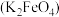 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生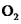 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
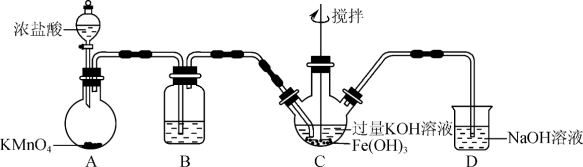
A为氯气发生装置。A中反应化学方程式是________________ (锰被还原为Mn2+)。除杂装置B所用试剂为________ 。C中得到紫色固体和溶液,C中Cl2发生的反应有 ,另外还有(离子方程式表示)
,另外还有(离子方程式表示)_____ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否 氧化了Cl-而产生Cl2,设计下图方案:
氧化了Cl-而产生Cl2,设计下图方案:
①由方案一中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是 将Cl-氧化,还可能由
将Cl-氧化,还可能由____________ 产生(用离子方程式表示)。
②根据 的制备实验得出:氧化性Cl2
的制备实验得出:氧化性Cl2______  (填“>”或“<”),而方案二实验表明,Cl2和
(填“>”或“<”),而方案二实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生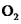 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
A为氯气发生装置。A中反应化学方程式是
 ,另外还有(离子方程式表示)
,另外还有(离子方程式表示)(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否
 氧化了Cl-而产生Cl2,设计下图方案:
氧化了Cl-而产生Cl2,设计下图方案:| 方案一 | 取少量a,滴加KSCN溶液至过量溶液呈血红色。 |
| 方案二 | 用KOH溶液充分洗涤C中所得固体再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有C12产生。 |
 将Cl-氧化,还可能由
将Cl-氧化,还可能由②根据
 的制备实验得出:氧化性Cl2
的制备实验得出:氧化性Cl2 (填“>”或“<”),而方案二实验表明,Cl2和
(填“>”或“<”),而方案二实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
解题方法
7 . 我国资源丰富,合理开发利用资源,才能实现可持续发展。
Ⅰ.以原油为原科生产有机高分子材料聚乙烯、聚丙烯的流程如下:

(1)流程中②表示的加工方法是____(填序号)。
(2)写出聚乙烯的结构简式_______ 。
Ⅱ.浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
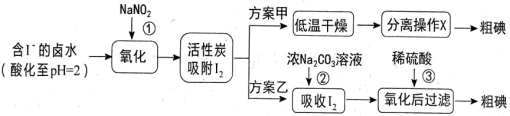
资料显示:
ⅰ. pH=2 时, NaNO2溶液只能将I-氧化为I2,同时生成 NO
ⅱ. I2+5Cl2+6H2O=2HIO3+10HCl; 氧化性:KMnO4>Cl2
ⅲ. 2Fe3++2I-=2Fe2++I2
(3)写出反应①的离子方程式_______ 。
(4)方案甲中,根据 I2的特性,分离操作 X 应为___________ 、冷凝结晶。
(5)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是_______ 。
(6)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 为了检验滤液中的 I-,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、CCl4。
a.将滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,_______ 。
Ⅰ.以原油为原科生产有机高分子材料聚乙烯、聚丙烯的流程如下:

(1)流程中②表示的加工方法是____(填序号)。
| A.分馏 | B.聚合 | C.裂解 | D.干馏 |
Ⅱ.浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ. pH=2 时, NaNO2溶液只能将I-氧化为I2,同时生成 NO
ⅱ. I2+5Cl2+6H2O=2HIO3+10HCl; 氧化性:KMnO4>Cl2
ⅲ. 2Fe3++2I-=2Fe2++I2
(3)写出反应①的离子方程式
(4)方案甲中,根据 I2的特性,分离操作 X 应为
(5)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是
(6)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 为了检验滤液中的 I-,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、CCl4。
a.将滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,
您最近一年使用:0次
8 . 某实验小组制备高铁酸钾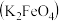 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
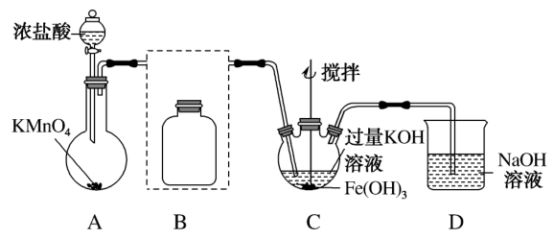
①A为氯气发生装置。
②装置B中盛放的试剂是_______ ,其作用是_______ 。
③C中通入 做氧化剂,制备得到紫色固体和溶液的化学方程式是
做氧化剂,制备得到紫色固体和溶液的化学方程式是_______ .此外C中 发生的反应还有
发生的反应还有_______ (写离子方程式)
(2)探究 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
①由方案Ⅰ中溶液变红反应的离子方程式是_______ ,该金属离子_______ (填“一定是”、“一定不是”、“无法确定是”)由 将
将 氧化所得。
氧化所得。
②方案Ⅱ可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
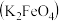 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置。
②装置B中盛放的试剂是
③C中通入
 做氧化剂,制备得到紫色固体和溶液的化学方程式是
做氧化剂,制备得到紫色固体和溶液的化学方程式是 发生的反应还有
发生的反应还有(2)探究
 的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,滴加 溶液至过量,溶液呈红色。 溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。 产生。 |
 将
将 氧化所得。
氧化所得。②方案Ⅱ可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是
您最近一年使用:0次
名校
9 . 某校化学兴趣小组用下图所示装置探究 的性质。请回答:
的性质。请回答:
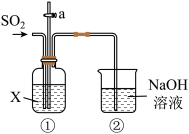
(1)装置②中发生反应的化学方程式是___________ 。
(2)若X为品红溶液,可观察到装置①中溶液___________ ,说明 具有
具有___________ 性。
(3)若X为紫色石蕊溶液,可观察到装置①中溶液___________ ,说明 的水溶液显
的水溶液显___________ (填“酸性”或“碱性”)。
(4)若X为 溶液,可观察到装置①中
溶液,可观察到装置①中___________ (填“有”或“无”)明显现象。打开活塞a,通入氧气,有白色沉淀生成,说明 最终被氧化为
最终被氧化为 ,由此可知
,由此可知 具有
具有___________ (填“氧化性”或“还原性”)。
(5)若X为 溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明
溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明 具有
具有___________ (填“氧化性”或“还原性”),氧化产物是___________ 。
 的性质。请回答:
的性质。请回答:
(1)装置②中发生反应的化学方程式是
(2)若X为品红溶液,可观察到装置①中溶液
 具有
具有(3)若X为紫色石蕊溶液,可观察到装置①中溶液
 的水溶液显
的水溶液显(4)若X为
 溶液,可观察到装置①中
溶液,可观察到装置①中 最终被氧化为
最终被氧化为 ,由此可知
,由此可知 具有
具有(5)若X为
 溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明
溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明 具有
具有
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)写出下列实验事实与所给酸对应的性质(填序号)
A.酸性 B.挥发性 C.吸水性 D.脱水性 E.不稳定性 F.氧化性
①浓硝酸使紫色石蕊试液先变红后褪色___________
②浓硫酸可作氯气的干燥剂___________
③浓硫酸加到蔗糖中,蔗糖变黑___________
(2)“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是___________
①制 :
: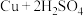 (浓)
(浓)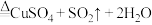
②制 ;
;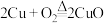 ;
; (稀)
(稀)
③制 :
: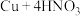 (浓)
(浓)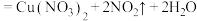
④制 :
: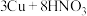 (稀)
(稀)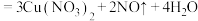
(3)某同学向 溶液中通入
溶液中通入 ,未观察到白色沉淀生成,由此可知酸性强弱:
,未观察到白色沉淀生成,由此可知酸性强弱:
___________ HCl(填“>”或“<”)。取上述所得溶液进行下列操作,能观察到白色沉淀生成的___________ (填字母)。
A.通入 B.滴加
B.滴加 溶液 C.滴加稀盐酸 D.滴加NaOH溶液
溶液 C.滴加稀盐酸 D.滴加NaOH溶液
(4) 中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、
中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、 溶液、
溶液、 、NaOH溶液、氨水。
、NaOH溶液、氨水。
①要证明 具有还原性,应选用的试剂是
具有还原性,应选用的试剂是___________ ,看到的现象是___________ 。
②选用 与
与 反应,反应的现象是
反应,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)写出下列实验事实与所给酸对应的性质(填序号)
A.酸性 B.挥发性 C.吸水性 D.脱水性 E.不稳定性 F.氧化性
①浓硝酸使紫色石蕊试液先变红后褪色
②浓硫酸可作氯气的干燥剂
③浓硫酸加到蔗糖中,蔗糖变黑
(2)“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
①制
 :
: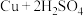 (浓)
(浓)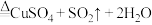
②制
 ;
;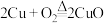 ;
; (稀)
(稀)
③制
 :
: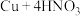 (浓)
(浓)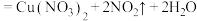
④制
 :
: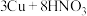 (稀)
(稀)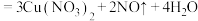
(3)某同学向
 溶液中通入
溶液中通入 ,未观察到白色沉淀生成,由此可知酸性强弱:
,未观察到白色沉淀生成,由此可知酸性强弱:
A.通入
 B.滴加
B.滴加 溶液 C.滴加稀盐酸 D.滴加NaOH溶液
溶液 C.滴加稀盐酸 D.滴加NaOH溶液(4)
 中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、
中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、 溶液、
溶液、 、NaOH溶液、氨水。
、NaOH溶液、氨水。①要证明
 具有还原性,应选用的试剂是
具有还原性,应选用的试剂是②选用
 与
与 反应,反应的现象是
反应,反应的现象是
您最近一年使用:0次



