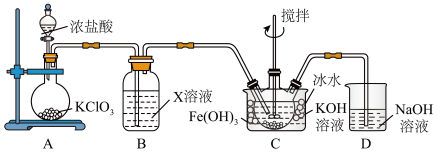
1 . 某研究性学习小组学生根据氧化还原反应规律,探究 、
、 与
与 反应的情况,提出假设并进行相关实验。
反应的情况,提出假设并进行相关实验。
Ⅰ.从理论上分析 和
和 都既有氧化性又有还原性,于是提出如下假设:
都既有氧化性又有还原性,于是提出如下假设:
假设1: 氧化
氧化 ;
;
假设2: 氧化
氧化 。
。
(1)甲同学设计如图装置进行实验:___________ 。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量 粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是___________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设Ⅰ正确。则 和
和 反应的化学方程式是
反应的化学方程式是___________ 。
Ⅱ.该研究性学习小组同学还认为易与 发生反应,应该更易被氧化。查阅资料:
发生反应,应该更易被氧化。查阅资料: ;
;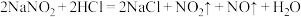 ;酸性条件下,能与
;酸性条件下,能与 反应生成
反应生成 和
和 。
。
(3)丙同学用下图所示装置(部分夹持装置略)探究 与
与 的反应。
的反应。 ,目的是
,目的是___________ 。
②B中观察到的主要现象的是___________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是___________ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,___________ ,则产物是 。
。
 、
、 与
与 反应的情况,提出假设并进行相关实验。
反应的情况,提出假设并进行相关实验。Ⅰ.从理论上分析
 和
和 都既有氧化性又有还原性,于是提出如下假设:
都既有氧化性又有还原性,于是提出如下假设:假设1:
 氧化
氧化 ;
;假设2:
 氧化
氧化 。
。(1)甲同学设计如图装置进行实验:

②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量
 粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
 和
和 反应的化学方程式是
反应的化学方程式是Ⅱ.该研究性学习小组同学还认为易与
 发生反应,应该更易被氧化。查阅资料:
发生反应,应该更易被氧化。查阅资料: ;
;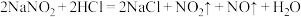 ;酸性条件下,能与
;酸性条件下,能与 反应生成
反应生成 和
和 。
。(3)丙同学用下图所示装置(部分夹持装置略)探究
 与
与 的反应。
的反应。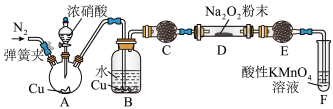
 ,目的是
,目的是②B中观察到的主要现象的是
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,
 。
。
您最近一年使用:0次
2024-04-08更新
|
628次组卷
|
5卷引用:四川省自贡市蜀光中学2023-2024学年高一下学期4月月考化学试题
名校
2 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的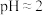 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1052次组卷
|
7卷引用:四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题
四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题2024届四川省攀枝花市第十五中学校高三上学期12月第7次半月考理科综合试题-高中化学广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题热点1实验方案设计(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)
解题方法
3 . 某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是_______ (填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为_______ 。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为_______ 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为_______ ,灼烧后 所得固体的颜色为 _______ ,灼烧时需要使用下列仪器中的 _______ (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______ 。
④由实验数据计算,每片药片中约含Fe2+_______ mg。
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的_______ (选填“氧化性”、“ 还原性”或“碱性”。)
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为
②步骤三中,加入H2O2溶液发生反应的离子方程式为
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是
④由实验数据计算,每片药片中约含Fe2+
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的
您最近一年使用:0次
名校
解题方法
4 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
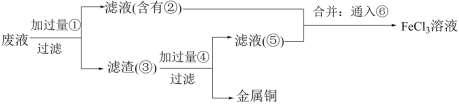
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
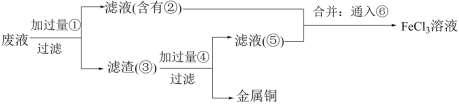
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
409次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
5 . I.完成下列氧化还原反应相关问题。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出___________ (填“氧化性”或“还原性”)。
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为___________ (填化学式)。
(4)浓盐酸在该反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为___________ 。还原性:
___________ Cl−(填“>”“<”或“=”)。
(1)误食NaNO2会使人体血红蛋白中的Fe2+转化为Fe3+而导致中毒,该过程中NaNO2表现出
(2)已知NaNO2可以与NH4Cl反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:
Ⅱ.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物ClO2。其反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(3)该反应中的氧化产物为
(4)浓盐酸在该反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)在碱性条件下加入NaClO3,可将NaCrO2转化为Na2CrO4,ClO
 被还原为Cl−,其离子方程式为
被还原为Cl−,其离子方程式为
您最近一年使用:0次
6 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是___________ ,原子序数为___________ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
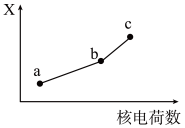
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2023-12-05更新
|
264次组卷
|
3卷引用:四川省眉山北外附属东坡外国语学校2023-2024学年高一下学期开学化学试题
名校
解题方法
7 . 化学创造美好生活,下列说法有关物质的性质与用途错误的是
| A.电子跃迁到激发态过程中释放能量产生紫色光—钾盐可用作紫色烟花的原料 |
| B.高铁酸钾(K2FeO4)具有强氧化性—可用作饮用水消毒剂 |
| C.SO2具有较强的还原性—可以在葡萄酒中添加SO2作为抗氧化剂食品保鲜 |
| D.Ca(OH)2具有碱性—理科突击班化学社团用熟石灰处理实验后的酸性废水 |
您最近一年使用:0次
2023-08-21更新
|
506次组卷
|
2卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
名校
解题方法
8 . Ⅰ.实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:

仪器a的名称是___________ ,装置乙的作用是___________ ,下列说法正确的是:___________ (填序号)。
A.KMnO4溶液用于尾气处理
B.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
C.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
D.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
Ⅱ.某同学为探究NaHSO3溶液与Cu2+的反应,查阅资料设计如下实验:
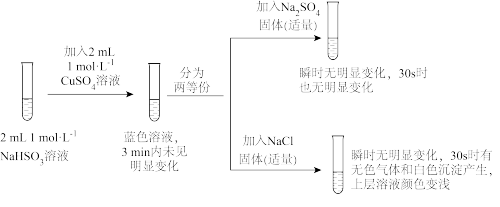
已知:①氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水;
②Cu2O [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:
[Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:
(1)加入NaCl固体后产生的无色气体能使湿润的品红试纸褪色,且加热后能恢复原来的颜色。工业上将Na2S和Na2CO3以2:1的物质的量比配成溶液,然后通入该无色气体,Na2S、Na2CO3完全反应,得到硫代硫酸钠(Na2S2O3)和另一种无色无味的气体,该过程中发生反应的化学方程式是___________ 。
(2)该同学对实验中加入NaCl产生无色气体的原因进行分析,提出两种假设:
①假设1不成立的原因是___________ 。
②若假设2合理,请将假设2补充完整:___________ ,其中生成的白色沉淀是___________ (填化学式)。
(3)通过分析实验可知,Cl—增强了Cu2+的氧化性。某同学设计原电池实验(如图)证明上述实验结果,请将实验现象补充完整:___________ (写两点即可)。
(4)将实验后的溶液静置24小时或加热后,得到红色沉淀,洗涤干燥后利用已知信息设计实验,证明红色沉淀中含有Cu+:___________ 。

仪器a的名称是
A.KMnO4溶液用于尾气处理
B.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
C.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
D.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
Ⅱ.某同学为探究NaHSO3溶液与Cu2+的反应,查阅资料设计如下实验:

已知:①氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水;
②Cu2O
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:
[Cu(NH3)4]2+(深蓝色溶液)。回答下列问题:(1)加入NaCl固体后产生的无色气体能使湿润的品红试纸褪色,且加热后能恢复原来的颜色。工业上将Na2S和Na2CO3以2:1的物质的量比配成溶液,然后通入该无色气体,Na2S、Na2CO3完全反应,得到硫代硫酸钠(Na2S2O3)和另一种无色无味的气体,该过程中发生反应的化学方程式是
(2)该同学对实验中加入NaCl产生无色气体的原因进行分析,提出两种假设:
| 假设1 | Cu2+水解使溶液中c(H+)增大 |
| 假设2 | Cl—存在时,HSO 将Cu2+还原为Cu+,___________ 将Cu2+还原为Cu+,___________ |
②若假设2合理,请将假设2补充完整:
(3)通过分析实验可知,Cl—增强了Cu2+的氧化性。某同学设计原电池实验(如图)证明上述实验结果,请将实验现象补充完整:
| 编号 | 实验1 | 实验2 |
| 实验 |  | 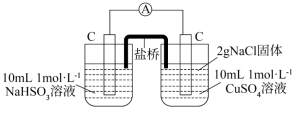 |
| 现象 | 电流表指针发生微小偏转 | 电流表指针发生明显偏转,___________ |
您最近一年使用:0次
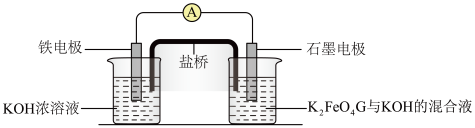
9 . 高铁酸钾(K2FeO4)是高效消毒剂,也是制作大功率电池的重要材料。某实验小组欲制备K2FeO4并探究其性质。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性, 在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
Ⅰ.制备K2FeO4夹持装置略)
(1)A中发生反应的化学方程式是___________ 。
(2)下列试剂中,装置B的X溶液可以选用的是___________ 。
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.NaHCO3溶液
(3)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是___________ ;若要从反应后的装置C中尽可能得到更多的K2FeO4固体,可以采取的一种措施是___________ 。
Ⅱ.探究K2FeO4的性质
(4)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得到溶液a。经检验气体中含有Cl2,为 证明是K2FeO4氧化了Cl-,而不是ClO-氧化了Cl-,设计以下方案:
①由方案Ⅰ中溶液变红可知a中含有离子是___________ ,但该离子的来源不能判断一定是K2FeO4与Cl-反应的产物,还可能是反应___________ (用离子方程式表示)的产物。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的,一是使减少K2FeO4溶解损失,二是___________ 。
(5)小组同学利用制备的K2FeO4制成如图简易电池,发现放电后两极都产生红褐色悬浮物,则该电池的总反应为___________ ;该电池放电时,正极电极反应式为___________ 。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性, 在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
Ⅰ.制备K2FeO4夹持装置略)

(1)A中发生反应的化学方程式是
(2)下列试剂中,装置B的X溶液可以选用的是
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.NaHCO3溶液
(3)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是
Ⅱ.探究K2FeO4的性质
(4)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得到溶液a。经检验气体中含有Cl2,为 证明是K2FeO4氧化了Cl-,而不是ClO-氧化了Cl-,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案II | 用KOH溶液洗净C中所得固体,再用一定浓度的KOH溶液将K2FeO,溶出,得到紫色溶液b,取少量b,滴加盐酸.有Cl2产生。 |
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的,一是使减少K2FeO4溶解损失,二是
(5)小组同学利用制备的K2FeO4制成如图简易电池,发现放电后两极都产生红褐色悬浮物,则该电池的总反应为

您最近一年使用:0次
2021-04-17更新
|
908次组卷
|
4卷引用:四川省攀枝花市2021届高三第一次统一考试理科综合化学试题
四川省攀枝花市2021届高三第一次统一考试理科综合化学试题(已下线)第09讲 铁及其重要化合物(精练)-2022年高考化学一轮复习讲练测2021年北京高考化学试题变式题11-19(已下线)微专题14 氢氧化亚铁、高铁酸盐的制备实验探究-备战2023年高考化学一轮复习考点微专题
名校
10 . 木炭与浓硫酸在加热条件下可发生化学反应,为检验反应的产物,某学生设计了如下图所示的实验,请回答下列问题:___________________ (填装置序号甲、乙等,每个装置仅限使用一次);
(2)甲装置中发生反应的化学方程式为_______________________ ,其中木炭被_________ (填“氧化”或“还原”),浓硫酸体现____________ (填“氧化性”或“还原性”或“酸性”);
(3)两次使用品红溶液的作用分别是________________ ,___________ (按连接先后顺序作答);
(4)丁装置中应该盛装的试剂是酸性_____________ ,写出该反应的离子方程式_______________ ;
(5)丙装置中出现的现象是________________ ,该装置的作用是______________ ;
(6)己装置中的现象是___________ ,能否将己的位置调换到丙的后面?______________ ,原因是_______________________ ;

(2)甲装置中发生反应的化学方程式为
(3)两次使用品红溶液的作用分别是
(4)丁装置中应该盛装的试剂是酸性
(5)丙装置中出现的现象是
(6)己装置中的现象是
您最近一年使用:0次
2024-04-30更新
|
120次组卷
|
2卷引用:四川省成都市安宁河联盟2023-2024学年高一下学期期中联考化学试题



