1 . 下列化学用语表示正确的是
A.NH3分子的VSEPR模型: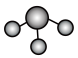 |
B.中子数为18的氯原子: |
C.HCl的形成过程: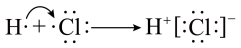 |
D.碳的基态原子轨道表示式: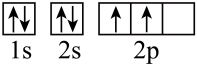 |
您最近一年使用:0次
昨日更新
|
71次组卷
|
2卷引用:陕西省西安市碑林区2023-2024学年高三高考模拟化学试卷
2 . 从古至今,人类的生活、生产都离不开材料的应用。下列说法正确的是
| A.歼-20上采用的氮化镓涂层,属于新型金属材料 |
| B.人民币票面文字处采用了含Fe3O4的磁性油墨,Fe3O4常用作红色颜料 |
| C.北斗卫星上使用的硅太阳能电池阵,利用SiO2将太阳能转化为电能 |
| D.神舟十七号返回舱降落回收过程中使用了芳纶制作的降落伞,芳纶是有机高分子材料 |
您最近一年使用:0次
解题方法
3 . 6-APA(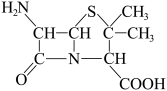 )是青霉素类抗生素的母核,与有机物H缩合生成阿莫西林。某课题组用
)是青霉素类抗生素的母核,与有机物H缩合生成阿莫西林。某课题组用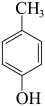 为原料设计阿莫西林的合成路线:
为原料设计阿莫西林的合成路线:
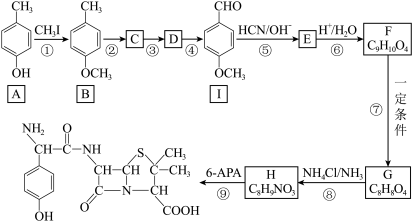
已知: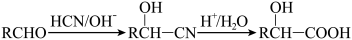
(2)②的反应的条件为
(3)反应①、⑤的类型分别是
(4)反应④的化学方程式
(5)说明反应①、⑦的目的:
(6)满足下列条件I的同分异构体有
①与FeCl3发生显色反应;②与新制氢氧化铜悬浊液产生砖红色沉淀;③不发生水解反应
其中核磁共振氢谱显示为5组峰,且峰面积比为2∶2∶2∶1∶1的同分异构体的结构简式为
您最近一年使用:0次
4 . 五种短周期主族元素的原子半径和主要化合价如图所示。下列叙述正确的是
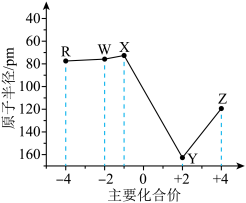
| A.电负性:R>W>X |
| B.最简单氢化物的热稳定性:X>W>R |
| C.基态原子中未成对电子数:Z>Y>X |
| D.工业上电解熔融YW制备Y单质 |
您最近一年使用:0次
名校
解题方法
5 . 2-甲基-2-丁醇是一种有机合成中间体,通常以溴乙烷、镁、丙酮等为原料,无水乙醚为溶剂,在无水、无氧的条件下,通过格氏反应制备。
反应过程:
ⅰ.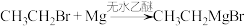 (乙基溴化镁);
(乙基溴化镁);
反应装置如图所示:
步骤1:乙基溴化镁的制备
在干燥的三颈烧瓶中加入1.8g镁粉、1小粒碘,在仪器A中加入7mL溴乙烷、15mL无水乙醚,混匀。安装搅拌、回流装置,由仪器A向三口瓶中滴入40滴(约2mL)溴乙烷、乙醚混合液。待反应缓和后,开动搅拌器,滴加剩余的混合液,控制滴速,维持反应液呈微沸状态,滴加完毕,用温水浴继续回流搅拌0.5h。使镁粉反应完全,冷却至室温。
步骤2:2-甲基-2-丁醇粗产品的制备
开动搅拌器,向仪器A中加入3.7mL(约0.05mol)无水丙酮和5mL无水乙醚的混合液,滴加完毕,继续搅拌15min,三颈烧瓶中有灰白色粘稠状固体析出。冷却后,在搅拌条件下滴加30mL 20%硫酸溶液。待反应完全后,分离得到醚溶液。
步骤3:蒸馏
将醚溶液加入烧瓶中,蒸去乙醚,再在电热套上直接加热蒸出产品,收集95~105℃馏分。
回答下列问题:
(1)仪器A的名称为_______ ;步骤3中蒸去乙醚的最佳加热方式为_______ 。
(2)本实验无需加入沸石的原因为_______ 。
(3)反应装置图中碱石灰的作用是_______ 。
(4)本实验采用乙醚作溶剂的优点为_______(填选项字母)。
(5)步骤2中的反应是放热反应,为避免反应过于剧烈,可采取的措施有_______ (任写两条)。
(6)步骤2中分离出醚溶液的具体操作为_______ 。
(7)实验结束后,测得产品质量为3.2g,则本实验的产率为_______ (保留三位有效数字)。
反应过程:
ⅰ.
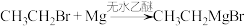 (乙基溴化镁);
(乙基溴化镁);ⅱ.CH3CH2MgBr+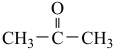
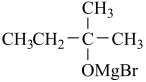 ;
;
ⅲ.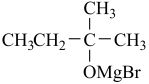

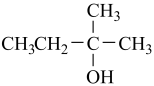 (未配平,部分生成物略)。
(未配平,部分生成物略)。
| 名称 | 相对分子质量 | 性状 | 密度( ) ) | 沸点(℃) | 溶解度(g/100mL溶剂) | |
| 水 | 乙醚 | |||||
| 乙醚 | 74 | 无色透明液体 | 0.7097 | 34.5 | 微溶 | — |
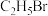 | 109 | 无色透明液体 | 1.2990 | 38.4 | 0.914 | 混溶 |
| 丙酮 | 58 | 无色透明液体 | 0.7899 | 56.2 | 混溶 | 混溶 |
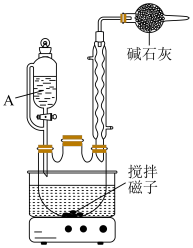
步骤1:乙基溴化镁的制备
在干燥的三颈烧瓶中加入1.8g镁粉、1小粒碘,在仪器A中加入7mL溴乙烷、15mL无水乙醚,混匀。安装搅拌、回流装置,由仪器A向三口瓶中滴入40滴(约2mL)溴乙烷、乙醚混合液。待反应缓和后,开动搅拌器,滴加剩余的混合液,控制滴速,维持反应液呈微沸状态,滴加完毕,用温水浴继续回流搅拌0.5h。使镁粉反应完全,冷却至室温。
步骤2:2-甲基-2-丁醇粗产品的制备
开动搅拌器,向仪器A中加入3.7mL(约0.05mol)无水丙酮和5mL无水乙醚的混合液,滴加完毕,继续搅拌15min,三颈烧瓶中有灰白色粘稠状固体析出。冷却后,在搅拌条件下滴加30mL 20%硫酸溶液。待反应完全后,分离得到醚溶液。
步骤3:蒸馏
将醚溶液加入烧瓶中,蒸去乙醚,再在电热套上直接加热蒸出产品,收集95~105℃馏分。
回答下列问题:
(1)仪器A的名称为
(2)本实验无需加入沸石的原因为
(3)反应装置图中碱石灰的作用是
(4)本实验采用乙醚作溶剂的优点为_______(填选项字母)。
| A.使有机镁化合物更稳定,并能溶解于乙醚 |
| B.易挥发,可以排除反应器中大部分空气 |
| C.无毒、无害、绿色环保 |
D.沸点与 接近,便于步骤1分离出未反应的 接近,便于步骤1分离出未反应的 |
(5)步骤2中的反应是放热反应,为避免反应过于剧烈,可采取的措施有
(6)步骤2中分离出醚溶液的具体操作为
(7)实验结束后,测得产品质量为3.2g,则本实验的产率为
您最近一年使用:0次
7日内更新
|
143次组卷
|
3卷引用:陕西省渭南高级中学2025届高三上学期9月份联考化学试题
名校
解题方法
6 . 二氧化碳加氢制甲烷有利于实现“碳达峰、碳中和”,该过程中的主要反应为
①
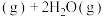
 ;
;
②
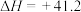
 。
。
回答下列问题:
(1)写出甲烷与 反应制取水煤气(CO、
反应制取水煤气(CO、 )的热化学方程式:
)的热化学方程式:_______ 。
(2)已知部分化学键的键能数据如表所示:
其中x=_______ 。
(3)恒温恒压下,向某密闭容器中充入一定量的 和
和 ,同时发生反应①和②,下列事实能说明反应②达到化学平衡状态的是_______。
,同时发生反应①和②,下列事实能说明反应②达到化学平衡状态的是_______。
(4)向若干个体积均为2L的恒容密闭容器中均充入1mol  、3.6mol
、3.6mol  ,若只发生反应①
,若只发生反应①
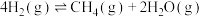 △H=-165kJ/mol,在不同温度下经过10min测得各容器中
△H=-165kJ/mol,在不同温度下经过10min测得各容器中 的转化率如图所示。
的转化率如图所示。 转化率先升高后降低的原因是
转化率先升高后降低的原因是_______ 。
②X点对应的坐标为(400,80),X点对应 的转化率为
的转化率为_______ (保留三位有效数字);X点对应的容器中压强为 kPa,则X点对应的平衡常数
kPa,则X点对应的平衡常数
_______ 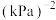 (用含
(用含 的代数式表示,
的代数式表示, 为用分压表示的平衡常数,气体的分压=总压×该气体的物质的量分数)。
为用分压表示的平衡常数,气体的分压=总压×该气体的物质的量分数)。
③X、Y两点对应的平衡常数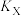
_______ 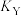 (填“大于”、“等于”或“小于”)。
(填“大于”、“等于”或“小于”)。
①

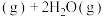
 ;
;②

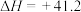
 。
。回答下列问题:
(1)写出甲烷与
 反应制取水煤气(CO、
反应制取水煤气(CO、 )的热化学方程式:
)的热化学方程式:(2)已知部分化学键的键能数据如表所示:
| 化学键 | C-H | H-H | O-H | C=O |
| 键能(kJ/mol) | 414 | 436 | 463 | x |
(3)恒温恒压下,向某密闭容器中充入一定量的
 和
和 ,同时发生反应①和②,下列事实能说明反应②达到化学平衡状态的是_______。
,同时发生反应①和②,下列事实能说明反应②达到化学平衡状态的是_______。| A.容器内气体密度不再变化 | B.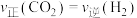 |
| C.气体的平均相对分子质量不再变化 | D.混合气体的总质量不变 |
 、3.6mol
、3.6mol  ,若只发生反应①
,若只发生反应①
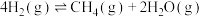 △H=-165kJ/mol,在不同温度下经过10min测得各容器中
△H=-165kJ/mol,在不同温度下经过10min测得各容器中 的转化率如图所示。
的转化率如图所示。
 转化率先升高后降低的原因是
转化率先升高后降低的原因是②X点对应的坐标为(400,80),X点对应
 的转化率为
的转化率为 kPa,则X点对应的平衡常数
kPa,则X点对应的平衡常数
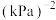 (用含
(用含 的代数式表示,
的代数式表示, 为用分压表示的平衡常数,气体的分压=总压×该气体的物质的量分数)。
为用分压表示的平衡常数,气体的分压=总压×该气体的物质的量分数)。③X、Y两点对应的平衡常数
 (填“大于”、“等于”或“小于”)。
(填“大于”、“等于”或“小于”)。
您最近一年使用:0次
7日内更新
|
417次组卷
|
3卷引用:陕西省渭南高级中学2025届高三上学期9月份联考化学试题
名校
解题方法
7 . 钛酸钡( )具有高介电常数和低介电损耗的性质,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微
)具有高介电常数和低介电损耗的性质,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微 粉末的制备方法如图所示。下列说法错误的是
粉末的制备方法如图所示。下列说法错误的是
 )具有高介电常数和低介电损耗的性质,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微
)具有高介电常数和低介电损耗的性质,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微 粉末的制备方法如图所示。下列说法错误的是
粉末的制备方法如图所示。下列说法错误的是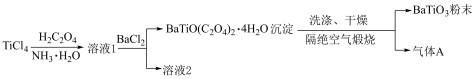
A.煅烧时得到的气体A是CO、 、 、 |
| B.用溶液2提取的一种副产物可作肥料 |
| C.流程中的三步反应均为非氧化还原反应 |
D.配制 溶液时,应先将 溶液时,应先将 固体溶于浓盐酸再加水稀释 固体溶于浓盐酸再加水稀释 |
您最近一年使用:0次
7日内更新
|
228次组卷
|
3卷引用:陕西省渭南高级中学2025届高三上学期9月份联考化学试题
名校
解题方法
8 . 我国科学家已经成功催化氢化 获得甲酸,利用化合物1催化氢化
获得甲酸,利用化合物1催化氢化 的反应过程如图甲所示,其中化合物2与水反应生成化合物3与
的反应过程如图甲所示,其中化合物2与水反应生成化合物3与 过程中的能量变化如图乙所示(TS表示过渡态,I表示中间体),下列说法错误的是
过程中的能量变化如图乙所示(TS表示过渡态,I表示中间体),下列说法错误的是
 获得甲酸,利用化合物1催化氢化
获得甲酸,利用化合物1催化氢化 的反应过程如图甲所示,其中化合物2与水反应生成化合物3与
的反应过程如图甲所示,其中化合物2与水反应生成化合物3与 过程中的能量变化如图乙所示(TS表示过渡态,I表示中间体),下列说法错误的是
过程中的能量变化如图乙所示(TS表示过渡态,I表示中间体),下列说法错误的是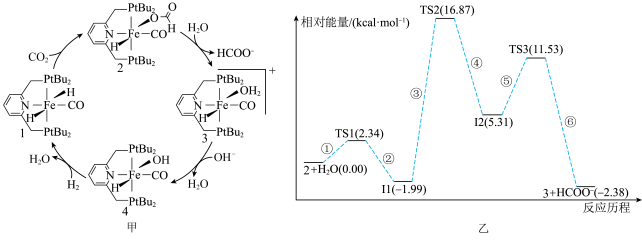
A.化合物1为该反应的催化剂,可加快 的转化速率 的转化速率 |
B.图乙中形成中间体I2的反应为图甲中“化合物2+ →化合物3+ →化合物3+ ”的决速步骤 ”的决速步骤 |
| C.化合物1→化合物2的过程中存在碳氧键的断裂和碳氢键的形成 |
D.从平衡移动的角度看,升高温度可促进化合物2与水反应生成化合物3与 |
您最近一年使用:0次
7日内更新
|
289次组卷
|
3卷引用:陕西省渭南高级中学2025届高三上学期9月份联考化学试题
名校
解题方法
9 . M、Q、Z、Y、X、T是原子半径依次增大的短周期主族元素,除M外其他元素均为同周期元素,M与Q形成的化合物能刻蚀玻璃,这六种元素形成的一种化合物结构如图所示。下列说法正确的是
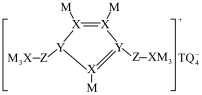
| A.M与X、Y形成的化合物中,前者的沸点一定低于后者 |
| B.Y、X、T三种元素中,Y的最高价含氧酸酸性最强 |
| C.与Z同周期且第一电离能大于Z的元素有2种 |
| D.该化合物为离子化合物,熔点很高,高于MgO |
您最近一年使用:0次
7日内更新
|
250次组卷
|
3卷引用:陕西省渭南高级中学2025届高三上学期9月份联考化学试题
名校
解题方法
10 . 为达到相应实验目的,下列所选玻璃仪器和试剂均准确、全面的是(不考虑存放试剂的容器和连接装置)
| 选项 | 实验目的 | 玻璃仪器 | 试剂 |
| A | 葡萄糖的银镜反应实验 | 试管、酒精灯、烧杯、量筒、胶头滴管 | 10%葡萄糖溶液、新制的银氨溶液 |
| B | 实验室制备乙烯 | 蒸馏烧瓶、温度计、酒精灯、导管 | 75%乙醇、浓硫酸 |
| C | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、烧杯、玻璃棒 | 蒸馏水、NaCl固体 |
| D | 萃取溴水中的溴单质 | 长颈漏斗、烧杯 | 苯、溴水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7日内更新
|
228次组卷
|
3卷引用:陕西省渭南高级中学2025届高三上学期9月份联考化学试题



