1 . 氢硫酸是 的水溶液,已知选项中的反应均在常温下进行,常温下,
的水溶液,已知选项中的反应均在常温下进行,常温下, 的电离常数负对数:
的电离常数负对数: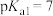 ,
,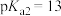 ,
,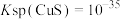 ,下列说法
,下列说法不正确 的是
 的水溶液,已知选项中的反应均在常温下进行,常温下,
的水溶液,已知选项中的反应均在常温下进行,常温下, 的电离常数负对数:
的电离常数负对数: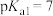 ,
,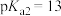 ,
,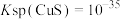 ,下列说法
,下列说法A.室温下物质的量浓度均为 的 的 与 与 的混合溶液的 的混合溶液的 约为13 约为13 |
B.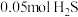 气体通入 气体通入 的硫酸铜溶液,能观察到黑色沉淀 的硫酸铜溶液,能观察到黑色沉淀 |
C.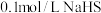 溶液中 溶液中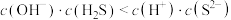 |
D.向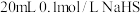 溶液中滴加一定体积的 溶液中滴加一定体积的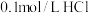 溶液,混合后体积变化忽略不计,不考虑气体等其他物质的逸出,溶液中一定存在: 溶液,混合后体积变化忽略不计,不考虑气体等其他物质的逸出,溶液中一定存在: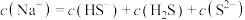 |
您最近一年使用:0次
真题
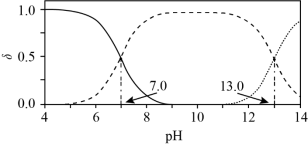
2 . 室温下, 水溶液中各含硫微粒物质的量分数
水溶液中各含硫微粒物质的量分数 随
随 变化关系如下图[例如
变化关系如下图[例如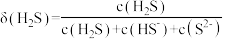 ]。已知:
]。已知: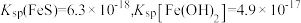 。
。
 水溶液中各含硫微粒物质的量分数
水溶液中各含硫微粒物质的量分数 随
随 变化关系如下图[例如
变化关系如下图[例如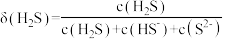 ]。已知:
]。已知: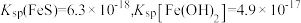 。
。
A.溶解度: 大于 大于 |
B.以酚酞为指示剂(变色的 范围8.2~10.0),用 范围8.2~10.0),用 标准溶液可滴定 标准溶液可滴定 水溶液的浓度 水溶液的浓度 |
C.忽略 的第二步水解, 的第二步水解, 的 的 溶液中 溶液中 水解率约为 水解率约为 |
D.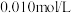 的 的 溶液中加入等体积 溶液中加入等体积 的 的 溶液,反应初始生成的沉淀是 溶液,反应初始生成的沉淀是 |
您最近一年使用:0次
真题
3 . 氢是清洁能源,硼氢化钠( )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)

请回答:
(1)该反应能自发进行的条件是_______。
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
(3)为加速 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比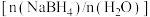 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因_______ 。_______ 。该电池以 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为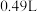 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为_______ 。[已知:该条件下 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间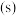 ;
;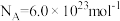 ;
;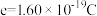 。]
。] )再生为
)再生为 。(已知:
。(已知: 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当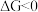 时,反应能自发进行。)
时,反应能自发进行。)
I.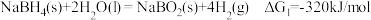
II.
III.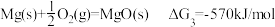
请书写一个方程式表示 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明
_______ 。(要求:反应物不超过三种物质;氢原子利用率为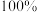 。)
。)
 )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)
请回答:
(1)该反应能自发进行的条件是_______。
| A.高温 | B.低温 | C.任意温度 | D.无法判断 |
| A.升高溶液温度 | B.加入少量异丙胺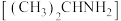 |
C.加入少量固体硼酸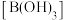 | D.增大体系压强 |
 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比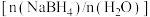 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因
 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为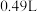 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间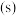 ;
;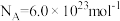 ;
;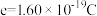 。]
。]
 )再生为
)再生为 。(已知:
。(已知: 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当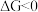 时,反应能自发进行。)
时,反应能自发进行。)I.
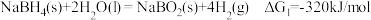
II.

III.
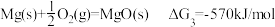
请书写一个方程式表示
 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明
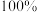 。)
。)
您最近一年使用:0次
名校
解题方法
4 . 氯及其部分化合物相关转化如图:
(1)化合物C的分子为 ,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:
,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:_______ 。
(2)下列有关流程中的说法正确的是_______。
(3)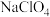 与浓硫酸反应可得
与浓硫酸反应可得 (
(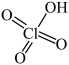 );
); 在液态时存在八元环状结构的双聚体,请画出环状
在液态时存在八元环状结构的双聚体,请画出环状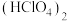 的结构式:
的结构式:_______ 。
(4)工业上利用过量的氨气、 、和乙醛进行气相反应合成异肼
、和乙醛进行气相反应合成异肼 然后使其水解得到肼
然后使其水解得到肼 :理论上生成
:理论上生成 的肼需要消耗
的肼需要消耗
_______ mol。
比较相同温度下,同浓度的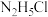 溶液和
溶液和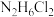 溶液的
溶液的 大小,
大小,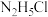
_______ 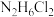 。(填大于、小于、等于或不能确定)
。(填大于、小于、等于或不能确定)
(5)设计实验证明 的碱性比
的碱性比 强
强_______ 。

(1)化合物C的分子为
 ,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:
,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:(2)下列有关流程中的说法正确的是_______。
A.工业上采用软锰矿(主要成分是 )与浓盐酸混合加热制备 )与浓盐酸混合加热制备 |
B.步骤④中以惰性电极电解制备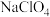 时,另一电极上产生 时,另一电极上产生 |
C.混合物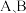 的物质的量之比可以是 的物质的量之比可以是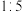 |
D.和1.2-二氯乙烯相似, 分子也存在顺反异构 分子也存在顺反异构 |
(3)
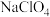 与浓硫酸反应可得
与浓硫酸反应可得 (
( );
); 在液态时存在八元环状结构的双聚体,请画出环状
在液态时存在八元环状结构的双聚体,请画出环状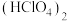 的结构式:
的结构式:(4)工业上利用过量的氨气、
 、和乙醛进行气相反应合成异肼
、和乙醛进行气相反应合成异肼 然后使其水解得到肼
然后使其水解得到肼 :理论上生成
:理论上生成 的肼需要消耗
的肼需要消耗
比较相同温度下,同浓度的
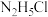 溶液和
溶液和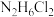 溶液的
溶液的 大小,
大小,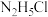
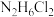 。(填大于、小于、等于或不能确定)
。(填大于、小于、等于或不能确定)(5)设计实验证明
 的碱性比
的碱性比 强
强
您最近一年使用:0次
名校
解题方法
5 . 低碳烯烃(乙烯、丙烯等)作为化学工业重要基本有机化工原料,在现代石油和化学工业中起着举足轻重的作用。碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应Ⅰ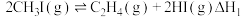
反应Ⅱ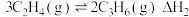
反应Ⅲ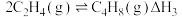
(1)反应Ⅰ、Ⅱ、Ⅲ的 随温度的变化如图1所示。
随温度的变化如图1所示。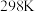 下,
下,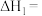
_______ kJ/mol。
(3)利用计算机模拟反应过程。一定压强条件下,测定反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图2所示。结合图1、图2,回答下列问题:_______ 。
A.同一个反应, 会随温度的变化而变,但变化程度不大
会随温度的变化而变,但变化程度不大
B.若 随温度的上升而增大,则
随温度的上升而增大,则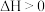
C.随温度升高,反应Ⅱ的化学平衡先正向移动后逆向移动
D.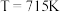 时,反应Ⅱ的平衡常数小于反应Ⅲ
时,反应Ⅱ的平衡常数小于反应Ⅲ
②从图2中可看出,当体系温度高于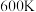 时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:
时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:_______ 。
(4)维持温度为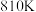 ,压强为
,压强为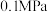 ,起始投料
,起始投料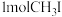 ,测得平衡体系中
,测得平衡体系中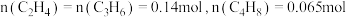 。
。
①平衡时 的物质的量分数
的物质的量分数 为
为_______ 。
②已知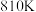 条件下,存在等式
条件下,存在等式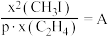 (常数)
(常数)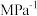 (对于气相反应,用某组分B的平衡压强
(对于气相反应,用某组分B的平衡压强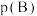 可代替物质的量浓度
可代替物质的量浓度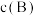 ,如
,如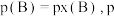 为平衡总压强,
为平衡总压强,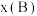 为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出
为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出 与压强
与压强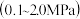 关系的曲线示意图
关系的曲线示意图_______ 。
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应Ⅰ
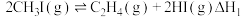
反应Ⅱ
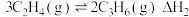
反应Ⅲ
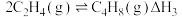
(1)反应Ⅰ、Ⅱ、Ⅲ的
 随温度的变化如图1所示。
随温度的变化如图1所示。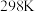 下,
下,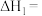
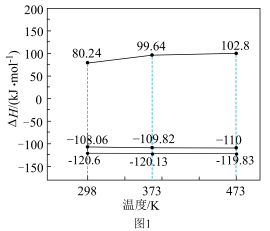
| A.高压 | B.高温 | C.移去 | D.催化剂 |
(3)利用计算机模拟反应过程。一定压强条件下,测定反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图2所示。结合图1、图2,回答下列问题:
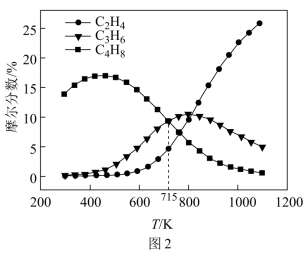
A.同一个反应,
 会随温度的变化而变,但变化程度不大
会随温度的变化而变,但变化程度不大B.若
 随温度的上升而增大,则
随温度的上升而增大,则
C.随温度升高,反应Ⅱ的化学平衡先正向移动后逆向移动
D.
 时,反应Ⅱ的平衡常数小于反应Ⅲ
时,反应Ⅱ的平衡常数小于反应Ⅲ②从图2中可看出,当体系温度高于
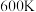 时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:
时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:(4)维持温度为
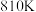 ,压强为
,压强为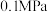 ,起始投料
,起始投料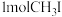 ,测得平衡体系中
,测得平衡体系中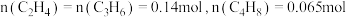 。
。①平衡时
 的物质的量分数
的物质的量分数 为
为②已知
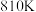 条件下,存在等式
条件下,存在等式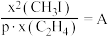 (常数)
(常数)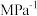 (对于气相反应,用某组分B的平衡压强
(对于气相反应,用某组分B的平衡压强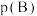 可代替物质的量浓度
可代替物质的量浓度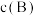 ,如
,如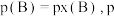 为平衡总压强,
为平衡总压强,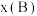 为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出
为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出 与压强
与压强 关系的曲线示意图
关系的曲线示意图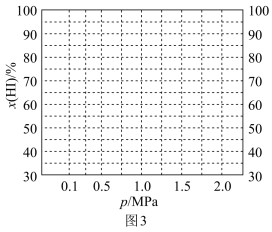
您最近一年使用:0次
名校
解题方法
6 . 工业上高炉炼铁产生的CO和CO2可以按如下流程脱除或利用。___________ 。
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是___________ 。
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式___________ 。
(3)设计实验验证化合物A中含有N元素___________ ;写出实验过程中涉及的反应方程式___________ 。

已知: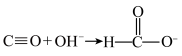 。请回答:
。请回答:
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式
(3)设计实验验证化合物A中含有N元素
您最近一年使用:0次
真题
解题方法
7 . 氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图1, 的配位数(紧邻的阳离子数)为
的配位数(紧邻的阳离子数)为_______ ;写出该化合物的化学式_______ ,写出该化合物与足量 溶液反应的化学方程式
溶液反应的化学方程式_______ 。
(3)化合物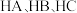 和
和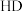 的结构如图2。
的结构如图2。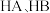 和
和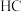 中羟基与水均可形成氢键(
中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序
),按照氢键由强到弱对三种酸排序_______ ,请说明理由_______ 。
②已知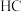 、
、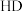 钠盐的碱性
钠盐的碱性 ,请从结构角度说明理由
,请从结构角度说明理由_______ 。
(1)某化合物的晶胞如图1,
 的配位数(紧邻的阳离子数)为
的配位数(紧邻的阳离子数)为 溶液反应的化学方程式
溶液反应的化学方程式
A. 的基态原子电子排布方式只有一种 的基态原子电子排布方式只有一种 |
B. 的第二电离能 的第二电离能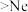 的第一电离能 的第一电离能 |
C. 的基态原子简化电子排布式为 的基态原子简化电子排布式为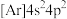 |
D. 原子变成 原子变成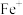 ,优先失去 ,优先失去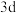 轨道上的电子 轨道上的电子 |
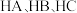 和
和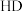 的结构如图2。
的结构如图2。
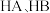 和
和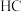 中羟基与水均可形成氢键(
中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序
),按照氢键由强到弱对三种酸排序②已知
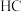 、
、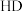 钠盐的碱性
钠盐的碱性 ,请从结构角度说明理由
,请从结构角度说明理由
您最近一年使用:0次
真题
解题方法
8 . 某小组采用如下实验流程制备 :
: 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
请回答:
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是_______ ,判断步骤I反应结束的实验现象是_______ 。不正确 的是_______。
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证_______ 。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中 含量以确定纯度。滴定原理为:先用过量
含量以确定纯度。滴定原理为:先用过量 标准溶液沉淀
标准溶液沉淀 ,再以
,再以 标准溶液回滴剩余的
标准溶液回滴剩余的 。已知:
。已知:
①从下列选项中选择合适的操作补全测定步骤_______ 。
称取产品 ,用少量稀酸A溶解后转移至
,用少量稀酸A溶解后转移至 容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取
容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取 待测溶液加入锥形瓶→_______→_______→加入稀酸B→用
待测溶液加入锥形瓶→_______→_______→加入稀酸B→用 标准溶液滴定→_______→读数。
标准溶液滴定→_______→读数。
a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂 溶液
溶液
d.滴加指示剂硫酸铁铵 溶液
溶液
e.准确移取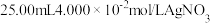 标准溶液加入锥形瓶
标准溶液加入锥形瓶
f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是_______ 。
③三次滴定消耗 标准溶液的平均体积为
标准溶液的平均体积为 ,则产品纯度为
,则产品纯度为_______ 。
 :
:
 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。请回答:
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是

| A.步骤I中,反应物和溶剂在使用前除水 |
| B.步骤I中,若控温加热器发生故障,改用酒精灯(配石棉网)加热 |
| C.步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜 |
| D.步骤Ⅳ中,使用冷的正己烷洗涤 |
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中
 含量以确定纯度。滴定原理为:先用过量
含量以确定纯度。滴定原理为:先用过量 标准溶液沉淀
标准溶液沉淀 ,再以
,再以 标准溶液回滴剩余的
标准溶液回滴剩余的 。已知:
。已知:| 难溶电解质 |  (黄色) (黄色) |  (白色) (白色) |  (红色) (红色) |
溶度积常数 | 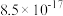 | 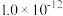 |  |
称取产品
 ,用少量稀酸A溶解后转移至
,用少量稀酸A溶解后转移至 容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取
容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取 待测溶液加入锥形瓶→_______→_______→加入稀酸B→用
待测溶液加入锥形瓶→_______→_______→加入稀酸B→用 标准溶液滴定→_______→读数。
标准溶液滴定→_______→读数。a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂
 溶液
溶液d.滴加指示剂硫酸铁铵
 溶液
溶液e.准确移取
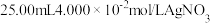 标准溶液加入锥形瓶
标准溶液加入锥形瓶f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是
③三次滴定消耗
 标准溶液的平均体积为
标准溶液的平均体积为 ,则产品纯度为
,则产品纯度为
您最近一年使用:0次
真题
解题方法
9 . 金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两种对海水中钢闸门的防腐措施示意图:

| A.图1、图2中,阳极材料本身均失去电子 |
B.图2中,外加电压偏高时,钢闸门表面可发生反应: |
| C.图2中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果 |
| D.图1、图2中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应 |
您最近一年使用:0次
名校
解题方法
10 . 乙醇-水催化重整可获得 。主要发生以下反应:
。主要发生以下反应:
反应Ⅰ: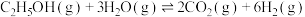
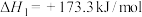
反应Ⅱ:
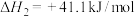
(1)反应Ⅰ自发进行的条件是_______。
(2)500℃时,向体积为VL的恒容密闭容器中充入1mol (g)和3mol
(g)和3mol  (g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%,
(g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%, 的转化率为80%。(CO的选择性=
的转化率为80%。(CO的选择性= )
)
①反应Ⅰ的
_______ (列出计算式即可)。反应Ⅰ的标准平衡常数 ,其中
,其中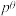 为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。
为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。
②在下图中画出500℃时,乙醇平衡转化率随[ ]变化而变化的情况
]变化而变化的情况_______ 。 的平衡产率与温度、起始时
的平衡产率与温度、起始时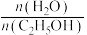 关系如图所示,每条曲线表示
关系如图所示,每条曲线表示 相同的平衡产率。
相同的平衡产率。 的平衡产率:Q点
的平衡产率:Q点_______ N点(填“>”、“=”或“<”);
②M、N两点 的平衡产率相等的原因是
的平衡产率相等的原因是_______ 。
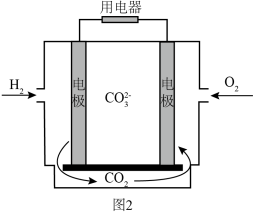
(4)氢气的应用:氢气熔融碳酸盐燃料电池工作原理如图所示。 和
和 经催化重整生成CO和
经催化重整生成CO和 ,CO和
,CO和 全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)
全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)_______ 。
②理论上负极生成的 与正极消耗的
与正极消耗的 的物质的量之比是
的物质的量之比是_______ 。
 。主要发生以下反应:
。主要发生以下反应:反应Ⅰ:
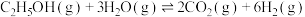
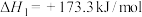
反应Ⅱ:

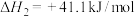
(1)反应Ⅰ自发进行的条件是_______。
| A.低温 | B.高温 | C.低压 | D.高压 |
(2)500℃时,向体积为VL的恒容密闭容器中充入1mol
 (g)和3mol
(g)和3mol  (g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%,
(g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%, 的转化率为80%。(CO的选择性=
的转化率为80%。(CO的选择性= )
)①反应Ⅰ的

 ,其中
,其中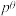 为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。
为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。②在下图中画出500℃时,乙醇平衡转化率随[
 ]变化而变化的情况
]变化而变化的情况
 的平衡产率与温度、起始时
的平衡产率与温度、起始时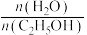 关系如图所示,每条曲线表示
关系如图所示,每条曲线表示 相同的平衡产率。
相同的平衡产率。
 的平衡产率:Q点
的平衡产率:Q点②M、N两点
 的平衡产率相等的原因是
的平衡产率相等的原因是(4)氢气的应用:氢气熔融碳酸盐燃料电池工作原理如图所示。

 和
和 经催化重整生成CO和
经催化重整生成CO和 ,CO和
,CO和 全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)
全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)②理论上负极生成的
 与正极消耗的
与正极消耗的 的物质的量之比是
的物质的量之比是
您最近一年使用:0次



