名校
解题方法
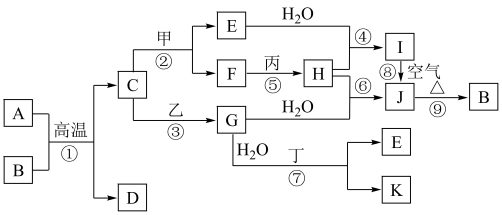
1 . 如图是中学化学常见物质的转化关系,部分物质和反应条件略去。其中A是地壳中含量最多的金属元素的单质,B是一种红棕色粉末;通常情况下,乙为黄绿色气体单质,H是有刺激性气味的气体,在工业上可通过反应⑥在高温高压、催化剂条件下合成;J为难溶于水的红褐色固体;反应⑦在工业上可用于制作印刷电路板。
请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为___________ 。
(2)在反应①~⑨中,不属于氧化还原反应的是___________ 。
(3)写出下列反应的化学方程式:
反应①:___________ 。
反应⑧:___________ 。
(4)写出乙与E在溶液中反应的离子方程式:___________ 。
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:___________ 。
(6)检验G中阳离子的试剂的化学式为___________ ,反应现象为___________ 。

请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为
(2)在反应①~⑨中,不属于氧化还原反应的是
(3)写出下列反应的化学方程式:
反应①:
反应⑧:
(4)写出乙与E在溶液中反应的离子方程式:
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:
(6)检验G中阳离子的试剂的化学式为
您最近一年使用:0次
2 .  、
、 、
、 、
、 、
、 、
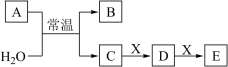
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(1)若 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:
① 的电子式为
的电子式为___________ , 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
②若 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为___________ 。
③若 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为_____ (填代号)。
a.酚酞溶液b. 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液
④若 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为________ ,写出 的一种用途
的一种用途______ 。
(2)若 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:
①组成物质 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是___________ 。
② 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性___________ (填“增强”、“减弱”或“不变”)。
③若 为强电解质,则
为强电解质,则 可能为
可能为___________ (填代号)。
a. b.
b. c.
c. d.
d.
④请写出 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:___________ 。
 、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(1)若
 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:①
 的电子式为
的电子式为 与
与 反应的离子方程式为
反应的离子方程式为②若
 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为③若
 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为a.酚酞溶液b.
 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液④若
 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为 的一种用途
的一种用途(2)若
 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:①组成物质
 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是②
 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性③若
 为强电解质,则
为强电解质,则 可能为
可能为a.
 b.
b. c.
c. d.
d.
④请写出
 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:
您最近一年使用:0次
2023-12-26更新
|
184次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期12月考试化学试题
解题方法
3 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
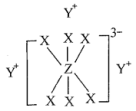
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出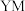 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓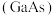 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
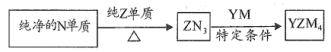
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
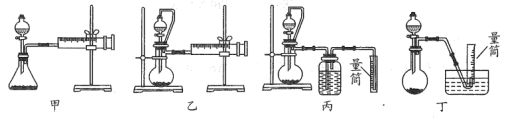
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示: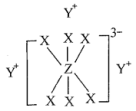
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是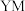 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓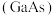 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
解题方法
4 . 已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A与B能形成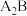 和
和 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
(1)C在元素周期表中的位置是_______ 。
(2)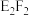 的电子式为
的电子式为_______ 。
(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4) 和
和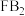 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的 和
和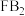 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为_______ 。
(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。
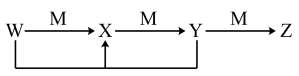
①Z的化学式为_______ 。
②上述五种物质所含的元素中,原子半径最大的是_______ (填元素符号)。
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为_______ 。
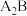 和
和 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:(1)C在元素周期表中的位置是
(2)
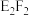 的电子式为
的电子式为(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为
(4)
 和
和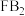 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的 和
和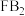 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。

①Z的化学式为
②上述五种物质所含的元素中,原子半径最大的是
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为
您最近一年使用:0次
名校
5 . 六氟锑酸钠(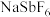 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含 、
、 和
和 、
、 、
、 等)合成六氟锑酸钠的工艺流程如图所示:
等)合成六氟锑酸钠的工艺流程如图所示:
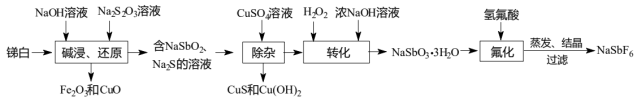
已知:① 的性质与
的性质与 类似;②
类似;② 可溶于Na2S溶液;③
可溶于Na2S溶液;③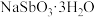 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:
(1)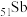 在元素周期表中的位置是
在元素周期表中的位置是_______ ,属于______ 区元素
(2)“碱浸、还原”时, 发生反应的离子方程式为
发生反应的离子方程式为_______ ;若 与
与 反应计量关系为2∶1,则氧化产物为
反应计量关系为2∶1,则氧化产物为_______
(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的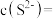
_______ [结果保留两位有效数字,常温下, ,
,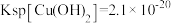 ]
]
(4)“转化”时控温约 的原因是
的原因是_______
(5)“氟化”中发生的反应化学方程式为_______ ,此过程不能选择玻璃仪器,是因为_______
(6)氟锑酸化学式为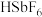 ,酸性比纯硫酸要强
,酸性比纯硫酸要强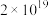 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成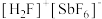 ,
, 离子的空间构型为
离子的空间构型为_______
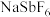 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含 、
、 和
和 、
、 、
、 等)合成六氟锑酸钠的工艺流程如图所示:
等)合成六氟锑酸钠的工艺流程如图所示:
已知:①
 的性质与
的性质与 类似;②
类似;② 可溶于Na2S溶液;③
可溶于Na2S溶液;③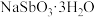 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:(1)
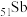 在元素周期表中的位置是
在元素周期表中的位置是(2)“碱浸、还原”时,
 发生反应的离子方程式为
发生反应的离子方程式为 与
与 反应计量关系为2∶1,则氧化产物为
反应计量关系为2∶1,则氧化产物为(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入
 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的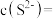
 ,
,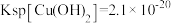 ]
](4)“转化”时控温约
 的原因是
的原因是(5)“氟化”中发生的反应化学方程式为
(6)氟锑酸化学式为
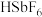 ,酸性比纯硫酸要强
,酸性比纯硫酸要强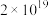 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成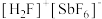 ,
, 离子的空间构型为
离子的空间构型为
您最近一年使用:0次
2022-05-06更新
|
396次组卷
|
2卷引用:湖北省龙泉中学,宜昌一中,荆州中学等四校2021-2022学年高三下学期模拟联考化学试题
解题方法
6 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:
SbCl3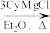 SbCy3(Cy代表-C6H11)
SbCy3(Cy代表-C6H11)

(1)已知Sb的原子序数为51,则它在元素周期表中的位置是_______ ,属于_____ (填s”、“p”、“d”或“ds”)区元素。
(2)CuI中Cu+的价电子排布图为_______ ;SbCy3只能与一个Cu+配位的原因是_____
(3)比较F和I的第一电离能大小,并说明理由:_______
(4)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是_______ 晶体,预测SbCl3的VSEPR模型名称为_______
(5)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_______ ,_______
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式_______ ,设阿伏加德罗常数的值为NA,已知SbCy3的相对分子质量是371,则该铜碘杂化团簇的密度_______ g/cm3(列计算式)
SbCl3
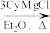 SbCy3(Cy代表-C6H11)
SbCy3(Cy代表-C6H11)
(1)已知Sb的原子序数为51,则它在元素周期表中的位置是
(2)CuI中Cu+的价电子排布图为
(3)比较F和I的第一电离能大小,并说明理由:
(4)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是
(5)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及
 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式
您最近一年使用:0次
解题方法
7 . A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。

请针对以下三种不同情况回答:
 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
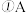 中含有的金属元素在元素周期表中的位置为
中含有的金属元素在元素周期表中的位置为_______________________ ,向水中加入X物质,X对水的电离平衡的影响是_________  填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响” 。
。
 与C的水溶液混合后生成B,反应的离子方程式为
与C的水溶液混合后生成B,反应的离子方程式为___________________________ 。
 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成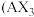 和
和 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为 ,则
,则 单质中含共价键数目为
单质中含共价键数目为_________  ,B的电子式为
,B的电子式为_________ 。
 与水反应的离子方程式为
与水反应的离子方程式为_______________________________________________ 。
 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
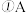 中所含有的化学键类型是
中所含有的化学键类型是_________ 。
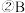 溶液中离子浓度由小到大的顺序是
溶液中离子浓度由小到大的顺序是_________ 。

请针对以下三种不同情况回答:
 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。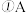 中含有的金属元素在元素周期表中的位置为
中含有的金属元素在元素周期表中的位置为 填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响” 。
。 与C的水溶液混合后生成B,反应的离子方程式为
与C的水溶液混合后生成B,反应的离子方程式为 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成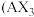 和
和 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为 ,则
,则 单质中含共价键数目为
单质中含共价键数目为 ,B的电子式为
,B的电子式为 与水反应的离子方程式为
与水反应的离子方程式为 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。 中所含有的化学键类型是
中所含有的化学键类型是 溶液中离子浓度由小到大的顺序是
溶液中离子浓度由小到大的顺序是
您最近一年使用:0次
8 . Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去),已知A由短周期非金属元素组成,B具有漂白性且光照易分解。

(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为______________________ ;
②A与H2O反应的离子反应方程式为______________________ ;
③X可能为________ (填代号)。a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为______________________ ;
②A与H2O反应的化学反应方程式为______________________ ;
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(3)请画出沉淀B中金属元素的原子结构示意图______________________ ;
(4)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式______________________ ;
(5)请写出气体C与氯气发生氧化还原反应的化学方程式______________________ 。

(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为
②A与H2O反应的离子反应方程式为
③X可能为
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为
②A与H2O反应的化学反应方程式为
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(3)请画出沉淀B中金属元素的原子结构示意图
(4)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式
(5)请写出气体C与氯气发生氧化还原反应的化学方程式
您最近一年使用:0次
9 . A、B、C、D均为中学化学常见的纯净物,且存在如图所示转化关系,其中A是单质。

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式_________________________ 。
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为________________ ,在A生成C的反应中每消耗1mol还原剂,可生成气体_______________ L(标准状况)。
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是________ ,元素a的最高价氧化物对应水化物的水溶液中离子浓度由大到小的顺序为___________ 。

(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是
您最近一年使用:0次
名校
解题方法
10 . A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________ 。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____ 。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________ 。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________ 。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______ 。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________ 。

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:
您最近一年使用:0次



