1 . 阿来替尼(Alectinib)是2018年9月在中国、美国、欧盟同时被批准使用的“肺癌最强靶向药”,它能有效控制肺癌转移,有效率达100%。其最新中国专利合成路线如下
请回答:
(1)化合物B的含氧官能团的名称______ 。
(2)下列说法正确的是______。
(3)化合物 与
与 反应生成化合物
反应生成化合物 和
和______ 。
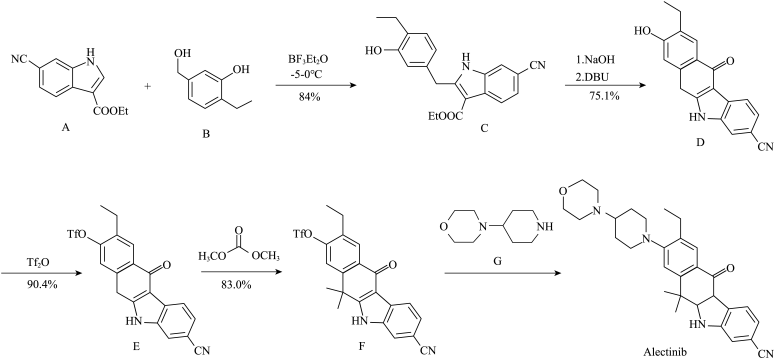
(4)三氟甲基磺酸䣷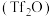 常用于磺酸酯类合成,写出化合物
常用于磺酸酯类合成,写出化合物 与
与 生成Alectinib反应的方程式:
生成Alectinib反应的方程式:____________ 。
(5)写出满足下列条件 的同分异构体的结构简式
的同分异构体的结构简式______ 。
①分子中含有1个苯环,2个羟基;
②有5种不同化学环境的氢原子。
(6)像化合物A一样的结构称为吲哚环结构,以下步骤可合成吲哚环结构:
请回答:
(1)化合物B的含氧官能团的名称
(2)下列说法正确的是______。
A.由 转化为 转化为 的过程中,有一步骤是水解反应 的过程中,有一步骤是水解反应 |
B.则化合物 的分子式是 的分子式是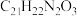 |
| C.化合物D为既有弱酸性又有弱碱性的两性氧化物 |
D.化合物 转化为化合物 转化为化合物 的目的是保护官能团 的目的是保护官能团 |
(3)化合物
 与
与 反应生成化合物
反应生成化合物 和
和(4)三氟甲基磺酸䣷
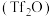 常用于磺酸酯类合成,写出化合物
常用于磺酸酯类合成,写出化合物 与
与 生成Alectinib反应的方程式:
生成Alectinib反应的方程式:(5)写出满足下列条件
 的同分异构体的结构简式
的同分异构体的结构简式①分子中含有1个苯环,2个羟基;
②有5种不同化学环境的氢原子。
(6)像化合物A一样的结构称为吲哚环结构,以下步骤可合成吲哚环结构:
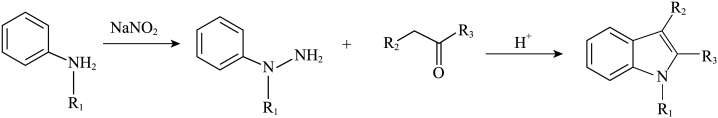
结合以上相关信息,利用硝基苯、1-丙醇设计合成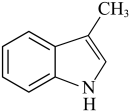 路线(无机试剂任用,合成路线例见本题题干):
路线(无机试剂任用,合成路线例见本题题干):
您最近一年使用:0次
2024-06-17更新
|
149次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高二下学期6月月考试卷 化学试题
2 .  NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL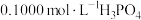 溶液时,
溶液时,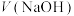 、各含磷元素微粒的
、各含磷元素微粒的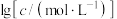 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是
 NaOH溶液滴定20.00mL
NaOH溶液滴定20.00mL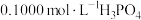 溶液时,
溶液时,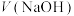 、各含磷元素微粒的
、各含磷元素微粒的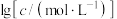 和pH的关系如图。下列说法错误的是
和pH的关系如图。下列说法错误的是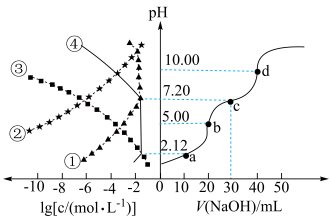
A. 的 的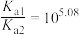 |
| B.水的电离程度:d>c>b>a |
C.③为 的 的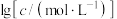 与pH的关系 与pH的关系 |
D.c点时,溶液中存在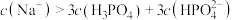 |
您最近一年使用:0次
2024-06-08更新
|
186次组卷
|
4卷引用:辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷
名校
3 . Ⅰ、CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①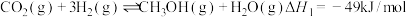
②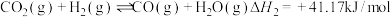
③
(1)③___________ (填“高温自发”“低温自发”或“任何温度下都自发”),该反应中活化能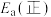
___________ 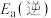 。(填“>”或“<”)
。(填“>”或“<”)
(2)反应①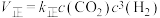 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
___________  。升高温度,
。升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
(3)一定压强下,往某密闭容器中按投料比 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ 。
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大
C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[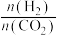 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=___________  (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
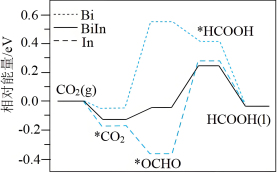
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是___________ 。
①
②
③

(1)③
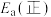
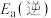 。(填“>”或“<”)
。(填“>”或“<”)(2)反应①
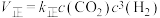 ,
, ,(
,( 、
、 只是温度的函数)。若该温度下的平衡常数K=10,则
只是温度的函数)。若该温度下的平衡常数K=10,则
 。升高温度,
。升高温度, 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。(3)一定压强下,往某密闭容器中按投料比
 充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
充入H2和CO2,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。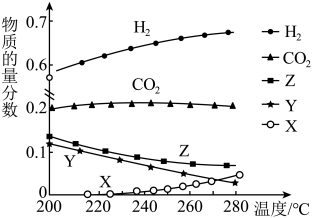
A.恒温恒压时充入氦气,反应①、③的平衡均逆向移动,反应②不移动
B.增大
 的比值,H2的平衡转化率增大
的比值,H2的平衡转化率增大C.图中X、Y分别代表CO、H2O
D.体系中的CO2的物质的量分数随温度变化不大,原因是温度变化,反应①、②的平衡移动方向相反
②在一定温度下,向恒容密闭容器中充入lnolCO2和3molH2,仅发生反应①。实验测得CH3OH的平衡分压与起始投料比[
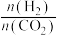 ]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp=
]的关系如图。起始时容器内气体的总压强为8pkPa,则b点时反应的平衡常数Kp= (用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(用含p的表达式表示)。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
(4)我国学者探究了BiIn合金催化剂电化学还原CO2生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态),试从图分析,采用BiIn合金催化剂优于中金属Bi和单金属In催化剂的原因分别是
您最近一年使用:0次
2024-06-06更新
|
345次组卷
|
3卷引用:2024届辽宁省实验中学高三下学期考前模拟训练(五模)化学试卷
2024·黑龙江吉林·模拟预测
解题方法
4 . 乙苯是生产苯乙烯的一种重要工业原料,工业上一般采用苯烷基化法制取乙苯。回答下列问题:
I.目前工业上生产乙苯主要采用乙烷裂解和苯与乙烯催化烷基化法,发生的反应如下:
①C2H6(g)=C2H4(g)+H2(g)______ (填字母),反应③在热力学上能实现的温度范围为_______ 。______ eV,该步基元反应的化学方程式为______ 。
②能提高反应①平衡转化率的适宜条件为_______ (填字母)。
A.升温 B.加压 C.使用高效的催化剂 D.分离出H2
II.工业上还可以在催化条件下用氯乙烷和苯反应制取乙苯,发生的反应如下:
乙苯的选择性=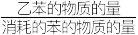 ×100%
×100%
Ka为为物质的量分数平衡常数_______ 。
(4)反应最适宜的时间为_______ (填字母)。
A.10min B.20min C.30min
(5)该温度下,反应④的平衡常数Kx=______ 。
I.目前工业上生产乙苯主要采用乙烷裂解和苯与乙烯催化烷基化法,发生的反应如下:
①C2H6(g)=C2H4(g)+H2(g)
②C2H4(g)+ (g)=
(g)=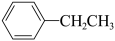 (g)
(g)
③C2H6(g)+ (g)=
(g)= (g)+H2(g)
(g)+H2(g)


②能提高反应①平衡转化率的适宜条件为
A.升温 B.加压 C.使用高效的催化剂 D.分离出H2
II.工业上还可以在催化条件下用氯乙烷和苯反应制取乙苯,发生的反应如下:
④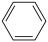 (g)+CH3CH2Cl(g)=
(g)+CH3CH2Cl(g)= (g)+HCl(g)
(g)+HCl(g)
⑤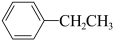 (g)+CH3CH2Cl(g)=
(g)+CH3CH2Cl(g)=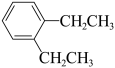 (g)+HCl(g)
(g)+HCl(g)
乙苯的选择性=
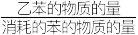 ×100%
×100%Ka为为物质的量分数平衡常数

(4)反应最适宜的时间为
A.10min B.20min C.30min
(5)该温度下,反应④的平衡常数Kx=
您最近一年使用:0次
5 . 已知SrF2为难溶于水、可溶于酸的盐。常温下,向SrF2浊液中滴加稀盐酸,溶液中-lgc(X)(X为Sr2+)变化关系如图。下列说法正确的是

A.L1表示-lgc(Sr2+)与lg 的变化关系 的变化关系 |
| B.Ksp(SrF2)的数量级为10-8 |
| C.c点溶液的pH=3.2 |
| D.b点溶液中存在:2c(Sr2+)+c(H+)=c(OH-)+c(F-) |
您最近一年使用:0次
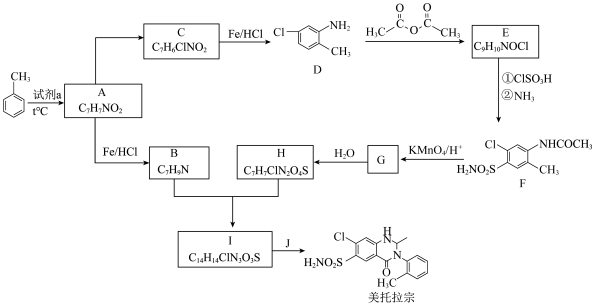
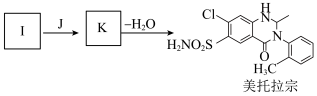
6 . 某研究小组以甲苯为起始原料,按下列路线合成利尿药美托拉宗。
(1)试剂a是_______ 。
(2)C→D的反应类型是_______ 。
(3)E分子中的官能团有_______ 。
(4)属于芳香族化合物的B的同分异构体有_______ 个(提示:不包括B)。
(5)写出 的化学方程式
的化学方程式_______ 。
(6)从D→H的流程看,D→E的主要目的是_______ 。
(7)有人认为由I合成美托拉宗的过程如下:_______ ,K的结构简式_______ 。
已知:ⅰ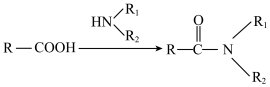 。
。
ⅱ.
(1)试剂a是
(2)C→D的反应类型是
(3)E分子中的官能团有
(4)属于芳香族化合物的B的同分异构体有
(5)写出
 的化学方程式
的化学方程式(6)从D→H的流程看,D→E的主要目的是
(7)有人认为由I合成美托拉宗的过程如下:
您最近一年使用:0次
名校
7 . 将一定量的锌、镁合金与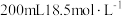 浓硫酸充分反应后,固体完全溶解,同时生成气体
浓硫酸充分反应后,固体完全溶解,同时生成气体 (生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到
(生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到 ,测得稀释后溶液中的
,测得稀释后溶液中的 浓度为
浓度为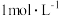 。向反应后的溶液中加入
。向反应后的溶液中加入 溶液
溶液 时,所得沉淀质量最大,其质量为
时,所得沉淀质量最大,其质量为 。下列叙述中错误的是
。下列叙述中错误的是
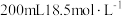 浓硫酸充分反应后,固体完全溶解,同时生成气体
浓硫酸充分反应后,固体完全溶解,同时生成气体 (生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到
(生成气体全部逸出,测定条件为标准状况)。将反应后的溶液稀释到 ,测得稀释后溶液中的
,测得稀释后溶液中的 浓度为
浓度为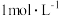 。向反应后的溶液中加入
。向反应后的溶液中加入 溶液
溶液 时,所得沉淀质量最大,其质量为
时,所得沉淀质量最大,其质量为 。下列叙述中错误的是
。下列叙述中错误的是A.气体A中 和 和 的体积比为 的体积比为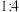 | B.该合金中锌、镁的物质的量之比为 |
C.该实验所有 的浓度是 的浓度是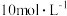 | D.沉淀质量最大时,溶液中所含溶质的质量为 |
您最近一年使用:0次
8 . 常温下,向 饱和溶液[有足量
饱和溶液[有足量 固体]中滴加氨水,发生反应:
固体]中滴加氨水,发生反应: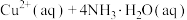

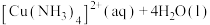 ,溶液中
,溶液中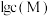 与
与 的关系如图所示,其中
的关系如图所示,其中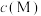 表示
表示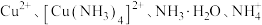 的浓度,单位为
的浓度,单位为 。下列说法正确的是
。下列说法正确的是
 饱和溶液[有足量
饱和溶液[有足量 固体]中滴加氨水,发生反应:
固体]中滴加氨水,发生反应: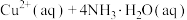

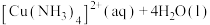 ,溶液中
,溶液中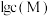 与
与 的关系如图所示,其中
的关系如图所示,其中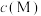 表示
表示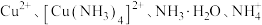 的浓度,单位为
的浓度,单位为 。下列说法正确的是
。下列说法正确的是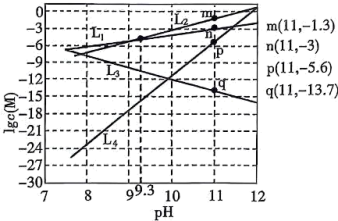
A. 表示溶液中 表示溶液中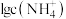 与 与 的关系 的关系 |
B. 的溶度积常数 的溶度积常数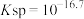 |
C. 时,溶液中: 时,溶液中: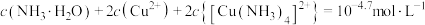 |
D.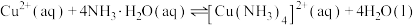 的平衡常数 的平衡常数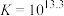 |
您最近一年使用:0次
解题方法
9 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇: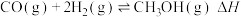
已知:① ;
;
②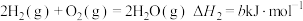 ;
;
③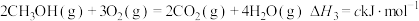
上述反应中的
___________  。
。
(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇: ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢: ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。___________ 下(高温、低温、任意温度)自发进行;图示历程包括___________ 个基元反应;其中决速反应是反应___________ (填序号),写出该步反应式:___________ 。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
① (主反应);
(主反应);
② (主反应);
(主反应);
③ (副反应)。
(副反应)。
一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是___________ ;采用水分子膜分离技术的容器是___________ (填“甲”或“乙”)。 为
为___________  。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
(1)工业上利用合成气合成甲醇:
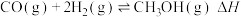
已知:①
 ;
;②
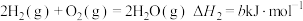 ;
;③
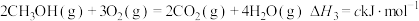
上述反应中的

 。
。(2)一定温度下,在恒容密闭容器中充入1molCO和1molH2,在固体催化剂作用下合成甲醇:
 ,下列叙述错误的是___________(填字母)。
,下列叙述错误的是___________(填字母)。| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡不移动 |
| C.平衡后再充入0.1molCO和0.1molH2,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:
 ,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图a所示(吸附在催化剂表面的物种用“*”表示)。
(4)工业上,可以采用CO2催化还原制备CH3OH、CH3CH2OH.发生反应如下:
①
 (主反应);
(主反应);②
 (主反应);
(主反应);③
 (副反应)。
(副反应)。一定温度下,在甲、乙体积相同的反应容器中分别充入1molCO2和3molH2,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得CO2平衡转化率与压强关系如图b所示。其他条件相同,增大压强,CO2平衡转化率增大,其原因是
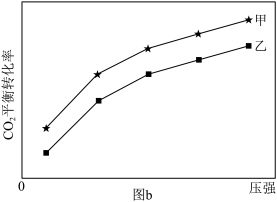
 为
为 。(写出数字表达式即可,分压=总压×物质的量分数)
。(写出数字表达式即可,分压=总压×物质的量分数)
您最近一年使用:0次
10 . 硼化镁晶体的理想模型中,镁原子和硼原子分层排布,彼此分层间隔。硼原子(黑球,半径为a)和镁原子(白球,半径为b)在平面上的投影如图1.下列说法正确的是
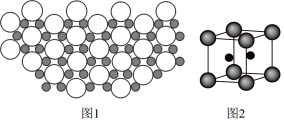
A.晶胞边长为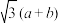 | B.镁原子的价电子排布为 |
C.该晶体的化学式为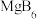 | D.在硼化镁晶体中,硼原子的配位数为3 |
您最近一年使用:0次
2024-04-05更新
|
184次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高二下学期6月月考试卷 化学试题



