名校
解题方法
1 . 下列物质中,不能 由单质直接化合生成的是
A. | B. | C. | D. |
您最近一年使用:0次
2024-01-01更新
|
201次组卷
|
44卷引用:湖北省部分市州2021-2022学年高一上学期期末联合调研考试化学试题
湖北省部分市州2021-2022学年高一上学期期末联合调研考试化学试题2014-2015学年广东省惠州市高一下学期期末考试化学文科试卷浙江省嘉兴市2020-2021学年高一上学期期末测试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高一上学期期末考试化学(文)试题新疆吐鲁番市2021-2022学年高一上学期期末考试化学试题湖南省长沙市长郡中学2020-2021学年高一上学期期末化学试题广东省惠州市2022-2023学年高一上学期期末质量检测化学试题 广东省深圳市福田区福田中学2023-2024学年高一上学期期末考试化学试卷山东省沂水县第四中学2020~2021学年高一上学期阶段检测化学试题北京首都师范大学第二附属中学2020-2021学年高一上学期期中考试化学(A)试题(已下线)【浙江新东方】双师(5)(已下线)【浙江新东方】双师(27)(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP402】【化学】(已下线)【浙江新东方】65.北京市昌平区新学道临川学校2020-2021学年高一上学期12月月考化学试题(京津班)(已下线)【浙江新东方】绍兴qw93浙江省浙南名校联盟2020-2021学年高一下学期返校联考(3月)化学试题(已下线)【浙江新东方】高中化学20210323-002化学试题广西贺州市平桂区平桂高级中学2020-2021学年高一下学期第一次月考化学(文)试题(已下线)【浙江新东方】在线化学60高一下(已下线)【浙江新东方】在线化学52高一上湖南省怀化市第五中学2019-2020学年高一下学期期中考试化学试题河北师范大学附属中学2021-2022学年高一上学期期中考试化学试题人教2019版必修第一册第二章 海中的重要元素——钠和氯复习与提高安徽省马鞍山第二中学2021-2022学年高一上学期期中考试化学试题 黑龙江省鸡东县第二中学2021-2022学年高一上学期期中考试(B班)化学试题浙江省湖州市安吉县高级中学等2021-2022学年高一下学期返校联考化学试题广东省深圳市盐田高级中学2021-2022学年高一下学期期中考试化学试题黑龙江省密山市第四中学2021-2022学年高一上学期期中考试化学试题北京市顺义区杨镇一中2022-2023学年高一上学期期中考试化学试题四川省广安市第二中学校2022-2023学年高一上学期11月期中考试化学试题四川省遂宁中学校2022-2023学年高一上学期期中考试化学试题北京市北京师范大学第二附属中学2022-2023学年高一上学期12月月考化学试题陕西省西安市阎良区关山中学2022-2023学年高一上学期第三次质量检测化学试题广西桂林市第十九中学2021-2022学年高一上学期期中质量检测化学试题北京市第八中学2023-2024学年高一上学期11月期中考试化学试题河北省石家庄市第二中学西校区2023-2024学年高一上学期12月月考化学试题北京市第六十六中学2023-2024学年高一上学期期中考试化学试题北京市回民学校2023-2024学年高一上学期期中考试化学试题广东省江门市新会第一中学2023-2024学年高一上学期期中考试化学试题河南省安阳市龙安高级中学2023-2024学年高一上学期期中考试化学试卷河南省商丘市柘城县德盛高级中学2023-2024学年高一上学期11月月考化学试题新疆喀什地区巴楚县第一中学2023-2024学年高一上学期12月月考化学试题广东省惠州一中实验学校2023-2024学年高一上学期期中考试化学试题
名校
解题方法
2 . Ⅰ.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为___________ 。
(2)在该条件下,反应前后容器的体积之比为___________ 。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)___________ 0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量___________ Q kJ(填 “大于”、“小于”或“等于”)。
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
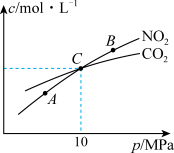
(4)A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填 “﹥”、“<”或“﹦”)。
(5)A、B、C三点中NO2的转化率最高的是___________ (填“A”或“B”或“C”)点。
(6)计算C点时该反应的压强平衡常数Kp(C)=___________ (Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:
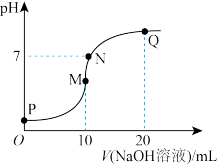
(7)M、Q两点中,水的电离程度较大的是___________ 点。
(8)下列关系中,正确的是___________ 。
a.M点c(Na+)>c(NH )
)
b.N点c(NH )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)
c.Q点c(NH )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
(1)写出该反应的热化学方程式为
(2)在该条件下,反应前后容器的体积之比为
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量
Ⅱ. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
(4)A、B两点的浓度平衡常数关系:Kc(A)
(5)A、B、C三点中NO2的转化率最高的是
(6)计算C点时该反应的压强平衡常数Kp(C)=
Ⅲ.25℃时,向10mL0.1mol•L-1NH4HSO4溶液中逐滴滴入0.1mol•L-1NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示:

(7)M、Q两点中,水的电离程度较大的是
(8)下列关系中,正确的是
a.M点c(Na+)>c(NH
 )
)b.N点c(NH
 )+c(Na+)=2c(SO
)+c(Na+)=2c(SO )
)c.Q点c(NH
 )+c(NH3•H2O)=c(Na+)
)+c(NH3•H2O)=c(Na+)
您最近一年使用:0次
名校
3 . 完成下列填空
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:
①高铁电池的负极材料是___________ 。
②放电时,正极发生___________ (填“氧化”或“还原”)反应。已知负极电极反应式为:Zn − 2e- +2OH- = Zn(OH)2,则正极电极反应式为___________ 。
③放电时,___________ (填“正”或“负”)极附近溶液的碱性增强。
(2)某种燃料电池的工作原理如图所示,a、b均为惰性电极。

①使用时,空气从___________ 口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为___________ 。
(3)氧化还原滴定与中和滴定类似,指的是用已知浓度的氧化剂(还原剂)溶液滴定未知浓度的还原剂(氧化剂)溶液。现有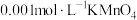 酸性溶液和未知浓度的无色
酸性溶液和未知浓度的无色 溶液,已知二者发生氧化还原反应的离子方程式是
溶液,已知二者发生氧化还原反应的离子方程式是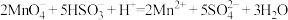 ,通过滴定实验测定
,通过滴定实验测定 溶液的浓度。完成下列问题:
溶液的浓度。完成下列问题:
①该滴定实验___________ (填“需要”或“不需要”)指示剂。
②滴定前平视 酸性溶液的液面,读数为amL,滴定后俯视液面,读数为bmL,则
酸性溶液的液面,读数为amL,滴定后俯视液面,读数为bmL,则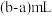 比实际消耗的
比实际消耗的 溶液体积
溶液体积___________ (填“偏大”或“偏小”)。则根据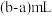 计算得到的待测液浓度比实际浓度
计算得到的待测液浓度比实际浓度___________ (填“偏大”或“偏小”)。
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH,请回答下列问题:①高铁电池的负极材料是
②放电时,正极发生
③放电时,
(2)某种燃料电池的工作原理如图所示,a、b均为惰性电极。

①使用时,空气从
②假设使用的“燃料”是甲醇,a极的电极反应式为
(3)氧化还原滴定与中和滴定类似,指的是用已知浓度的氧化剂(还原剂)溶液滴定未知浓度的还原剂(氧化剂)溶液。现有
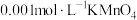 酸性溶液和未知浓度的无色
酸性溶液和未知浓度的无色 溶液,已知二者发生氧化还原反应的离子方程式是
溶液,已知二者发生氧化还原反应的离子方程式是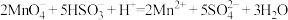 ,通过滴定实验测定
,通过滴定实验测定 溶液的浓度。完成下列问题:
溶液的浓度。完成下列问题:①该滴定实验
②滴定前平视
 酸性溶液的液面,读数为amL,滴定后俯视液面,读数为bmL,则
酸性溶液的液面,读数为amL,滴定后俯视液面,读数为bmL,则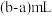 比实际消耗的
比实际消耗的 溶液体积
溶液体积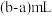 计算得到的待测液浓度比实际浓度
计算得到的待测液浓度比实际浓度
您最近一年使用:0次
名校
解题方法
4 . 钪(Sc)是一种重要且价格昂贵的稀土金属,广泛用于航空航天、超导等领域。从赤泥(含有Sc2O3、Al2O3、Fe2O3、TiO2等)中回收钪,同时生产聚合硫酸铁铝的工艺流程如图所示:
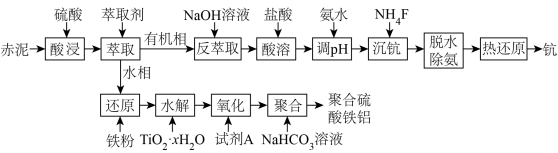
回答下列问题:
(1)写出基态Sc原子的简化电子排布式:___________ 。
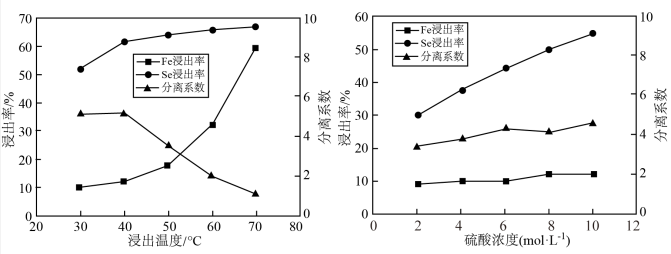
(2)在酸浸赤泥的后续萃取分离过程中,Fe3+与Sc3+会发生共萃而进入有机相,从而使后续分离难度加大,经探究温度、硫酸浓度与铁、钪的浸出率及分离系数(钪的浸出率和铁的浸出率比值)关系如下图所示,则酸浸的最佳浸出温度为___________ ℃,最佳硫酸浓度为___________ mol/L。
(3)该工艺条件下,溶液中有关离子开始沉淀和完全沉淀的pH值如下表所示:
①已知TiO2和硫酸反应生成水溶性的TiO2+,则流程中TiO2+水解生成TiO2·xH2O的离子方程式为___________ 。
②该工艺流程中引入“氧化”这个步骤的原因是___________ 。
(4)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,“沉钪”时,溶液的pH=3,c(F-)=10-4 mol/L,则此时钪的存在形式为___________ (填化学式)。

(5)“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,该步骤的离子方程式为___________ 。

回答下列问题:
(1)写出基态Sc原子的简化电子排布式:
(2)在酸浸赤泥的后续萃取分离过程中,Fe3+与Sc3+会发生共萃而进入有机相,从而使后续分离难度加大,经探究温度、硫酸浓度与铁、钪的浸出率及分离系数(钪的浸出率和铁的浸出率比值)关系如下图所示,则酸浸的最佳浸出温度为

(3)该工艺条件下,溶液中有关离子开始沉淀和完全沉淀的pH值如下表所示:
| 离子 | Fe2+ | Fe3+ | Al3+ | TiO2+ |
| 开始沉淀的pH | 7.0 | 1.9 | 3.0 | 0.3 |
| 完全沉淀的pH | 9.0 | 3.2 | 4.7 | 2.0 |
②该工艺流程中引入“氧化”这个步骤的原因是
(4)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,“沉钪”时,溶液的pH=3,c(F-)=10-4 mol/L,则此时钪的存在形式为

(5)“聚合”生成聚合硫酸铁铝AlFe(OH)2(SO4)2时,同时产生气体,该步骤的离子方程式为
您最近一年使用:0次
2023-09-16更新
|
258次组卷
|
2卷引用:湖北省襄阳市第一中学2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
5 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E和D的最高能层数相同,其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E和D的最高能层数相同,其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①C元素基态原子核外有___________ 种运动状态不同的电子,其核外电子的空间运动状态有___________ 种。
②A、B、C三种元素的电负性由大到小的顺序是:___________ 。
③B、C、D、E四种元素的第一电离能由大到小的顺序是:___________ 。
(2)下表是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ (填元素符号)。
(3)F元素位于周期表的___________ 区,该元素的价层电子排布图为___________ 。
 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E和D的最高能层数相同,其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E和D的最高能层数相同,其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用元素符号完成下列空白:
①C元素基态原子核外有
②A、B、C三种元素的电负性由大到小的顺序是:
③B、C、D、E四种元素的第一电离能由大到小的顺序是:
(2)下表是A~F元素中某种元素的部分电离能,由此可判断该元素是
| 元素 | 电离能/( ) ) | ||||
 |  |  |  |  | |
| 某种元素 | 578 | 1817 | 2745 | 11575 | 14830 |
您最近一年使用:0次
2023-09-16更新
|
734次组卷
|
4卷引用:湖北省襄阳市第一中学2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
6 . 研究成果表明,塑料经改造后能像金属一样导电,要使塑料聚合物导电,其内部碳原子之间必须交替地以单键与双键结合(再经掺杂处理)。由上述分析,下列聚合物经掺杂处理后可以制成“导电塑料”的是
A. | B. |
C. | D. |
您最近一年使用:0次
2023-05-10更新
|
148次组卷
|
4卷引用:湖北省襄阳市襄州一中2020-2021学年高一下学期期末考试化学试题
7 . 人体必需的一些元素在周期表中的分布情况如下:

(1)请在上图中画出金属与非金属的分界线_______ 。
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为_______ 。
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为_______ 。
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确的是_______ (填字母)。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

(6)铬是胰岛素不可缺少的辅助成分,但食用不当也会带来很大的危害。六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,可转化为重要产品磁性铁铬氧体(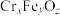 ):先向含
):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分 )并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式:
的离子方程式:_______ 。
②若处理含1mol (不考虑其他含铬微粒)的污水时恰好消耗10mol
(不考虑其他含铬微粒)的污水时恰好消耗10mol ,则当铁铬氧体中
,则当铁铬氧体中 时,铁铬氧体的化学式为
时,铁铬氧体的化学式为_______ 。

(1)请在上图中画出金属与非金属的分界线
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确的是
| A | B | C | D |
| HCl |  |  |  |
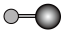 |  | 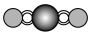 | 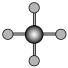 |
| 直线形 | 直线形 | 直线形 | 平面正方形 |

| A.若a、b、c表示碱金属元素,则X表示对应单质的密度 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
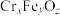 ):先向含
):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分 )并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出
 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式:
的离子方程式:②若处理含1mol
 (不考虑其他含铬微粒)的污水时恰好消耗10mol
(不考虑其他含铬微粒)的污水时恰好消耗10mol ,则当铁铬氧体中
,则当铁铬氧体中 时,铁铬氧体的化学式为
时,铁铬氧体的化学式为
您最近一年使用:0次
解题方法
8 . 某工厂的工业废水中含有大量的 和较多的
和较多的 、
、 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题:
和金属铜。请根据以下流程图,回答下列问题:

(1)A的主要成分是_______ (填化学式)。
(2)试剂Y的名称为_______ 。
(3)取少量溶液B加入试管中,然后滴加过量氢氧化钠溶液,产生的现象是_______ ,此过程中发生的氧化还原反应为_______ (用化学方程式表示)。
(4)查阅资料发现,硫酸亚铁在不同温度下结晶可分别得到 、
、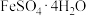 、
、 。其溶解度曲线如下图所示,则操作③应选择的最佳操作是
。其溶解度曲线如下图所示,则操作③应选择的最佳操作是_______ (填字母)。

a.加热蒸发,直至蒸干
b.加热温度至略低于64℃浓缩、冷却至略高于56℃结晶,热水洗涤,干燥
c.加热浓缩得到56℃饱和溶液,冷却结晶,过滤,冷水洗涤,干燥
(5)利用 制备
制备 的方程式为
的方程式为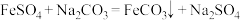 。生成的
。生成的 沉淀需经充分洗涤,洗涤
沉淀需经充分洗涤,洗涤 所用玻璃仪器有:
所用玻璃仪器有:____ 、烧杯、玻璃棒;检验洗净的方法是____ 。
 和较多的
和较多的 、
、 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题:
和金属铜。请根据以下流程图,回答下列问题:
(1)A的主要成分是
(2)试剂Y的名称为
(3)取少量溶液B加入试管中,然后滴加过量氢氧化钠溶液,产生的现象是
(4)查阅资料发现,硫酸亚铁在不同温度下结晶可分别得到
 、
、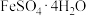 、
、 。其溶解度曲线如下图所示,则操作③应选择的最佳操作是
。其溶解度曲线如下图所示,则操作③应选择的最佳操作是
a.加热蒸发,直至蒸干
b.加热温度至略低于64℃浓缩、冷却至略高于56℃结晶,热水洗涤,干燥
c.加热浓缩得到56℃饱和溶液,冷却结晶,过滤,冷水洗涤,干燥
(5)利用
 制备
制备 的方程式为
的方程式为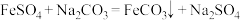 。生成的
。生成的 沉淀需经充分洗涤,洗涤
沉淀需经充分洗涤,洗涤 所用玻璃仪器有:
所用玻璃仪器有:
您最近一年使用:0次
解题方法
9 . 同学甲用下述装置组装了一套可以证明实验室制取 的过程中有HCl和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:
的过程中有HCl和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:

(1)①按气流方向填出接口顺序:a→_______ →f。
②A中反应的离子方程式是_______ 。
③B中盛放试剂的名称是_______ ;C中盛放的是 溶液,其作用是
溶液,其作用是_______ ;
④同学乙认为该实验有缺陷,不能保证最终通入 溶液中的气体只有一种,提出无需多加装置,只需将原来D中的
溶液中的气体只有一种,提出无需多加装置,只需将原来D中的 溶液换成其他溶液。你认为可换成
溶液换成其他溶液。你认为可换成_______ ,如果观察到_______ 的现象,则证明制 时有HCl挥发出来。
时有HCl挥发出来。
(2)A装置中所用溶液浓度为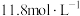 ,现欲用其配制80mL
,现欲用其配制80mL 的稀溶液,则需用量筒量取
的稀溶液,则需用量筒量取_______ mL浓溶液;若所配制的稀溶液浓度偏小,则下列可能的原因分析中正确的是_______ (填字母)。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
 的过程中有HCl和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:
的过程中有HCl和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:
(1)①按气流方向填出接口顺序:a→
②A中反应的离子方程式是
③B中盛放试剂的名称是
 溶液,其作用是
溶液,其作用是④同学乙认为该实验有缺陷,不能保证最终通入
 溶液中的气体只有一种,提出无需多加装置,只需将原来D中的
溶液中的气体只有一种,提出无需多加装置,只需将原来D中的 溶液换成其他溶液。你认为可换成
溶液换成其他溶液。你认为可换成 时有HCl挥发出来。
时有HCl挥发出来。(2)A装置中所用溶液浓度为
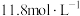 ,现欲用其配制80mL
,现欲用其配制80mL 的稀溶液,则需用量筒量取
的稀溶液,则需用量筒量取A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
您最近一年使用:0次
解题方法
10 . 牙膏是常见的日用化学品。磨擦剂是牙膏的主体原料,在牙膏中最重要的作用就是去除牙垢,减轻牙结石。
I.完成下列问题。
(1)下表列出了牙膏中常见的摩擦剂,请写出它们所属的物质类别(填“酸”“碱”“盐”或“氧化物”)。
(2)根据用途推测 在水中的溶解性:
在水中的溶解性:_______ (填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂氢氧化镁可以用菱镁矿(主要成分为 、
、 、
、 、
、 )来制备,按要求回答下列问题。
)来制备,按要求回答下列问题。_______ (填字母)。
A.菱镁矿 B. C.
C. D.
D. E.硫酸钙 F.氨
E.硫酸钙 F.氨
②方案中可循环利用的物质有_______ (填化学式)。
II.某牙膏摩擦剂的成分为 ,为测定其中
,为测定其中 的含量的操作如下(设该牙膏中的其他成分不与盐酸或者氢氧化钠反应):
的含量的操作如下(设该牙膏中的其他成分不与盐酸或者氢氧化钠反应):
①配制 稀盐酸和
稀盐酸和 NaOH溶液;
NaOH溶液;
②称取0.60g该牙膏,溶于水并稀释至20.00mL;
③用 NaOH溶液中和过量的稀盐酸,记录所消耗氢氧化钠溶液的体积;
NaOH溶液中和过量的稀盐酸,记录所消耗氢氧化钠溶液的体积;
④加入25.00mL 稀盐酸;
稀盐酸;
(4)正确的操作顺序为①_______ (填标号)。
(5)该测定实验共进行了4次,实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制盐酸应选用的容量瓶规格为_______ 。
(6)某同学4次测定所消耗NaOH溶液的体积如下:
则该牙膏中碳酸钙的质量分数约为_______ (保留三位有效数字)%。
I.完成下列问题。
(1)下表列出了牙膏中常见的摩擦剂,请写出它们所属的物质类别(填“酸”“碱”“盐”或“氧化物”)。
| 摩擦剂成分 | 氢氧化镁 | 碳酸钙 | 二氧化硅 |
| 物质类别 | ① | ② |
 在水中的溶解性:
在水中的溶解性:(3)牙膏中的摩擦剂氢氧化镁可以用菱镁矿(主要成分为
 、
、 、
、 、
、 )来制备,按要求回答下列问题。
)来制备,按要求回答下列问题。
A.菱镁矿 B.
 C.
C. D.
D. E.硫酸钙 F.氨
E.硫酸钙 F.氨②方案中可循环利用的物质有
II.某牙膏摩擦剂的成分为
 ,为测定其中
,为测定其中 的含量的操作如下(设该牙膏中的其他成分不与盐酸或者氢氧化钠反应):
的含量的操作如下(设该牙膏中的其他成分不与盐酸或者氢氧化钠反应):①配制
 稀盐酸和
稀盐酸和 NaOH溶液;
NaOH溶液;②称取0.60g该牙膏,溶于水并稀释至20.00mL;
③用
 NaOH溶液中和过量的稀盐酸,记录所消耗氢氧化钠溶液的体积;
NaOH溶液中和过量的稀盐酸,记录所消耗氢氧化钠溶液的体积;④加入25.00mL
 稀盐酸;
稀盐酸;(4)正确的操作顺序为①
(5)该测定实验共进行了4次,实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制盐酸应选用的容量瓶规格为
(6)某同学4次测定所消耗NaOH溶液的体积如下:
| 实验标号 | 1 | 2 | 3 | 4 |
| V(NaOH)/mL | 10.10 | 9.90 | 10.20 | 9.80 |
您最近一年使用:0次
2023-02-03更新
|
378次组卷
|
2卷引用:湖北省襄阳市普通高中2022-2023学年高一上学期期末教学质量检测统一测试化学试题



