名校
解题方法
1 . 某小组同学探究SO2与新制Cu(OH)2悬浊液反应的实验装置图如下所示:
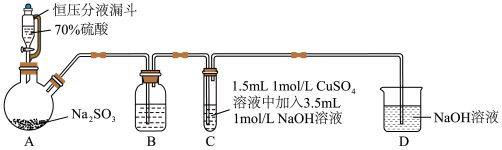
| A.配制70%硫酸溶液需要用到的仪器有烧杯、量筒、玻璃棒、胶头滴管 |
| B.装置B的作用是监控SO2流速,其中试剂可以用饱和NaHSO4溶液 |
| C.反应开始时C中出现砖红色沉淀,氧化剂和还原剂的物质的量之比为2:1 |
| D.反应后向C的溶液中加入稀盐酸酸化后,再滴加BaCl2溶液、有白色沉淀生成,证明反应中SO2作还原剂 |
您最近一年使用:0次
2024-03-16更新
|
442次组卷
|
3卷引用:高二化学下学期期末押题卷02-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(江苏专用)
(已下线)高二化学下学期期末押题卷02-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(江苏专用)2024届甘肃省兰州市高三下学期诊断考试化学试卷湖南省常德市汉寿县第一中学2023-2024学年高一下学期3月月考化学试题
名校
2 . 下列说法不正确 的是
| A.常温下,测定0.1mol·L-1醋酸溶液的pH可证明醋酸是弱电解质 |
| B.相同温度下,与相同浓度、相同体积的盐酸和醋酸溶液恰好中和时消耗NaOH的物质的量相同 |
| C.由反应NaR+CO2(少量)+H2O=HR+NaHCO3可知:Ka1(H2CO3)>Ka(HR)>Ka2(H2CO3) |
| D.等体积pH=2的两种酸分别与足量的铁反应,单位时间内酸性较强的酸与铁反应速率更快 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法不正确 的是
| A.常温下,测定0.1mol·L-1醋酸溶液的pH可证明醋酸是弱电解质 |
| B.等体积pH=2的两种酸分别与足量的铁反应,单位时间内酸性较强的酸与铁反应速率更快 |
| C.由反应NaR+CO2(少量)+H2O=HR+NaHCO3可知:Ka1(H2CO3)>Ka(HR)>Ka2(H2CO3) |
| D.室温下,pH=2的醋酸溶液和pH=12的氢氧化钠溶液等体积混合,混合溶液显酸性 |
您最近一年使用:0次
4 . 一定条件下在容积不变的容器中充入 和
和 发生如下反应:
发生如下反应: ,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得
,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得 与时间的关系如图所示。已知:
与时间的关系如图所示。已知:

ⅰ.起始投料比 均为2:3;
均为2:3;
ⅱ.比表面积:单位质量的物质具有的总面积。
下列说法不正确的是
 和
和 发生如下反应:
发生如下反应: ,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得
,其他条件不变时,分别探究温度和催化剂的比表面积对上述反应的影响。实验测得 与时间的关系如图所示。已知:
与时间的关系如图所示。已知:
ⅰ.起始投料比
 均为2:3;
均为2:3;ⅱ.比表面积:单位质量的物质具有的总面积。
下列说法不正确的是
| A.Ⅰ、Ⅱ曲线证明催化剂比表面积对上述反应有影响 |
B.Ⅱ中 的平衡转化率为50% 的平衡转化率为50% |
C.在Ⅲ的条件下,该反应的平衡常数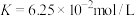 |
D. min,Ⅲ中平均反应速率 min,Ⅲ中平均反应速率 |
您最近一年使用:0次
名校
解题方法
5 . 完成下列问题
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
(3)关于新制饱和氯水,下列叙述正确的是_______
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2O
ii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是___________
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)_________
③配平反应i的化学方程式_________ 。
④标出反应ii中电子转移的方向和数目_________ 。
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾___________ 吨。
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
| A.钝化 | B.漂白 | C.固氮 | D.燃烧 |
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
| A.工业合成氨的过程是固氮的过程 |
| B.自然界中,氨是动物体特别是蛋白质腐败后的产物 |
| C.为防止粮食、罐头、水果等食品腐烂,常用氮气作保护气 |
| D.在雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收 |
(3)关于新制饱和氯水,下列叙述正确的是_______
| A.加入适量NaOH,溶液黄绿色褪去,说明氯水中含有Cl2分子 |
| B.加入少量NaCl粉末,溶液漂白性增强 |
| C.加入少量的碳酸钠粉末,pH增大,溶液漂白性一定减弱 |
| D.光照过程中,有气泡冒出,溶液的导电性减弱 |
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
| A.向含足量NaOH的Na2S溶液中加入Na2SO3 |
| B.常温下,向试管中加入1mL浓硫酸和一小块铜片 |
| C.将0.5g硫粉和1.0g铁粉均匀混合,在石棉网上用红热玻璃棒触及粉末一端至粉末红热 |
| D.向Na2SO3固体中加入70%的浓硫酸制备SO2 |
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

| A.O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O |
| B.中间体HOOBr和HOBr中Br的化合价相同 |
| C.发生步骤②时,断裂的化学键既有极性键又有非极性键 |
| D.步骤③中,每生成1molBr2转移2mol电子 |
(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3
 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2Oii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)
③配平反应i的化学方程式
④标出反应ii中电子转移的方向和数目
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾
您最近一年使用:0次
6 . 下列说法能证明HF是弱电解质的是
| A.HF溶于水能导电 |
| B.常温下测得0.l mol·L-1 HF溶液的pH=2 |
| C.与等浓度NaOH溶液刚好完全反应,两者消耗的体积之比为1:1 |
| D.往HF溶液中滴加石蕊,溶液显红色 |
您最近一年使用:0次
名校
7 . 回答下列问题。
(1)下列物质的水溶液因水解而呈碱性的是___________。
(2)0.1mol•L﹣1的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO﹣+H+,要使溶液中 值增大,可以采取的措施是___________。
值增大,可以采取的措施是___________。
①加少量烧碱固体②升高温度③加少量冰醋酸④加水
(3)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是___________。
(4)溶液的pH与水的电离密切相关,以下说法一定正确的是___________。
(5)室温下,在10mL浓度均为0.1mol•L﹣1的醋酸和盐酸混合液中,滴加0.1mol•L﹣1的NaOH溶液VmL,则下列关系正确的是___________。
(6)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
①相同条件下,0.1mol•L﹣1NH4Al(SO4)2溶液中的c( )
)___________ (填“等于”“大于”或“小于”)0.1mol•L﹣1NH4HSO4溶液中的c( )。
)。
②浓度均为0.1mol•L﹣1的几种电解质溶液的pH随温度变化的曲线如图1所示:
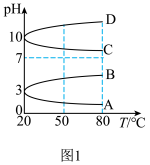
i.其中符合0.1mol•L﹣1NH4Al(SO4)2溶液的pH随温度变化的曲线是___________ ,导致pH随温度变化的原因是___________ 。
ii.20℃时,0.1mol•L﹣1NH4Al(SO4)2溶液中2c( )﹣c(
)﹣c( )﹣3c(A13+)=
)﹣3c(A13+)=___________ mol•L﹣1(填精确数值表达式)。
③室温时,向100mL0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,溶液pH与NaOH溶液体积的关系如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________ 点;在b点,溶液中各离子浓度由大到小的排列顺序是___________ 。

④难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(A13+)=0.1mol•L﹣1,使Al3+开始沉淀的pH为___________ 。[25℃时,Al(OH)3的Ksp=1×10﹣34]
⑤向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl﹣)升高的原因:___________ 。
(1)下列物质的水溶液因水解而呈碱性的是___________。
| A.Na2S | B.NH3 | C.KOH | D.NH4Cl |
(2)0.1mol•L﹣1的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO﹣+H+,要使溶液中
 值增大,可以采取的措施是___________。
值增大,可以采取的措施是___________。①加少量烧碱固体②升高温度③加少量冰醋酸④加水
| A.②③ | B.②④ | C.①④ | D.①③ |
(3)氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是___________。
| A.1mol•L﹣1氢氰酸(HCN)溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10mL1mol•L﹣1HCN恰好与10mL1mol•L﹣1NaOH溶液完全反应 |
| D.HCN溶液的导电性比强酸溶液的弱 |
(4)溶液的pH与水的电离密切相关,以下说法一定正确的是___________。
| A.90℃的纯水pH=7 |
| B.将醋酸滴入氢氧化钠溶液,促进了水的电离 |
| C.电解质溶液中都存在水的电离平衡 |
| D.室温下pH相同的盐酸和明矾溶液,水的电离程度相同 |
(5)室温下,在10mL浓度均为0.1mol•L﹣1的醋酸和盐酸混合液中,滴加0.1mol•L﹣1的NaOH溶液VmL,则下列关系正确的是___________。
| A.V=0时:c(H+)>c(Cl﹣)=c(CH3COOH) |
| B.V=10mL时:c(OH﹣)+c(CH3COO﹣)=c(H+) |
| C.V=20mL时:c(Na+)<c(CH3COO﹣)+c(Cl﹣) |
| D.加入NaOH溶液至pH=7时,V>20mL |
(6)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
①相同条件下,0.1mol•L﹣1NH4Al(SO4)2溶液中的c(
 )
) )。
)。②浓度均为0.1mol•L﹣1的几种电解质溶液的pH随温度变化的曲线如图1所示:

i.其中符合0.1mol•L﹣1NH4Al(SO4)2溶液的pH随温度变化的曲线是
ii.20℃时,0.1mol•L﹣1NH4Al(SO4)2溶液中2c(
 )﹣c(
)﹣c( )﹣3c(A13+)=
)﹣3c(A13+)=③室温时,向100mL0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,溶液pH与NaOH溶液体积的关系如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

④难溶电解质在水溶液中存在溶解平衡。25℃,某NH4Al(SO4)2溶液里c(A13+)=0.1mol•L﹣1,使Al3+开始沉淀的pH为
⑤向AgNO3溶液中加入过量NaCl溶液,会有白色沉淀产生,接着加入NaI溶液,发现白色沉淀变为黄色,请用平衡移动原理来解释颜色变化与溶液中c(Cl﹣)升高的原因:
您最近一年使用:0次
名校
解题方法
8 . 某化学小组欲探究反应“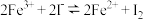 ”为可逆反应,做了如下实验:
”为可逆反应,做了如下实验:

已知:
现象为:实验ii中产生了黄色沉淀;实验iii中溶液变蓝;实验iv中溶液不变蓝,下列说法中不正确 的是
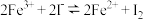 ”为可逆反应,做了如下实验:
”为可逆反应,做了如下实验:
已知:

现象为:实验ii中产生了黄色沉淀;实验iii中溶液变蓝;实验iv中溶液不变蓝,下列说法中
A.实验ii中产生黄色沉淀的离子方程式为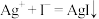 |
B.实验iii加淀粉溶液变蓝,证明棕黄色溶液中有 生成 生成 |
C.设计实验iv的目的是为了排除空气中氧气氧化 的可能 的可能 |
D.通过上述实验可以证明“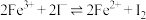 ”为可逆反应 ”为可逆反应 |
您最近一年使用:0次
2024-01-20更新
|
148次组卷
|
3卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
名校
9 . 下列说法正确且一定能证明 是弱电解质的是
是弱电解质的是
 是弱电解质的是
是弱电解质的是A.25℃时,用 试纸测0.01 试纸测0.01  溶液的 溶液的 为4 为4 |
B. 水溶液中含有 水溶液中含有 分子和 分子和 、 、 |
C.10 0.01 0.01  溶液恰好与10 溶液恰好与10 0.01 0.01  溶液完全反应 溶液完全反应 |
D.用 溶液做导电性实验,灯泡很暗 溶液做导电性实验,灯泡很暗 |
您最近一年使用:0次
名校
解题方法
10 . 某实验小组用如下实验测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
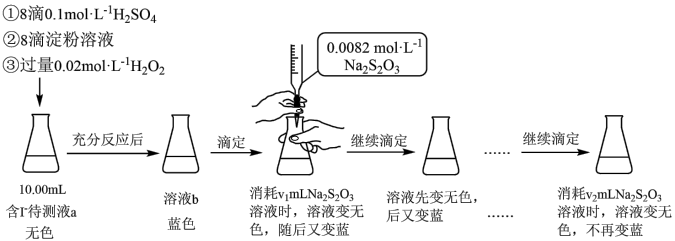
已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法不正确 的是:

已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法
| A.溶液b为蓝色是因为发生了反应:H2O2+2I-+2H+=I2+2H2O |
| B.该实验可证明蓝色恢复与空气无关 |
| C.溶液反复由无色变蓝的原因可能是H2O2氧化I-的反应速率比Na2S2O3还原I2的反应速率快 |
| D.上述实验不能准确测定待测液中的碘含量,应补充实验步骤:滴定前向溶液b中加少量MnO2,反应至不再产生气泡,过滤,对滤液进行滴定 |
您最近一年使用:0次
2023-11-06更新
|
1274次组卷
|
10卷引用:河北省保定市唐县第一中学2023-2024学年高二上学期1月期末化学试题
河北省保定市唐县第一中学2023-2024学年高二上学期1月期末化学试题内蒙古赤峰二中2023-2024学年高二上学期第二次月考化学试题黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题河南省信阳高级中学2023-2024学年高二上学期元旦测试化学试题北京市丰台区2023-2024学年高三上学期期中练习化学试题(已下线)选择题21-23(已下线)选择题11-14湖北省武昌实验中学2023-2024学年高三上学期12月月考化学试题北京实验学校2023-2024学年高三上学期12月化学学科竞赛试题



