2024高三下·全国·专题练习
1 . 已知Ka(Kb)、Kw、Kh、Ksp分别表示弱酸的电离平衡常数(弱碱的电离平衡常数)、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq) Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=___________ ,并据此推断Mg(OH)2___________ (填“能”或“不能”)溶解于醋酸(已知1.83≈5.8)。
(1)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)
 Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=
您最近一年使用:0次
2 . 回答下列问题。
(1)锅炉水垢的主要成分是碳酸钙和硫酸钙,清洗时,经常先加入饱和的碳酸钠溶液浸泡,最后用酸溶解。结合沉淀溶解平衡原理解释清洗硫酸钙的过程___________ 。
(2)当器壁上附有 很难除去时,也常采用沉淀转化的方法。已知某温度下
很难除去时,也常采用沉淀转化的方法。已知某温度下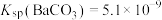 ,
,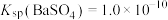 。在该温度下要使
。在该温度下要使 转化成
转化成 ,
, 溶液的浓度应大于
溶液的浓度应大于___________  。
。
(1)锅炉水垢的主要成分是碳酸钙和硫酸钙,清洗时,经常先加入饱和的碳酸钠溶液浸泡,最后用酸溶解。结合沉淀溶解平衡原理解释清洗硫酸钙的过程
(2)当器壁上附有
 很难除去时,也常采用沉淀转化的方法。已知某温度下
很难除去时,也常采用沉淀转化的方法。已知某温度下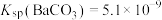 ,
,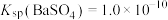 。在该温度下要使
。在该温度下要使 转化成
转化成 ,
, 溶液的浓度应大于
溶液的浓度应大于 。
。
您最近一年使用:0次
3 .  元素是自然界中以及生活中常见的元素,请回答下列有关问题。
元素是自然界中以及生活中常见的元素,请回答下列有关问题。
(1)已知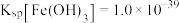 ,若使
,若使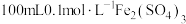 溶液中的
溶液中的 完全沉淀(
完全沉淀( ),应调节
),应调节 最小为
最小为___________ 。
 元素是自然界中以及生活中常见的元素,请回答下列有关问题。
元素是自然界中以及生活中常见的元素,请回答下列有关问题。(1)已知
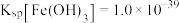 ,若使
,若使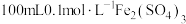 溶液中的
溶液中的 完全沉淀(
完全沉淀( ),应调节
),应调节 最小为
最小为
您最近一年使用:0次
2024高三下·全国·专题练习
4 . 硫及其化合物在日常生活、工业生产中都非常普遍。
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++ ,
,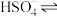 H++
H++ 。
。
①25℃时,Na2SO4溶液的pH___________ (填“>”“<”或“=”)7。
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数___________ (写出计算过程,结果保留三位有效数字)。
(2)液态水中,水存在自偶电离:H2O+H2O H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为___________ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是___________ 。若保持温度不变,关于该所得溶液,下列说法正确的是___________ 。
A.加入少量冰醋酸,c( )与c(
)与c( )均减小
)均减小
B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c( )与c(
)与c( )的比值减小
)的比值减小
D.加入少量Na2SO4固体,c(Ac-)减小
(1)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:H2SO4=H++
 ,
,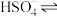 H++
H++ 。
。①25℃时,Na2SO4溶液的pH
②0.100 mol∙L−1的稀硫酸中,c(H+)=0.109 mol∙L−1,求硫酸第二步电离的电离常数
(2)液态水中,水存在自偶电离:H2O+H2O
 H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。
H3O++OH-。平常书写的H+,实际上是纯水或水溶液中H3O+的缩写。如HCl在水中电离,完整写法是HCl+H2O=H3O++Cl-。①液态的醋酸(用HAc表示)中,同样存在HAc的自偶电离,其方程式可表示为
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量H2SO4溶于冰醋酸中,第一步电离的完整写法是
A.加入少量冰醋酸,c(
 )与c(
)与c( )均减小
)均减小B.加入少量H2SO4,H2SO4的电离程度增大
C.加入少量NaAc固体。c(
 )与c(
)与c( )的比值减小
)的比值减小D.加入少量Na2SO4固体,c(Ac-)减小
您最近一年使用:0次
2024高三下·全国·专题练习
5 . 资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)将 通入
通入 溶液时,得到一组
溶液时,得到一组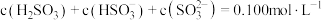 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。 ,溶液中
,溶液中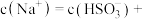
___________ ,此时溶液中
___________  。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)
(2)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数( )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数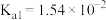 ,
,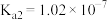 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________
(1)将
 通入
通入 溶液时,得到一组
溶液时,得到一组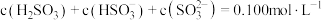 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。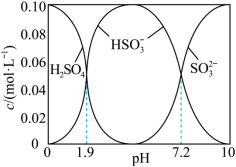
 ,溶液中
,溶液中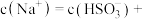

 。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)(2)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(
 )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数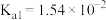 ,
,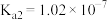 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
6 . 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:
①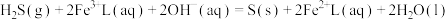

②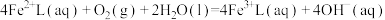
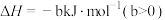
回答下列问题:
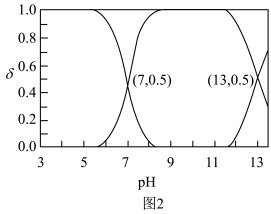
(1) 的电离方程式为
的电离方程式为___________ 。25℃时, 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
___________ ,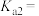
___________ 。再生反应在常温下进行,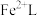 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的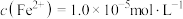 ,
,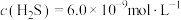 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于___________ (已知25℃时,FeS的 为
为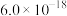 )。
)。
 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:①
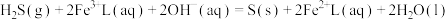

②
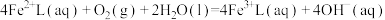
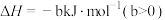
回答下列问题:
(1)
 的电离方程式为
的电离方程式为 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
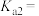
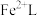 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的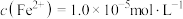 ,
,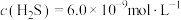 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于 为
为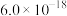 )。
)。
您最近一年使用:0次
2024高三下·全国·专题练习
7 . 推动 的综合利用、实现碳中和是党中央作出的重大战略决策。
的综合利用、实现碳中和是党中央作出的重大战略决策。
(1) 一定条件可转化为
一定条件可转化为 ,
,
②恒压下,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,分子筛膜能选择性分离出 。P点甲醇产率高于T点的原因为
。P点甲醇产率高于T点的原因为___________ 。 与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对
与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对 转化率的影响如图所示,
转化率的影响如图所示, 时
时 转化率低于
转化率低于 和
和 的原因可能为
的原因可能为___________ 。
 的综合利用、实现碳中和是党中央作出的重大战略决策。
的综合利用、实现碳中和是党中央作出的重大战略决策。(1)
 一定条件可转化为
一定条件可转化为 ,
,
②恒压下,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,分子筛膜能选择性分离出
 。P点甲醇产率高于T点的原因为
。P点甲醇产率高于T点的原因为
 与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对
与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对 转化率的影响如图所示,
转化率的影响如图所示, 时
时 转化率低于
转化率低于 和
和 的原因可能为
的原因可能为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
8 . 二氧化碳催化加氢制甲醇有利于减少温室气体排放。涉及的主要反应如下:
Ⅰ.

Ⅱ.
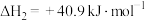
Ⅲ.
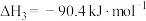
(1)不同压强下,按照 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
 的平衡转化率
的平衡转化率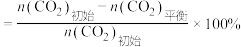
 的平衡产率
的平衡产率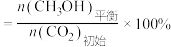
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图___________ (填“甲”或“乙”),压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是___________ 。
Ⅰ.


Ⅱ.

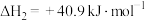
Ⅲ.

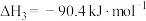
(1)不同压强下,按照
 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。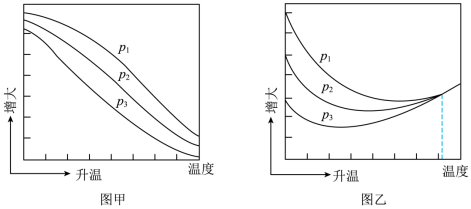
 的平衡转化率
的平衡转化率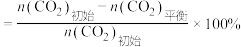
 的平衡产率
的平衡产率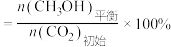
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
9 . 我国氢能源汽车已经开始销售,氢能源的热值高、无污染,使其成为理想的能源,工业上量产化制氢原理是:CH4(g)+2H2O(g)  CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。
(1)相关化学键键能数据如下表所示。
则a=___________ 。
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
___________ ;无分子筛膜时,升高温度,反应速率 将
将___________ (选填“增大”、“减小” 或“不变”)。
②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是___________ 。
 CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。(1)相关化学键键能数据如下表所示。
| 化学键 | H-H | C=O | H-O | C-H |
 | 435 | 745 | 463 | 415 |
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和
 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。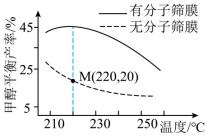

 将
将②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是
您最近一年使用:0次
2024高三下·全国·专题练习
10 . 完成下列问题
(1)已知:
反应I:N2(g)+O2(g) 2NO(g) ΔH1=akJ/mol
2NO(g) ΔH1=akJ/mol
反应Ⅱ;2NO(g)+O2(g) 2NO2(g) ΔH2=bkJ/mol
2NO2(g) ΔH2=bkJ/mol
反应Ⅲ:2N2O(g) 2N2(g)+O2(g) ΔH3=ckJ/mol
2N2(g)+O2(g) ΔH3=ckJ/mol
反应Ⅳ:N2O(g)+NO2(g) 3NO(g) ΔH=
3NO(g) ΔH=___________ kJ/mol
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体。在密闭容器中充入反应物,测得平衡时NO的体积分数与温度、压强的关系如图。 N2(g)+2CO2(g) ΔH<0,则T1
N2(g)+2CO2(g) ΔH<0,则T1___________ T2(填“>”“=”或“<”)。
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有___________ (答两点即可)。
③在D点,对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的___________ 点。
(3)在催化剂作用下,利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:___________ ;在1050K时,CO2的体积分数为___________ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1100K、1.1×106Pa时,该反应的化学平衡常数Kp=___________ [已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(1)已知:
反应I:N2(g)+O2(g)
 2NO(g) ΔH1=akJ/mol
2NO(g) ΔH1=akJ/mol反应Ⅱ;2NO(g)+O2(g)
 2NO2(g) ΔH2=bkJ/mol
2NO2(g) ΔH2=bkJ/mol反应Ⅲ:2N2O(g)
 2N2(g)+O2(g) ΔH3=ckJ/mol
2N2(g)+O2(g) ΔH3=ckJ/mol反应Ⅳ:N2O(g)+NO2(g)
 3NO(g) ΔH=
3NO(g) ΔH=(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体。在密闭容器中充入反应物,测得平衡时NO的体积分数与温度、压强的关系如图。

 N2(g)+2CO2(g) ΔH<0,则T1
N2(g)+2CO2(g) ΔH<0,则T1②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有
③在D点,对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的
(3)在催化剂作用下,利用反应C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒容,在相同时间内测得NO的转化率随温度的变化如图所示:
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1100K、1.1×106Pa时,该反应的化学平衡常数Kp=
您最近一年使用:0次



