解题方法
1 . 短周期元素X、Y、Z、M、N、W原子序数依次递增,六种元素形成的一种化合物结构如图所示,其中元素Z最外层电子数为内层电子数的3倍。下列说法错误的是
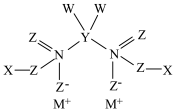

| A.最高价氧化物对应水化物的酸性:W>N>Y |
| B.元素Z与其他五种元素均可形成2种及以上化合物 |
| C.原子半径:M>W>N>Z |
| D.元素Z与M可形成含有非极性共价键的离子化合物 |
您最近一年使用:0次
2023高三·全国·专题练习
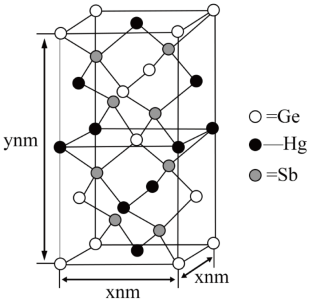
2 . 经理论计算预测,一种由汞( )、锗(
)、锗( )、锑(
)、锑( )形成的新物质X为潜在的拓扑绝缘体材料。X的晶体可视为金刚石晶体中的C原子被
)形成的新物质X为潜在的拓扑绝缘体材料。X的晶体可视为金刚石晶体中的C原子被 、
、 和
和 取代后形成。其晶胞如图所示,下列说法正确的
取代后形成。其晶胞如图所示,下列说法正确的
 )、锗(
)、锗( )、锑(
)、锑( )形成的新物质X为潜在的拓扑绝缘体材料。X的晶体可视为金刚石晶体中的C原子被
)形成的新物质X为潜在的拓扑绝缘体材料。X的晶体可视为金刚石晶体中的C原子被 、
、 和
和 取代后形成。其晶胞如图所示,下列说法正确的
取代后形成。其晶胞如图所示,下列说法正确的
A. 、 、 、 、 三种元素都位于周期表的ds区 三种元素都位于周期表的ds区 |
B.该晶胞中粒子个数比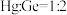 |
C. 原子位于 原子位于 原子构成的四面体空隙中 原子构成的四面体空隙中 |
| D.X晶体是一种合金,内部有自由电子,是电的良导体 |
您最近一年使用:0次
名校
3 . 某化学学习小组经查阅资料发现: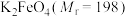 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。
(1)制备 (夹持装置略)
(夹持装置略)

①A为气体发生装置,写出对应的离子方程式_______ 。
②装置B的作用为_______ 。
③装置C中主要反应的化学方程式为_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
①补全方案Ⅰ中实验步骤:取少量a于试管中,_______ ,但该离子的产生不能判断一定是 被
被 还原得到,还可能由
还原得到,还可能由_______ 产生(用离子反应方程式表示)。
②方案Ⅱ可证明 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
③小组同学对比方案Ⅱ实验和 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是_______ 。
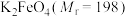 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。现制备高铁酸钾
,在碱性溶液中较稳定。现制备高铁酸钾 ,测定其纯度并探究其性质。
,测定其纯度并探究其性质。(1)制备
 (夹持装置略)
(夹持装置略)
①A为气体发生装置,写出对应的离子方程式
②装置B的作用为
③装置C中主要反应的化学方程式为
(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否是
。为证明是否是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a于试管中,… |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 溶出,得到紫色溶液b;取少量b,滴加盐酸,有 产生。 产生。 |
 被
被 还原得到,还可能由
还原得到,还可能由②方案Ⅱ可证明
 氧化了
氧化了 ,用
,用 溶液洗涤的目的是
溶液洗涤的目的是③小组同学对比方案Ⅱ实验和
 的制备实验发现:
的制备实验发现: 和
和 的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
的氧化性强弱关系相反,请你帮助解释出现矛盾的原因是
您最近一年使用:0次
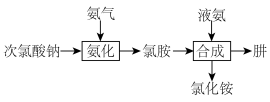
4 . 肼(N2H4)是一种应用广泛的化工原料。工业上合成肼的简易流程如下。
回答下列问题:
I.某小组同学用下列装置完成“氨化”步骤,制备氯胺(NH2Cl)(加热和夹持装置省略)。
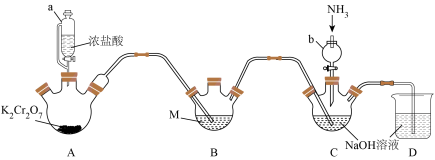
(1)与普通分液漏斗相比,仪器a的优点为________________ ,该仪器使用前需进行的操作为___________________ 。
(2)装置A中发生反应的离子方程式为________________ ,仪器b的作用除导气外,还有_________________ 。
(3)试剂M为___________ (填名称),若省略装置B,造成的后果是_________________ 。
(4)装置C中由次氯酸钠制备氯胺的化学方程式为_______________________ 。
Ⅱ.测定最终所得肼的纯度。
称取0.40g产品配成250mL待测溶液,取25.00mL待测溶液加入20.00mL0.1000mol·L-1碘标准溶液,再加入适量NaHCO3溶液调节pH,待N2H4完全转化为N2后,加盐酸调节溶液的pH并加入少量淀粉溶液,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液的体积为20.00mL(已知: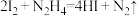 ,
, )。
)。
(5)滴定时盛放Na2S2O3溶液的是___________________ (填“酸式滴定管”或“碱式滴定管”)。
(6)若滴定管用蒸馏水洗涤后,未润洗直接盛放Na2S2O3溶液,最终测得肼的纯度会____________ (填“偏高”“偏低”或“无影响”)。
(7)肼的纯度为___________ 。

回答下列问题:
I.某小组同学用下列装置完成“氨化”步骤,制备氯胺(NH2Cl)(加热和夹持装置省略)。

(1)与普通分液漏斗相比,仪器a的优点为
(2)装置A中发生反应的离子方程式为
(3)试剂M为
(4)装置C中由次氯酸钠制备氯胺的化学方程式为
Ⅱ.测定最终所得肼的纯度。
称取0.40g产品配成250mL待测溶液,取25.00mL待测溶液加入20.00mL0.1000mol·L-1碘标准溶液,再加入适量NaHCO3溶液调节pH,待N2H4完全转化为N2后,加盐酸调节溶液的pH并加入少量淀粉溶液,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液的体积为20.00mL(已知:
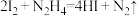 ,
, )。
)。(5)滴定时盛放Na2S2O3溶液的是
(6)若滴定管用蒸馏水洗涤后,未润洗直接盛放Na2S2O3溶液,最终测得肼的纯度会
(7)肼的纯度为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
5 . X、Y、Z、M是电负性逐渐减小的短周期非金属元素。X、Z、M位于三个不同周期,Y与Z的价电子数目之和为M价电子数的两倍;化合物 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是
 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是| A.原子半径:Z<Y<X<M | B.简单氢化物的稳定性:X>Y>M |
| C.Z与M形成的化合物具有较强的还原性 | D.Y的最高价含氧酸为强酸 |
您最近一年使用:0次
6 . 大苏打(Na2S2O3)是一种重要的化工产品,也是实验室常用试剂。某小组对大苏打展开如下探究。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:
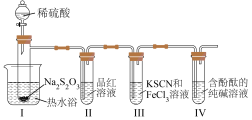
实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是_______ ,其他条件相同时,若拆去热水浴,试管Ⅱ中溶液褪色速率变_______ (填“快”或“慢”)。
(2)装置Ⅰ中的离子方程式为_______ 。
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为 的试剂是
的试剂是_______ 。由试管Ⅳ中现象可知,电离常数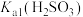
_______ (填“>”“<”或“=”) 。
。
实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
(4)
_______ 。
(5)实验记录: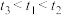 。由实验①②得出的结论是
。由实验①②得出的结论是_______ 。设计实验①③的目的是_______ 。
实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示: 。
。
(6)Na2S2O3∙xH2O中x为_______ 。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:

实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是
(2)装置Ⅰ中的离子方程式为
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为
 的试剂是
的试剂是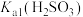
 。
。实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
| 编号 | 0.1mol∙L-1 Na2S2O3溶液的体积/mL | 0.1mol∙L-1 H2SO4溶液的体积/mL | 水的体积/mL | 水浴温度/℃ | 测定变浑浊时间/s |
| ① | 10.0 | 15.0 | 0 | 35 |  |
| ② | 10.0 | 10.0 |  | 35 |  |
| ③ |  | 15.0 | 0 | 45 |  |
(4)

(5)实验记录:
 。由实验①②得出的结论是
。由实验①②得出的结论是实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示:
 。
。(6)Na2S2O3∙xH2O中x为
您最近一年使用:0次
2023-12-15更新
|
198次组卷
|
5卷引用:实验探究题
名校
解题方法
7 . 已知短周期主族元素T、W、X、Y、Z的原子序数依次增大,X的核外电子总数等于T、W的核外电子总数之和。化合物TZ的水溶液呈酸性且可用于刻蚀玻璃。下列说法错误的是
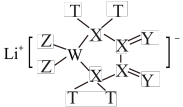

A.加热条件下,Li与单质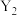 反应的产物为 反应的产物为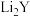 |
| B.简单离子半径:Y>Z>T |
| C.最高价氧化物对应水化物的酸性:W>X |
| D.简单氢化物的稳定性:Z>Y>X |
您最近一年使用:0次
2023-12-14更新
|
387次组卷
|
3卷引用:选择题11-14
8 . 硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备:
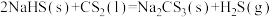
下列说法错误的是
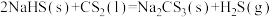
下列说法错误的是
A.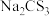 具有还原性 具有还原性 | B. 是直线形非极性分子 是直线形非极性分子 |
C.该反应中 是氧化产物 是氧化产物 | D.电负性: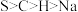 |
您最近一年使用:0次
2023-12-14更新
|
145次组卷
|
3卷引用:选择题6-10
解题方法
9 . 下列实验操作和现象,得出的相应结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有 和 和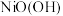 的试管中分别滴加相同浓度的浓盐酸 的试管中分别滴加相同浓度的浓盐酸 | 只有盛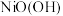 的试管中产生黄绿色气体 的试管中产生黄绿色气体 | 氧化性: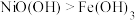 |
| B | 取   溶液于试管中,加入 溶液于试管中,加入   溶液,充分反应后滴入5滴15% 溶液,充分反应后滴入5滴15% 溶液 溶液 | 溶液变为血红色 |  与 与 的反应有一定限度 的反应有一定限度 |
| C | 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 乙烯发生了加成反应 |
| D | 向 溶液中滴加 溶液中滴加 溶液 溶液 | 出现黄色沉淀 |  发生了水解反应 发生了水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 元素镓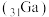 、锗
、锗 )、砷
)、砷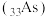 位于周期表中第四周期。下列说法
位于周期表中第四周期。下列说法不正确 的是
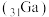 、锗
、锗 )、砷
)、砷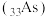 位于周期表中第四周期。下列说法
位于周期表中第四周期。下列说法A.原子半径: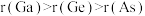 |
B.电负性: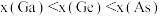 |
| C.Ge、Ga、As都具有半导体性能 |
D.第一电离能: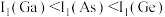 |
您最近一年使用:0次



