解题方法
1 . 汽车工业的发展得益于化工等行业的支撑。
(1)三种可燃物在空气中发生燃烧反应的能量变化示意图如图,你认为可燃物___________ (填“A”、“B”或“C”)更适合用作车用燃料。(已知:燃点是指在规定的条件下,应用外部热源使物质表面起火并持续燃烧一定时间所需的最低温度,燃点较低时存在安全隐患。)

(2)燃油汽车尾气有污染,尾气中 生成过程中的能量变化如图所示。
生成过程中的能量变化如图所示。

生成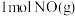
___________ (填“吸收”或“放出”)___________  的热量。
的热量。
(3)利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 ,化学方程式为:
,化学方程式为: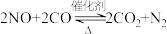
①某温度下,在容积2L的密闭容器中通入CO和NO,测得不同时间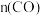 如下表:
如下表:
用 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为___________ 。
②下列可以表明上述反应已达到平衡状态的是___________ 。
a.容器中的气体压强保持不变 b.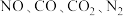 的浓度之比为
的浓度之比为
c. 的浓度不再改变 d.相同时间内,反应消耗
的浓度不再改变 d.相同时间内,反应消耗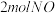 同时消耗
同时消耗
(4)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是______

(1)三种可燃物在空气中发生燃烧反应的能量变化示意图如图,你认为可燃物

(2)燃油汽车尾气有污染,尾气中
 生成过程中的能量变化如图所示。
生成过程中的能量变化如图所示。
生成
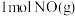
 的热量。
的热量。(3)利用催化技术可将汽车尾气中的
 和
和 转化为
转化为 和
和 ,化学方程式为:
,化学方程式为: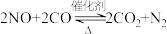
①某温度下,在容积2L的密闭容器中通入CO和NO,测得不同时间
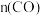 如下表:
如下表:| 时间/s | 0 | 1 | 2 | 3 | …… |
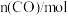 | 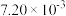 | 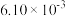 | 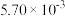 | 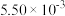 | …… |
 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为②下列可以表明上述反应已达到平衡状态的是
a.容器中的气体压强保持不变 b.
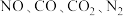 的浓度之比为
的浓度之比为
c.
 的浓度不再改变 d.相同时间内,反应消耗
的浓度不再改变 d.相同时间内,反应消耗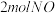 同时消耗
同时消耗
(4)国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是______

A.电池工作时,电解质溶液中的 向b极移动 向b极移动 |
B.a极发生的电极反应为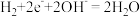 |
| C.b极为正极,发生氧化反应 |
D.当外电路有 电子转移时,b极消耗 电子转移时,b极消耗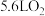 |
您最近一年使用:0次
解题方法
2 . 我国空间站“天和”核心舱太阳翼电池采用自主研发的砷化镓器件,能量转化效率大大提高。已知:砷( )与镓(
)与镓( )同位于第四周期;
)同位于第四周期; 与
与 同主族,
同主族, 与P同主族。
与P同主族。
(1)P在元素周期表中的位置是___________ ,镓的原子结构示意图为___________ 。
(2)非金属性强弱S___________ P(填“大于”或“小于”),下列表述中能证明这一事实的是___________ (填字母)。
a.S的简单氢化物的水溶液比P的简单氢化物的水溶液酸性强
b.S最高价氧化物对应的水化物的酸性强于P最高价氧化物对应的水化物的酸性
c.在反应中,P原子得电子数比S原子得电子数多
d.S的简单阴离子的还原性比P的简单阴离子的还原性弱
(3)下列关于 的推断正确的是
的推断正确的是___________ (填序号)。
① 的最高正价为+5;②原子半径:
的最高正价为+5;②原子半径: ;③元素的金属性:
;③元素的金属性:
(4) ,的酸性由强到弱的关系是
,的酸性由强到弱的关系是___________ 。
(5) 与
与 在一定条件下化合为
在一定条件下化合为 ,用电子式表示
,用电子式表示 的形成过程:
的形成过程:___________ 。
 )与镓(
)与镓( )同位于第四周期;
)同位于第四周期; 与
与 同主族,
同主族, 与P同主族。
与P同主族。(1)P在元素周期表中的位置是
(2)非金属性强弱S
a.S的简单氢化物的水溶液比P的简单氢化物的水溶液酸性强
b.S最高价氧化物对应的水化物的酸性强于P最高价氧化物对应的水化物的酸性
c.在反应中,P原子得电子数比S原子得电子数多
d.S的简单阴离子的还原性比P的简单阴离子的还原性弱
(3)下列关于
 的推断正确的是
的推断正确的是①
 的最高正价为+5;②原子半径:
的最高正价为+5;②原子半径: ;③元素的金属性:
;③元素的金属性:
(4)
 ,的酸性由强到弱的关系是
,的酸性由强到弱的关系是(5)
 与
与 在一定条件下化合为
在一定条件下化合为 ,用电子式表示
,用电子式表示 的形成过程:
的形成过程:
您最近一年使用:0次
名校
3 . 氯及其化合物有重要用途,以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
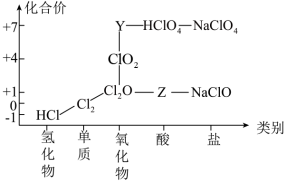
(1)根据图中信息写出Y、Z的化学式:___________ 、___________ 。
(2)已知高氯酸(HClO4)是强酸,写出高氯酸与氢氧化钠反应的离子方程式:___________ 。
(3)2016年巴西奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为NaClO+H2O2=O2 +NaCl+H2O,反应产生的O2促进藻类快速生长。
+NaCl+H2O,反应产生的O2促进藻类快速生长。
①该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”)。
②当标准状况下有5.6LO2生成时,转移电子___________ mol。
(4)Cl2O可用潮湿的Cl2与Na2CO3反应制取,同时生成NaHCO3,反应中Cl2既体现氧化性,又体现还原性,该反应的化学方程式为___________ 。
(5)ClO2具有很强的氧化性,是新的自来水消毒剂,其消毒效率是Cl2的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(6)将一定量的Cl2通入一定浓度的KOH溶液中,两者恰好完全反应,反应过程中有热量放出。反应的生成物中有三种含氯元素的离子,其中ClO-和ClO 两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中氧化产物与还原产物的物质的量之比为
两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中氧化产物与还原产物的物质的量之比为___________


(1)根据图中信息写出Y、Z的化学式:
(2)已知高氯酸(HClO4)是强酸,写出高氯酸与氢氧化钠反应的离子方程式:
(3)2016年巴西奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为NaClO+H2O2=O2
 +NaCl+H2O,反应产生的O2促进藻类快速生长。
+NaCl+H2O,反应产生的O2促进藻类快速生长。①该反应说明氧化性:NaClO
②当标准状况下有5.6LO2生成时,转移电子
(4)Cl2O可用潮湿的Cl2与Na2CO3反应制取,同时生成NaHCO3,反应中Cl2既体现氧化性,又体现还原性,该反应的化学方程式为
(5)ClO2具有很强的氧化性,是新的自来水消毒剂,其消毒效率是Cl2的
(6)将一定量的Cl2通入一定浓度的KOH溶液中,两者恰好完全反应,反应过程中有热量放出。反应的生成物中有三种含氯元素的离子,其中ClO-和ClO
 两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中氧化产物与还原产物的物质的量之比为
两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中氧化产物与还原产物的物质的量之比为
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,回答下列问题:
判断下列六种化合物:①NH3;②N2O;③NO;④N2O3;⑤N2O4;⑥HNO3中:氮元素只能作还原剂的是___________ (填序号,下同);可能是HNO2被还原后产物的是___________ ;不可能是N2被氧化后产物的是___________ 。
(2)下列物质中:①CO2 ②Cl2 ③NH4Cl固体 ④熔融的NaCl ⑤NaOH溶液。
其中属于电解质且能导电的是___________ (填序号); 将③溶于水的电离方程式___________ ;已知标准状况下由①和②组成的混合气体的密度为2.567 g/L,则该混合气体中①和②的体积之比为___________ ;将标况下6.72L的①通入到200mL 2mol/L的⑤中,总反应的化学方程式为___________ 。
(3)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2.发生的反应可表示如下,请完成方程式的配平:
,产物是N2.发生的反应可表示如下,请完成方程式的配平:
________Al+_______ +_________=________AlO
+_________=________AlO +_________N2↑ +________H2O
+_________N2↑ +________H2O________
(1)已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,回答下列问题:
判断下列六种化合物:①NH3;②N2O;③NO;④N2O3;⑤N2O4;⑥HNO3中:氮元素只能作还原剂的是
(2)下列物质中:①CO2 ②Cl2 ③NH4Cl固体 ④熔融的NaCl ⑤NaOH溶液。
其中属于电解质且能导电的是
(3)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2.发生的反应可表示如下,请完成方程式的配平:
,产物是N2.发生的反应可表示如下,请完成方程式的配平:________Al+_______
 +_________=________AlO
+_________=________AlO +_________N2↑ +________H2O
+_________N2↑ +________H2O
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)0.5 molNH3的质量是___________ ,在标准状况下的体积为___________ ,将此气体溶于100 mL水中得到溶液,且溶液密度为a g/mL,则该溶液的物质的量浓度为___________ ;(已知水的密度为1 g/mL)
(2)7.8g Na2X中含有Na+ 0.2 mol,则Na2X的摩尔质量为___________ ;
(3)实验室需要1.0 mol/L NaOH溶液240 mL,根据配制溶液的过程,回答下列问题:
①为完成此溶液配制实验需要的仪器除托盘天平(带砝码)、药匙、烧杯、玻璃棒、量筒、胶头滴管这六种仪器外,还缺少的必要玻璃仪器为___________ (填名称)。
②根据计算用托盘天平称取NaOH的质量为___________ g。
③若取5 mL该溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为___________ mol/L。
(1)0.5 molNH3的质量是
(2)7.8g Na2X中含有Na+ 0.2 mol,则Na2X的摩尔质量为
(3)实验室需要1.0 mol/L NaOH溶液240 mL,根据配制溶液的过程,回答下列问题:
①为完成此溶液配制实验需要的仪器除托盘天平(带砝码)、药匙、烧杯、玻璃棒、量筒、胶头滴管这六种仪器外,还缺少的必要玻璃仪器为
②根据计算用托盘天平称取NaOH的质量为
③若取5 mL该溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为
您最近一年使用:0次
名校
6 . 请回答下列问题:
(1)云、雾属于胶体,鉴别胶体和溶液的方法是___________ ,胶体和溶液的本质区别是___________ 。
(2)钠的焰色试验的焰色为___________ 色;钠着火了不能用水而需要用干燥的沙土来灭火,请用离子方程式来表示其原因___________ 。
(3)过氧化钠是一种___________ 色的固体,可作漂白剂和呼吸面具中的供氧剂,写出过氧化钠和二氧化碳反应的化学方程式,并用双线桥法表示电子转移的方向和数目:___________ 。
(4)小苏打可用于治疗胃酸过多,其原理用离子反应方程式表示为___________
(5)漂白粉是将氯气通入冷的石灰乳中制得的,写出该制备原理的化学方程式___________ 。
(1)云、雾属于胶体,鉴别胶体和溶液的方法是
(2)钠的焰色试验的焰色为
(3)过氧化钠是一种
(4)小苏打可用于治疗胃酸过多,其原理用离子反应方程式表示为
(5)漂白粉是将氯气通入冷的石灰乳中制得的,写出该制备原理的化学方程式
您最近一年使用:0次
解题方法
7 . 利用“价类二维图”可以从不同角度研究含铁物质的性质及其转化关系,图中甲~戊均含铁元素。回答下列问题:

(1)Na2FeO4是一种新型饮用水消毒剂。工业上常用NaClO、Fe(NO3)3、NaOH制备:3ClO-+2Fe3++10OH-=2FeO +3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为
+3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为______ 。
(2)打印机使用的墨粉中含有Fe3O4,下列关于Fe3O4的说法正确的是______ (填标号)。
(3)维生素C易溶于水,可将Fe3+转化为Fe2+被人体吸收。为检验转化产物Fe2+,设计如下实验:取适量Fe2(SO4)3溶液置于试管中,加入过量维生素C片振荡溶解后,滴加酸性高锰酸钾溶液,紫色褪去。该设计方案能否检验Fe2+并说明理由______ 。
(4)丁与烧碱溶液反应可生成乙,在空气中放置一段时间后乙转化为丙。乙转化为丙的现象为______ ,发生反应的化学方程式为______ 。
(5)若用丁溶液经一系列反应来制备Fe2O3。不考虑过程损失,若100mL丁溶液最终制得1.6gFe2O3,变质前丁溶液的物质的量浓度为______ 。

(1)Na2FeO4是一种新型饮用水消毒剂。工业上常用NaClO、Fe(NO3)3、NaOH制备:3ClO-+2Fe3++10OH-=2FeO
 +3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为
+3Cl-+5H2O,该反应中氧化剂与还原剂的物质的量之比为(2)打印机使用的墨粉中含有Fe3O4,下列关于Fe3O4的说法正确的是
| A.有磁性,是FeO与Fe2O3的混合物 |
| B.属于两性氧化物,与酸、碱都能反应 |
| C.Fe3O4与稀盐酸反应生成Fe2+与Fe3+物质的量之比为1:2 |
| D.Fe与水蒸气在高温下反应能生成Fe3O4 |
(4)丁与烧碱溶液反应可生成乙,在空气中放置一段时间后乙转化为丙。乙转化为丙的现象为
(5)若用丁溶液经一系列反应来制备Fe2O3。不考虑过程损失,若100mL丁溶液最终制得1.6gFe2O3,变质前丁溶液的物质的量浓度为
您最近一年使用:0次
8 . 铬及其化合物在工业上用途广泛,回答下列问题:
(1)铁铬液流电池是一种酸性介质中,正、负极活性物质均为液体的化学电池,放电时电池的总反应为: ,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势
,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势_______ b级电势(填“高于”“低于”或“等于”),电池充电时阴极的电极反应为_______ .

(2)含 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含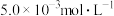 的
的 .为了使废水的排放达标;进行如下处理:
.为了使废水的排放达标;进行如下处理:
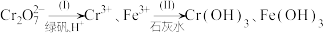
若处理后的废水中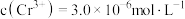 ,则废水中
,则废水中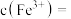
_______  .
.
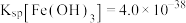 ;
;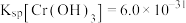 )
)
(3)以铬酸钠( )为原料,用电化学法可制备重铬酸钠(
)为原料,用电化学法可制备重铬酸钠( ),实验装置如图所示
),实验装置如图所示

①阳极的电极反应式为_______
②电解一段时间后,测得阳极区溶液中 物质的量由
物质的量由 变为
变为 ,则生成重铬酸钠的物质的量为
,则生成重铬酸钠的物质的量为_______  。
。
(1)铁铬液流电池是一种酸性介质中,正、负极活性物质均为液体的化学电池,放电时电池的总反应为:
 ,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势
,电池结构原理如图所示,a和b代表电极。电池放电时a级的电势
(2)含
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含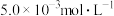 的
的 .为了使废水的排放达标;进行如下处理:
.为了使废水的排放达标;进行如下处理: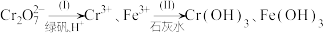
若处理后的废水中
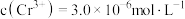 ,则废水中
,则废水中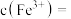
 .
.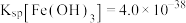 ;
;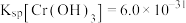 )
)(3)以铬酸钠(
 )为原料,用电化学法可制备重铬酸钠(
)为原料,用电化学法可制备重铬酸钠( ),实验装置如图所示
),实验装置如图所示
①阳极的电极反应式为
②电解一段时间后,测得阳极区溶液中
 物质的量由
物质的量由 变为
变为 ,则生成重铬酸钠的物质的量为
,则生成重铬酸钠的物质的量为 。
。
您最近一年使用:0次
2023-03-02更新
|
203次组卷
|
3卷引用:内蒙古包头市2022-2023学年高二上学期期末考试化学试题
内蒙古包头市2022-2023学年高二上学期期末考试化学试题(已下线)题型03 新型化学电池-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)福建省泉州市永春第一中学2023-2024学年高二下学期开学化学试题
9 . 酸、碱、盐都是电解质,常温下,有以下电解质溶液:
① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦
已知: 的电离常数
的电离常数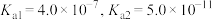
(1)用化学用语解释④呈酸性的原因:_______
(2) 的溶液①中由水电离出的
的溶液①中由水电离出的 为
为_______
(3)浓度均为 的上述7种溶液,
的上述7种溶液,  由大到小为
由大到小为_______
(4)在⑥溶液中下列关系成立的是_______
(5)若某浓度的⑥和⑦的混合溶液中 ,该溶液的
,该溶液的
_______
(6)将 的①溶液与
的①溶液与 的③溶液混合,若所得混合溶液的
的③溶液混合,若所得混合溶液的 ,则①和②溶液的体积比为
,则①和②溶液的体积比为_______
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦
已知:
 的电离常数
的电离常数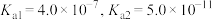
(1)用化学用语解释④呈酸性的原因:
(2)
 的溶液①中由水电离出的
的溶液①中由水电离出的 为
为(3)浓度均为
 的上述7种溶液,
的上述7种溶液,  由大到小为
由大到小为(4)在⑥溶液中下列关系成立的是
A.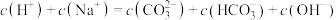 |
B.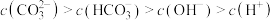 |
C. |
D.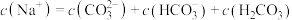 |
 ,该溶液的
,该溶液的
(6)将
 的①溶液与
的①溶液与 的③溶液混合,若所得混合溶液的
的③溶液混合,若所得混合溶液的 ,则①和②溶液的体积比为
,则①和②溶液的体积比为
您最近一年使用:0次
名校
10 . I.用分类思想研究一类物质的通性和特殊性是学习化学的一种重要方法 。按一定方法对物质进行的分类如图所示,请回答下列问题:

(1)上述10种物质中属于电解质的有_________________ (填标号)。
(2)⑦与③反应的化学方程式为_________________ 。
(3)⑩溶于水后形成的 Al(OH)3 胶体能用于净水,鉴别胶体和溶液的方法为_________________ 。
(4)④与NaOH 溶液反应的离子反应方程式_________________ 。
II.如图是元素周期表的一部分。按要求填写下列空白:
(5)元素⑦在周期表中的位置可表示为_______ 。
(6)已知元素③的一种核素,其中中子数为 10,用原子符号表示该核素为__________
(7)元素周期表中与⑤同主族元素中最高价氧化物对应水化物的碱性最强的是(放射性元素除外)_______ (用化学式表示)
(8)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是___________(填字母)。

(1)上述10种物质中属于电解质的有
(2)⑦与③反应的化学方程式为
(3)⑩溶于水后形成的 Al(OH)3 胶体能用于净水,鉴别胶体和溶液的方法为
(4)④与NaOH 溶液反应的离子反应方程式
II.如图是元素周期表的一部分。按要求填写下列空白:
| ① | ||||||||||
| ② | ③ | ④ | ||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(6)已知元素③的一种核素,其中中子数为 10,用原子符号表示该核素为
(7)元素周期表中与⑤同主族元素中最高价氧化物对应水化物的碱性最强的是(放射性元素除外)
(8)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是___________(填字母)。
| A.比较这两种元素单质的沸点 |
| B.比较这两种元素单质与氢气化合的难易 |
| C.比较这两种元素的氧化物对应水化物的酸性 |
| D.比较这两种元素单质与酸或碱反应的难易性 |
您最近一年使用:0次



